氧化高密度脂蛋白及其亚型对人脐静脉内皮细胞组织因子途径抑制物-1表达的影响
彭湘萍 苑 聪 姜志胜 任 重 赵战芝 卜梓斌 唐志晗 刘录山 黄宜娥 聂德波
肖文虎1,2 刘艳文1,2 (吉首大学医学院,湖南 吉首 416000)
组织因子途径抑制物(TFPI)是近年发现的最强的生理性抗凝物质,有两种异构体:TFPI-1和TFPI-2,前者主要由血管内皮细胞合成,在抑制血栓形成和血管重塑等方面发挥重要作用〔1〕。血浆中的天然高密度脂蛋白(HDL)具有直接的抗动脉粥样硬化(AS)和血管保护作用〔2〕。利用密度梯度超速离心可将 HDL 分为 HDL1、HDL2、HDL3三类〔3〕。Asztalos 等〔4〕报道HDL对心血管的保护作用与HDL亚型在血中的相对含量、颗粒大小有关,而HDL亚型分布异常可能是影响AS发生的重要原因。已有学者提出血清HDL亚型组成及含量变化可作为评价AS危险性及其严重程度的一个指标〔5〕。本研究旨在探索oxHDL、oxHDL2、oxHDL3对内皮细胞TFPI-1 mRNA和蛋白表达的影响,为阐明oxHDL及其亚型在AS血栓形成中的作用提供依据。
1 材料与方法
1.1 材料与试剂 人脐静脉内皮细胞HUVEC-12细胞株来源于中南大学湘雅医学院细胞中心;RT-PCR试剂盒(北京博大泰克生物公司);兔抗人TFPI-1多克隆抗体,羊抗兔辣根过氧化物酶标记二抗(Santa cruz);β-actin鼠抗人一抗,兔抗鼠辣根过氧化物酶标记二抗(武汉博士德生物工程有限公司);BCA蛋白定量检测试剂盒(上海捷瑞生物工程有限公司);丙二醛(MDA)试剂盒(南京建成生物工程研究所);引物均由上海生工生物工程服务有限公司合成。其他试剂均为国产分析纯。
1.2 HDL及其亚型的制备、氧化与鉴定 健康人血浆购自衡阳市血站。采用本实验室常规方法〔6〕密度梯度超速离心分离HDL(1.063 ~1.21 g/ml)、HDL2(1.063 ~1.125 g/ml)、HDL3(1.125~1.21 g/ml),固体KBr调密度。将分离的HDL、HDL2、HDL3均分成两部分,一部分用含0.1%EDTA的PBS溶液透析48 h;另一部分同样方法进行透析后,1 mg/ml HDL、HDL2和HDL3分别在37℃与含20 μmol/L CuSO4的PBS溶液孵育24 h进行氧化修饰。BCA法蛋白定量,过滤除菌,4℃保存备用。琼脂糖凝胶电泳法及硫代巴比妥法鉴定oxHDL及其亚型修饰情况。取氧化前后的 HDL、HDL2、HDL3经0.8%琼脂糖凝胶电泳,2.5%考马斯亮蓝常规染色,脱色后可见清晰的脂蛋白和氧化修饰脂蛋白条带,凝胶成像系统扫描收集图像。按MDA试剂盒操作方法,532 nm处可见光分光光度计测各管吸光度值,计算MDA含量。
1.3 逆转录聚合酶链反应 收集细胞,总RNA提取试剂提取总RNA,各标本取0.2 g总RNA按cDNA第一链合成试剂盒说明书进行逆转录。TFPI-1引物序列上游:5'-CAACTCTGATACAAACGTGTTGA-3',下游 5'-CTACTACAATTCAGTCATTGGGA-3',PCR扩增产物长度374 bp;内参照采用GAPGH,引物序列上游 5'-TCACCATCTTCCAGGAGCGAG-3',下游 5'-TGTCGCTGTTGAAGTCAGAG-3',PCR扩增长度为697 bp。PCR反应条件为:94℃预变性 3 min,94℃变性30 s,58℃退火60 s,72℃延伸90 s,35个循环,72℃ 10 min继续延伸。反应结束后,取RT-PCR产物行1.5%琼脂糖凝胶电泳,用凝胶成像分析系统对电泳条带拍照以及分析,以各组目的基因与内参基因的吸光度值的比值比较目的基因mRNA表达差异。每组实验重复3次。
1.4 Western印迹 将变性过的蛋白行聚丙烯酰胺凝胶电泳,分离胶浓度为12%,电泳后半干转移到PVDF膜上,5%脱脂奶粉常温封闭4℃过夜,一抗以最佳浓度稀释后常温2 h或4℃孵育12 h,TBST洗膜3×15 min,洗膜后用相应辣根过氧化物酶二抗常温孵育2 h,TBST洗膜3×15 min,暗室显影。
2 结果
2.1 HDL氧化修饰鉴定 HDL及其亚型经CuSO4孵育后,HDL、HDL2、HDL3中 MAD 含 量 分 别 由 2.82、2.95、3.46 nmol/ml升至 29.23、30.64、37.18 nmol/ml,具有显著性差异(P<0.01)。说明氧化后MDA含量增高,HDL及其亚型发生了氧化修饰。同时,由于阴离子含量增多,氧化修饰后电泳迁移率明显加快,表明已被氧化修饰。见图1。
2.2 不同浓度 oxHDL、oxHDL2、oxHDL3对 HUVECs细胞TFPI-1mRNA表达的影响 不同浓度的HDL、HDL2、HDL3孵育HUVECs细胞24 h后,各浓度组TFPI-1 mRNA表达变化不明显。用不同浓度的 oxHDL、oxHDL2、oxHDL3(10、20、40、80 mg/L)孵育HUVECs细胞24 h后,各浓度组TFPI-1 mRNA的表达均有所减少,其中在oxHDL和oxHDL3各系列浓度中以40 mg/L时作用最明显,TFPI-1 mRNA表达分别为0 mg/L组的72%、51%,下降了28%、49%;在 oxHDL2各系列浓度中以80 mg/L作用最明显,TFPI-1 mRNA表达为0 mg/L组的73%,下降了27%,差异均具有(P<0.05)。见图2。
2.3 不同浓度 oxHDL、oxHDL2、oxHDL3对 HUVECs细胞TFPI-1蛋白表达的影响 与0 mg/L组比较,不同浓度的ox-HDL、oxHDL2、oxHDL3(10、20、40、80 mg/L)组 TFPI-1 蛋白表达减少,其中在oxHDL和oxHDL3各系列浓度中以40 mg/L作用最明显,TFPI-1蛋白表达分别为0 mg/L组的65%、53%,下降了35%、47%;在oxHDL2各系列浓度中以80 mg/L时作用最明显,TFPI-1蛋白表达是0 mg/L组的73%,下降了27%,差异均具有统计学意义(P<0.05)。见图3,表1。
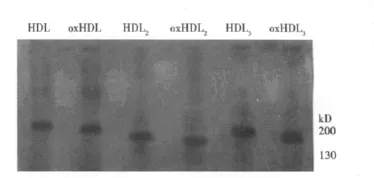
图1 oxHDL、HDL及其亚型琼脂糖凝胶电泳图
表1 不同浓度 oxHDL、oxHDL2、oxHDL3对TFPI-1蛋白表达的影响(s)
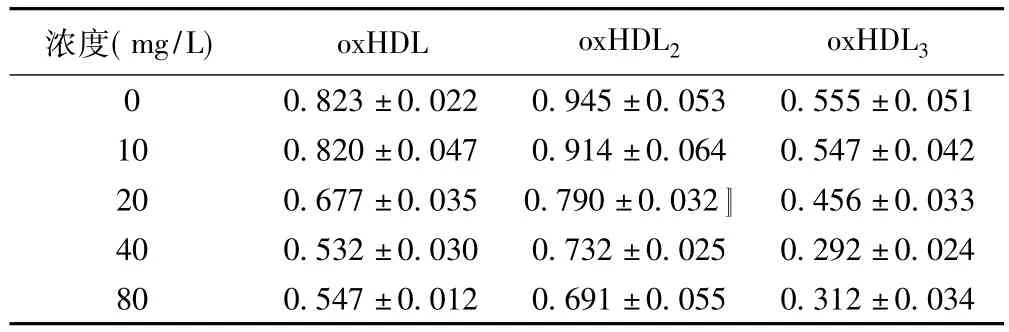
表1 不同浓度 oxHDL、oxHDL2、oxHDL3对TFPI-1蛋白表达的影响(s)
浓度(mg/L)oxHDL oxHDL2 oxHDL3 0 0.823±0.022 0.945±0.053 0.555±0.051 10 0.820±0.047 0.914±0.064 0.547±0.042 20 0.677±0.035 0.790±0.032〛 0.456±0.033 40 0.532±0.030 0.732±0.025 0.292±0.024 80 0.547±0.012 0.691±0.055 0.312±0.034
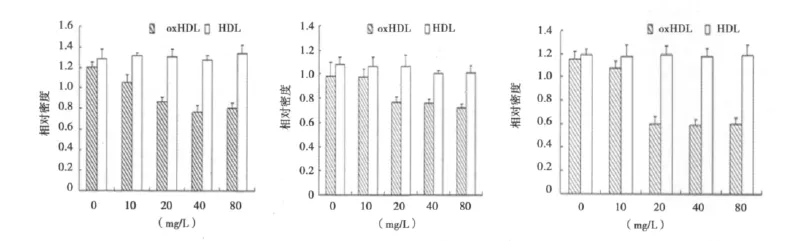
图2 不同浓度oxHDL、oxHDL2、oxHDL3对TFPI-1 mRNA表达的影响
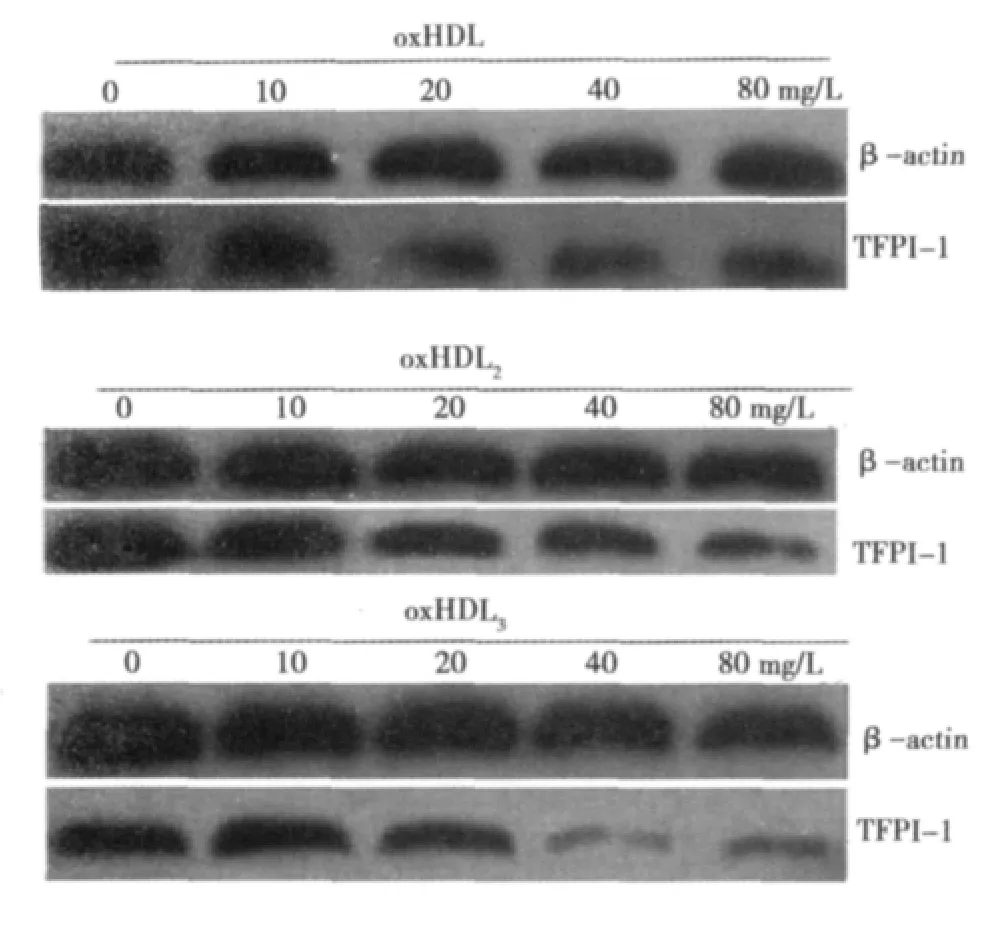
图3 不同浓度oxHDL、oxHDL2、oxHDL3对TFPI-1蛋白表达的影响
3 讨论
oxHDL是导致AS的一个危险因素。HDL发生氧化修饰以后,其化学组成成分、化学性质以及生物学功能均发生变化,转运胆固醇的能力下降,丧失了抑制LDL氧化修饰的能力,破坏凝血和纤溶平衡,引起血小板聚集。促进AS发生。文献报道〔7〕,oxHDL能抑制内皮细胞一氧化氮合酶(NOS)的合成和一氧化氮(NO)的产生,促进内皮细胞释放内皮素-1(ET-1),影响血管正常的舒张和收缩功能。oxHDL可上调血管紧张素转化酶(ACE)表达,使血管紧张素Ⅱ(AngⅡ)生成增多,造成内皮功能不良。体外研究发现,oxHDL引起的凝血酶原时间(PT)及活化部分凝血活酶时间(APTT)明显短于 HDL〔8〕。Giuseppe等〔9〕报道,oxHDL3通过激活有丝分裂原活化蛋白激酶(MAPK)途径,促进内皮细胞纤溶酶原激活物抑制物-1(PAI-1)mRNA表达和相应的抗原生成,加速血栓形成。
本研究发现oxHDL及其亚型能抑制HUVECs TFPI-1 mRNA和蛋白表达,其中oxHDL3的作用最强。TFPI是外源性凝血途径起始步骤的生理性抑制物,是目前唯一能抑制组织因子(TF)活性的生理活性物质,TFPI-1对AS及其并发症有拮抗作用。文献报道,在AS斑块破裂之前,TFPI和TF同时出现在坏死区周围的巨噬细胞以及纤维帽的血管内皮细胞、平滑肌细胞中,但在脂质丰富区却只有TF而没有TFPI,提示如果缺乏TFPI对TF的抑制作用,易引起 AS并发症〔10〕。Westrick 等〔11〕通过对小鼠的研究发现TFPI能有效地防止AS的发生并能减少血栓的形成。内源性TFPI-1活性降低可促进血栓形成〔12〕。研究发现,心肌梗死、冠状动脉局部缺血等疾病中,血浆中TFPI-1水平较高,TFPI-1水平增高可抑制TF引起的血栓形成〔13〕。陈莹等〔14〕研究结果表明,急性冠脉综合征患者 TF、TFPI水平较稳定型心绞痛病人和对照组明显增高,提示存在凝血机制异常。
本课题组前期研究发现oxHDL及其亚型可呈浓度和时间依赖性增加TF的表达,作用强弱不一,以oxHDL3的效应最显著〔15〕。本实验结果结合前期研究提示oxHDL及其亚型诱导血管内皮细胞表达TF、抑制TFPI-1可能是AS血栓形成的重要机制,而oxHDL3似在其中扮演着更重要的角色。脂蛋白氧化修饰后不仅影响血管内皮细胞TF的分泌,也可影响血管内皮细胞TFPI-1的表达;而TFPI-1作为重要的体内抗凝物质,其表达下降;对TF的抑制作用降低,体内抗凝/促凝平衡被打破,抗凝作用减弱,促进血栓的形成,从而可能加速了AS的进程。
1 Pedersen B,Holscher T,SatoY,et al.A balance between tissue factor and tissue factor pathway inhibitor is required for embryonic development and hemostasis in adult mice〔J〕.Blood,2005;105(7):2777-882.
2 Young CE,Karas RH,Kuvin JT.High-density lipoprotein cholesterol and coronary heart disease〔J〕.Cardiol Rev,2004;12(2):107-19.
3 Lund-Katz S,Liu L,Thuahnai ST,et al.High density lipoprotein structure〔J〕.Front Biosci,2003;8(1):d1044-54.
4 Asztalos BF,Schaefer EJ.High-density lipoprotein subpopulations in pathologic conditions〔J〕.Am J Cardiol,2003;91(7A):12E-17E.
5 Thorne RF,Mhaidat NM,Ralston KJ,et al.CD36 is a receptor for oxidized high density lipoprotein:Implications for the development of atherosclerosis〔J〕.FFBS Lett,2007;581(6):1227-32.
6 赵战芝,姜志胜,卜梓斌,等.ox-LDL3、ox-LDL诱导THP-1单核源性巨噬细胞表达 IL-1β、IL-6、HLA-DR、CD86〔J〕.中国免疫学杂志,2008;24(4):365-70,373.
7 刘录山,危当恒,杨永宗.高密度脂蛋白和氧化型高密度脂蛋白对ECV2304分泌一氧化氮、一氧化氮合酶和内皮素1的影响〔J〕.中国动脉粥样硬化杂志,2002;10(5):421-3.
8 邓祖跃,刘秉文,周 静,等.脂蛋白的氧化修饰对血凝及纤溶活性的影响〔J〕. 中国病理生理杂志,2004;20(10):1773-7.
9 Giuseppe N,Cristina B.Oxidised-HDL3 induces the expression of PAI-1 in human endothelial cells:role of p38MAPK activation and mRNA stabilization〔J〕.Br J Haematol,2004;127(1):97-104.
10 Dahm A,Van Hylckama Vlieg A,Bendz B,et al.Low levels of tissue factor pathway inhibitor(TFPI)increase the risk of venous thrombosis〔J〕.Blood,2003;101(11):4387-92.
11 Westrick RJ,Bodary PF,Xu Z,et al.Deficiency of tissue factor pathway inhibitor promotes at herosclerosis and t hrombosis in mice〔J〕.Circulation,2001;103(25):3044-6.
12 Kato H.Regulation of functions of vascular wall cells by tissue factor pathway inhibitor:basic and clinical aspects〔J〕.Arterioscler Thromb Vasc Biol,2002;22(4):539-48.
13 Colino P,Ravera A,Ragni M,et al.Involvement of tissue factor pathway inhibitor in the coronary circulation of patients with acute coronary syndromes〔J〕.Circulation,2003;108(23):2864-9.
14 陈 莹,刘复强,志 文,等.急性冠脉综合征患者P-selectin、TF、TFPI水平的研究〔J〕. 中国现代医学杂志,2008;18(17):2551-6.
15 卜梓斌,姜志胜,马珍妮,等.氧化型高密度脂蛋白通过MAPKs信号转导途径诱导ECV304细胞表达组织因子〔J〕.中国病理生理杂志,2009;25(4):636-41.

