柱层析法纯化灯盏乙素的研究
肖俊辉 姚 旭* 刘运美* 王小平 唐昌云 周 洋 郑 兴*
(1 南华大学附属第二医院,湖南 衡阳 421001;2 南华大学药学科研兴趣小组,湖南 衡阳 421001)
灯盏乙素又名黄芩素苷(scutellarin),即4',5,6-三羟基黄酮-7-葡糖醛酸苷,是灯盏花治疗脑血管疾病所致瘫痪的主要有效成分,在灯盏花素中一般占90%左右。研究表明,灯盏乙素具有改善微循环,调节血脂,提高心肌功能,清除氧自由基等广泛的药理作用[1-4]。现在市售的灯盏乙素多为纯度为90%左右的粗品,为获得高纯度的灯盏乙素,我们分别以大孔树脂、聚乙酰胺、硅胶为填料,探讨通过柱层析法获得高纯度灯盏乙素的最佳方案。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪(日本岛津公司LC2010A型);电子分析天平BT25S(日本岛津公司);旋转蒸发仪(BUCHI R-124);CQ250超声波清洗器(上海必能信超声有限公司);层析柱(2.5×40cm)。
市售灯盏乙素(云南植物药业有限公司);灯盏乙素标准品(中国药品生物制品检定所);甲醇(色谱纯,天津市科密欧化学试剂有限公司);硅胶100~200目,200~300目(中国医药上海化学试剂公司);大孔树酯D-101,AB-8(北京慧德易科技有限公司);聚乙酰胺30-60目(台州市路桥四甲生化塑料厂);水为双蒸水;其他试剂均为分析纯。
1.2 填充材料的预处理
硅胶于105℃烤2h,置干燥器中冷却;大孔树脂用乙醇浸泡24h,再水洗至无醇味;聚乙酰胺乙醇浸泡24h后用10%的醋酸和5%的NaOH处理。
2 方 法
2.1 薄层色谱法(TLC)定性和半定量分析
实验采用玻璃板为载板,硅胶G为固定相,V(C4H8OH)∶V(CH3COOH)∶V(H2O)=4∶1∶5混合液为流动相,碘蒸气显色。
2.2 高相液相色谱法(HPLC)
2.2.1 色谱条件
色谱柱为Diamonsil C18柱(4.6mm×250mm,5μm),流动相为V(CH3OH)∶V(0.1%H3PO4)=60∶40,流速为1.0mL/min,检测波长为335nm,柱温为室温,进样量为10μL[5-7]。
2.2.2 标准曲线的制备
精密称取灯盏乙素标准品10mg,于比色管中甲醇定容至10mL,即浓度为1mg/mL对照品溶液。分别取0.25、0.5、1、1.5、2.0、2.5mL稀释至10ml,配成0.025、0.05、0.1、0.15、0.2、0.25mg/mL系列标准液,进样测得峰面积。以峰面积(Y)与进样浓度(X)进行线性回归,得回归方程为Y =1.0×107X-602 511,r=0.9981,线性范围25.00~250.00μg/mL。
2.2.3 精密度实验
精密量取0.05、0.1、0.2mg/mL的灯盏乙素标准品溶液按上述色谱条件,分别重复5次。计算RSD值分别为0.14%、0.18%、0.24%,表明测定方法精密度良好。
2.2.4 稳定性实验
精密量取0.1%标准品液分别与0、1、2、4、6、8h内进样测定。测得RSD值为0.32%,表明灯盏乙素样品液在8h内稳定。
3 结果与讨论
3.1 大孔树脂的动态吸附洗脱
取大孔树脂D-101,AB-8装柱,精密称取样品0.25g,置烧杯中,加NaHCO3/NaOH缓冲液5ml,60℃水浴加热搅拌至完全溶解,上样,用10%乙醇洗脱,收集洗脱液,浓缩至约5mL,加入10倍体积丙酮沉淀,静置30min,过滤,沉淀用40%丙酮搅拌溶解,待完全溶解后用稀盐酸酸化至pH=2,静置30min,过滤,滤渣水洗至中性,真空干燥。称重,HPLC检测纯度。按上述过程,大孔树脂D-101,AB-8各重复3次,求平均值。结果见表1。
3.2 聚乙酰胺的动态吸附洗脱
取30~60目聚乙酰胺装柱,精密称取灯盏乙素样品1.0g,上样,分别用不同浓度乙醇梯度洗脱。根据TLC监测结果,收集洗脱液。将洗脱液浓缩,真空干燥。称重,进行HPLC分析。按上述过程,重复3次,求平均值。结果见表1。
3.3 硅胶的动态吸附洗脱
通过薄层色谱法比较了不同比例的二氯甲烷、甲醇作流动相时,主成份的比移值Rf、杂质组份的比移值Rf′、比移值差ΔRf及相对比移值,结果发现当V(CH2Cl2)∶V(CH3OH)=5∶1时较适宜硅胶柱的动态吸附洗脱。
分别取100~200目和200~300目硅胶干法装柱,称取灯盏乙素样品0.25g,上样,V(CH2Cl2)∶V(CH3OH)=5∶1常压洗脱。根据TLC监测结果,收集洗脱液,浓缩,真空干燥。称重,HPLC分析。按上述过程,100~200目和200~300目各重复3次,求平均值。结果见表1。

表1 不同固定相吸附效果
由表1可以看出:硅胶和大孔树脂对灯盏乙素纯化效果均较好,但大孔树脂的产率明显较硅胶低,且操作步骤繁琐,易造成原料损失。因此该条件下大孔树脂用于灯盏乙素的分离精制存在缺陷,而用硅胶柱精制灯盏乙素有如下优点:①工艺流程简单,且纯化效果明显。②经200-300目的硅胶分离后,其纯度达到98%以上,且收率相对较高。
硅胶柱纯化前后成分变化的HPLC分析结果分别见图1、图2。
4 结 论
固定相为200~300目硅胶,流动相为V(CH2Cl2)∶V(CH3OH)=5∶1时,灯盏乙素能获得较好的纯度和收率,且该方法成本低,操作简单。

图1 未处理前样品的HPLC图谱
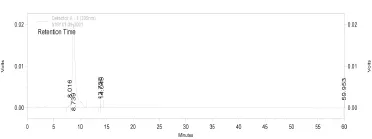
图2 经200~300目硅胶处理后样品的HPLC图谱
[1]孟庆峰,刘国安.灯盏细辛注射液的临床应用进展[J].云南中医中药杂志,2008,29(2): 24-34.
[2]张春霞,康立源,胡利民,等.灯盏细辛中黄酮类成分药理活性的研究进展[J].中国新药杂志,2008,17(2): 110-113.
[3]李丽,刘东阳,江骥,等.灯盏乙素药理学研究进展[J].中草药,2006,37(8): 附9-11.
[4]林春,刘鸿高,余选礼,等.药用植物灯盏花的研究进展[J].中国野生植物资源,2003,22(1): 8-11.
[5]姚旭,刘运美,罗星,等.灯盏乙素提纯工艺的正交设计实验优选[J].时珍国医国药,2009,20(10): 2520-2521.
[6]刘鹏,周军,秦向阳,等.HPLC法测定不同产地灯盏细辛中灯盏乙素的含量[J].第四军医大学学报,2006,27(9): 187-387.
[7]李勇军,何迅,兰燕宇,等.高效液相色谱法测定辛芍注射液中野黄芩苷的含量[J].中外健康文摘:医药月刊,2007,4(8): 50-52.

