美洛昔康对大鼠肝缺血再灌注损伤的影响
朱秋伟 刘意 朱 晟
(常州市第二人民医院普外科,江苏 常州 213001)
在肝脏外科中,肝脏缺血再灌注损伤是一个常见的问题,也是导致术后肝功能衰竭的重要原因。近年来研究发现缺血再灌注导致肝脏损伤的机制与细胞能量代谢障碍、线粒体功能受损、细胞内钙超载、氧自由基产生、一些细胞因子的合成与释放等有关。COX-2作为一种与损伤关系密切的活性蛋白酶,参与肝缺血再灌注损伤的过程,其具体表达以及COX-2抑制剂在肝缺血再灌注损伤的过程中的作用值得深入研究。本实验旨在通过研究COX-2抑制剂美洛昔康对肝脏缺血再灌注损伤的保护作用,为临床缺血再灌注损伤的预防和治疗提供新的思路和方法。
1 材 料
1.1 试剂
美洛昔康( 昆山龙灯瑞迪制药);哺乳动物组织和细胞抽提物蛋白酶抑制剂(Manmalian protease inhibitor mixture 100x)、哺乳动物组织蛋白质抽提试剂(上海串俞博彩生物科技有限公司);兔抗ERK,P-ERK(美国Biovision公司),COX-2多克隆抗体(美国Iabvision公司),HRP标记羊抗兔IgG抗体(上海英基生物科技有限公司),超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(南京建成生物工程研究所)
1.2 实验动物
健康雄性SD大鼠30只,体质量(300±20)g,随机分为A组(美洛昔康组),B组(缺血再灌注组)C组(手术对照组)每组10只动物。
2 方法与结果
2.1 方法
2.1.1 动物模型的建立
手术前12h动物开始禁食而自由饮水,腹腔内注射戊巴比妥钠(30mg/kg)麻醉后,常规消毒、铺巾,上腹正中切口逐层进腹,分离肝门,无损伤动脉夹阻断肝脏中叶、左叶血供,90min后恢复缺血肝叶血供,建立部分肝脏I/R模型,切口用1号线缝合。A组于缺血前30min经腹腔注射美洛昔康(3mg/kg);B组于缺血前30 min 经腹腔注射等量生理盐水;C组仅作麻醉、开腹、不阻断血流。
2.1.2 肝组织中COX-2检测
采用Western Blot半定量分析检测肝组织中COX-2表达情况。
2.1.3 肝脏组织学检查
取左叶中部肝组织,经10%甲醛固定石蜡包埋,切成4μm 厚的切片,HE染色,用普通光学显微镜检查形态学改变情况。
2.1.4 肝功能检测
血丙氨酸氨基转换酶(ALT),天冬氨酸氨基转换酶(AST),乳酸脱氢酶(LDH)水平:应用Olympus Au2700全自动生化分析仪(日本)进行分析,判定肝脏功能改变情况。
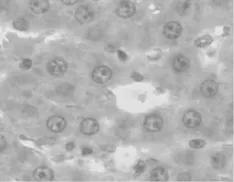
图1 C组 HE ×400
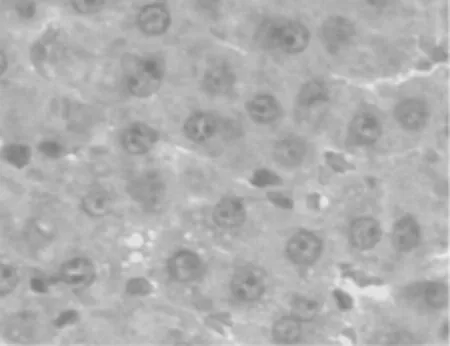
图2 A组 HE ×400
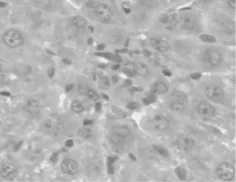
图3 B组 HE ×400
2.1.5 超氧歧化酶活性(SOD)和丙二醛(MDA)的含量测定
肝组织中的超氧歧化酶活性(SOD)和丙二醛(MDA)的含量采用超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒进行检测,操作按试剂盒说明进行。
2.1.6 统计学方法
用SPSS 10.0软件行方差齐性检验、方差分析,组间比较采用LSD法。
2.2 结果
2.2.1 肝脏缺血再灌注6h后血清中ALT、AST水平
再灌注6h后,A组和B组的ALT、AST均升高:血清中ALT、AST水平B组显著高于C组(P<0.01),A组显著低于B组(P<0.01)。见表1。
表1 各组大鼠再灌注6h血清ALT、AST水平(±s)
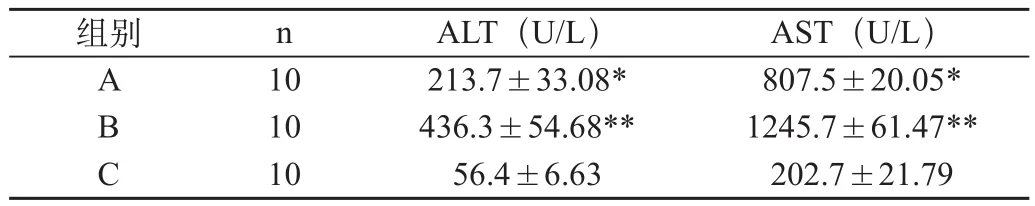
表1 各组大鼠再灌注6h血清ALT、AST水平(±s)
注:与B组比较,*P<0.01; 与C组比较,**P<0.01
组别 n ALT(U/L)AST(U/L)A 10 213.7±33.08* 807.5±20.05*B 10 436.3±54.68** 1245.7±61.47**C 10 56.4±6.63 202.7±21.79
2.2.2 肝脏超氧歧化酶活性(SOD)的活性
缺血再灌注6h,B组大鼠肝脏SOD活性明显高于C组(P<0.01),美洛昔康可明显降低缺血再灌注后升高的SOD活性(P<0.01)。见表2。
表2 各组大鼠再灌注6 h肝组织MDA及SOD的活性(±s)
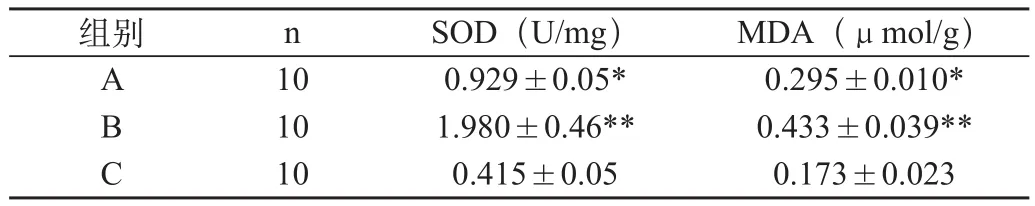
表2 各组大鼠再灌注6 h肝组织MDA及SOD的活性(±s)
注:与B组比较,*P<0.01; 与C组比较,**P<0.01
组别 n SOD(U/mg)MDA(μmol/g)A 10 0.929±0.05* 0.295±0.010*B 10 1.980±0.46** 0.433±0.039**C 10 0.415±0.05 0.173±0.023
2.2.3 肝组织内丙二醛(MDA)的含量
缺血再灌注6h,B组大鼠肝脏MDA的含量明显高于C组(P<0.01),美洛昔康可明显降低缺血再灌注后组织中MDA的含量(P<0.01)。见表2。
2.2.4 肝脏组织病理学观察(图1~3)
B组大鼠肝细胞及肝窦内皮细胞水肿,肝细胞索结构紊乱,肝组织内大量中性粒细胞聚集、浸润,肝窦狭窄甚至闭塞。A组肝脏水肿程度明显轻于B组,肝窦仍然保持通畅。C组为正常肝组织表现。
2.2.5 肝脏VEGF蛋白表达(图4)
C大鼠肝组织VEGF仅有微弱表达;B组表达较A组明显增强;C组可以降低缺血再灌注后肝脏VEGF表达,与B组比较明显减弱。
3 讨 论
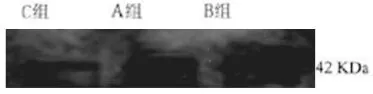
图4 肝组织中COX-2表达情况
肝脏缺血再灌注损伤是肝脏手术过程中常见的、多因素参与的病理生理变化,是导致肝脏外科术后肝功能衰竭甚至死亡的主要原因。在肝脏缺血再灌注过程中,早、中期损伤通常发生在再灌注之后0~6h,各种炎性因子显著升高,肝功能损害较为明显[1,2]。本实验中以再灌注后6h作为观察时间点,可确切反映大鼠肝脏缺血再灌注后的肝组织损伤情况以及肝功能状况。氧自由基可氧化细胞内的脂质、蛋白质和核酸,导致细胞损伤、死亡[3]。肝内MDA的含量及SOD的活性可以反映肝细胞的损伤情况。本研究中发现,肝脏缺血再灌注后6h,肝脏内有较多中性粒细胞浸润,肝脏MDA的含量及SOD活性明显升高,出现严重的肝组织损害。病理观察发现,肝细胞及肝窦内皮细胞水肿明显,出现明显的肝功能损害,ALT,AST水平明显升高。
环氧化酶(COX)是一类具多重功能的跨细胞膜依赖性结合蛋白。其主要功能是催化AA生成类花生酸,如各种前列腺素(prostaglandins,PGs)、凝血烷A2(thromboxaneA2,TXA2)和白细胞三烯(1eukotrienes,LTs)等物质。目前已明确,其至少有两种亚型,即COX-1和COX-2。COX-2则主要与炎性反应相关,主要在巨噬细胞和肥大细胞内表达,炎症过程中释放的细胞因子是COX-2的有效诱导剂。COX-2被大量诱导和表达,反过来又可引起炎症的放达和增强。在本实验中肝脏缺血再灌注时期的COX-2表达增强,肝组织病理损害以及肝功能损害明显严重。通过应用COX-2抑制剂(美洛昔康),肝组织内COX-2表达明显减弱,肝损伤较前明显减轻,说明COX-2参与肝缺血再灌注损伤,其可能通过COX途径抑制前列腺素产生,减少ROS生成,阻止白细胞迁徙及减少膜降解产物的生成有关。Ganey等和Mathurin等研究证实,COX-2表达下调可以减轻肝脏炎症反应;特异性的COX-2抑制荆能减轻肝脏缺血再灌注损伤[4,5]。Ito等[6]发现在阻断大鼠肝动脉和门静脉致部分肝脏缺血再灌注损伤的研究中发现,COX-1抑制剂和COX-2抑制剂能相对减少TNF-a和TXs的产生,从而起到降低肝脏的炎性反应程度和改善肝血窦微循环的作用。
本研究在建立大鼠肝脏热缺血再灌注损伤的基础上,观察肝组织中COX-2表达与再灌注损伤之间的关系,以及其抑制剂美洛昔康对缺血再灌注损伤的影响。发现缺血再灌注6h后,A组大鼠血清中的ALT,AST和肝组织中的MDA、SOD活性分别显著低于B组大鼠血清中的ALT,AST和肝组织中的MDA、SOD活性;B组大鼠肝组织发生了显著的病理改变,而A组大鼠的肝组织结构接近正常组织,病理改变不明显。表明,COX-2抑制剂美洛昔康对缺血再灌注造成的肝功能下降有显著的缓解作用,对肝组织损伤有明确的保护作用。
本实验提示,COX-2抑制剂美洛昔康可以显著降低肝脏中COX-2的活性,减轻肝缺血再灌注损伤,缓解移植肝功能下降,是预防和减轻肝缺血再灌注损伤的有效方法之一,同时也为肝缺血再灌注损伤的保护方法提供了理论依据。
[1]Fondevila C,Busuttil RW,Kupiec-Weglinski JW.Hepaticischemia/reperfusion injury:a fresh look[J].Exp Mol Pathol,2003,74 (2):86-93.
[2]Serracino-Inglott F,Habib NA,Mathie RT.Hepatic ischemia reperfusion injury[J].Am J Surg,2001,181 (2):160 -166.
[3]Young C,Tenkova T,Dikranian K,et al.Excitotoxic versus apoptotic mechanisms of neuronal cell death inperinatal hypoxia/ischemia[J].Curr Mol Med,2004,4 (2):77-85.
[4]Hamada T,Tsuchihashi S,Avanesyan A,et al.Cyclooxygenase-2 deficiency enhances Th2 immune responses and impairsneutrophil recruitment in hepatic ischemia/reperfusioninjury[J].J Immunol,2008,180(3):1843-1853.
[5]Ozturk H,Gezici A,Ozturk H.The effect of celecoxib,aselective COX-2 inhibitor on liver ischemia/reperfusion-induced oxidative stress in rats [J].Hepatol Res,2006,34(2):76-83.
[6]Ito Y,Katagiri H,Ishii K,et a1.Effects of selective cyclooxygenase inhihitors on ischemia/reperfusion-induced hepatic microcirculatory dysfunction in mice[J].Eur Surg Res,2003,35(5):408-416.

