Fe2+对碳钢硫酸盐还原菌腐蚀行为的影响
汪 崧, 李晓刚, 黄一中, 杜翠薇
(1. 北京科技大学 材料研究院腐蚀与防护中心,北京100083;2. 牛津大学 材料学院,英国牛津OXI3PH)
由于微生物活动造成的金属降解被称为微生物腐蚀(MIC)[1],微生物腐蚀取决于细菌、金属与生物膜之间的交互作用[2]。硫酸盐还原菌(SRB)是参与厌氧微生物腐蚀的主要菌种,SRB 是一类能够通过硫酸盐呼吸获取能量的原核微生物功能类群,它以氢为直接电子供体,将硫酸盐还原为硫化物[3]。由SRB 引起的铁及其合金的厌氧微生物腐蚀给工业生产造成很多问题,涉及范围包括核电站[4,5],石油工业[6],海洋结构[7],船舶[8]等。
SRB 腐蚀的影响因素主要包括介质的pH 值,溶解氧浓度,Cl-浓度,Fe2+浓度等。由于生物膜会阻碍反应物及产物的扩散过程,当表面有生物膜时,铁的溶解会导致金属与生物膜的界面处Fe2+浓度高于周边环境。已有研究结果显示,Fe2+会在生物膜中富集[9],使细菌数量显著增加[10],生物膜中的铁离子被认为具有催化剂功能[1]。随Fe2+浓度从10ml/L 增加到60ml/L,阴极电流和阳极电流急剧增加,同时极化电阻则急剧降低[3]。已有的工作主要采用电化学阻抗、极化曲线等测试界面电化学行为,采用扫描电镜、能谱等获取表面形貌及成分,对SRB 腐蚀进行过程、金属生物膜界面和生物膜内部结构的研究未见报道。
为了更好的了解SRB 的腐蚀行为,本工作跟踪观察了碳钢在没有Fe2+离子的培养基和有Fe2+离子的培养基中的SRB 腐蚀过程,对碳钢在两种介质中的腐蚀行为、腐蚀产物、金属生物膜界面及生物膜内部结构进行了对比分析。
1 实验
1.1 实验材料
试样采用Q235 钢,其主要化学成分(质量分数/%)为C 0.26,Si 0.063,Mn 0.56,P 0.009,S 0,0.031,余量为铁。将Q235 钢加工成10 mm ×10 mm×5mm 的片状试样,打磨除锈除油后焊接引出铜导线,用环氧树脂冷镶作为工作电极,工作电极的工作面积为1cm2。实验前依次用200#,400#,600#和800#SiC 纸逐级打磨,表面抛光处理,无水乙醇除油,吹干备用。实验前将工作电极和电解池放入无菌操作箱中,用75%无水乙醇水溶液消毒,吹干,在紫外灯下照射30min 杀菌。
1.2 实验介质
本实验所用介质为不含Fe2+接菌培养基(以下简称培养基I)和Fe2+含量为30mg/L 的接菌培养基(以下简称培养基II)。培养基I 配方(g/L)为K2HPO40.5,NH4Cl 0.5,Na2SO40.5,CaCl20.076,Mg2SO4·7H2O 2.0,乳酸钠3.5,酵母粉1.0,维生素C 0.1,保险粉0.1,培养基II 在培养基I 的基础上再加入FeSO4·6H2O 0.138 g/L。其中维生素C、保险粉(巯基乙酸)、硫酸亚铁(用于培养基II)依次溶于去离子水,在生物安全柜中使用紫外灯灭菌30分钟后使用过滤灭菌器过滤灭菌。其它组份依次溶于去离子水,在高压灭菌锅中121℃湿热灭菌20min,取出后置于生物安全柜中冷却至室温,然后与过滤灭菌的溶液混合,配制成灭菌培养基。在配好的灭菌培养基中按比例接种激活并培养3 天的SRB 菌液,制成实验所用的介质。
1.3 电化学实验
将准备好的工作电极浸入两种实验介质中,记录浸泡时间为1h,15h,38h 及65h 工作电极的电化学阻抗谱。电化学阻抗(EIS)的测定条件为:自腐蚀电位下扰动为5mV,扫描频率范围100kHz ~10mHz。以上实验内容使用Princeton Applied Research 出品的VMP3 完成。参比电极为饱和甘汞电极,甘汞电极通过饱和氯化钾盐桥与实验介质相接触。辅助电极为石墨电极。
1.4 形貌观察及成分分析
在浸泡过程中使用Leica 广视野金相显微镜观察Q235 钢工作电极表面形貌的变化。浸泡实验结束后取出工作电极,去离子水清洗后吹干。用FEI FIB200 聚焦离子束显微镜观察试样表面形貌,并对表面腐蚀产物进行切割,观察腐蚀产物层的内部结构及腐蚀产物与金属基体界面的形貌。使用Thermo 能谱对腐蚀产物进行成分分析。
2 结果与讨论
2.1 电化学阻抗谱
为研究Fe2+对Q235 钢SRB 腐蚀过程中电极/溶液界面电化学行为的影响,测试了Q235 钢在培养基Ⅰ和培养基Ⅱ中的电化学阻抗谱,结果如图1所示。
在培养基Ⅰ中,浸泡15h 及以后时间常数基本相同,低于但接近于浸泡1h,说明系统稳定性有所降低但变化不大。不同浸泡时间|Z| ~log Freq 曲线位置基本不变,表明系统的电容特性接近,但浸泡15h 及以后阻抗远高于浸泡1h,此时表面可能形成了一层高阻抗低电容的隔绝层。
在培养基Ⅱ中,时间常数随时间延长而降低,浸泡65h 的时间常数远低于在培养基Ⅰ中浸泡65h,这表明在培养基Ⅱ中系统稳定性持续下降,浸泡65小时后腐蚀较培养基Ⅰ严重。|Z| ~log Freq 曲线随时间延长向低频方向移动,系统的电阻特性减小,电容特性增加,此时表面可能形成了一层低电阻高电容的膜层,较培养基Ⅰ中形成的膜层保护性差。
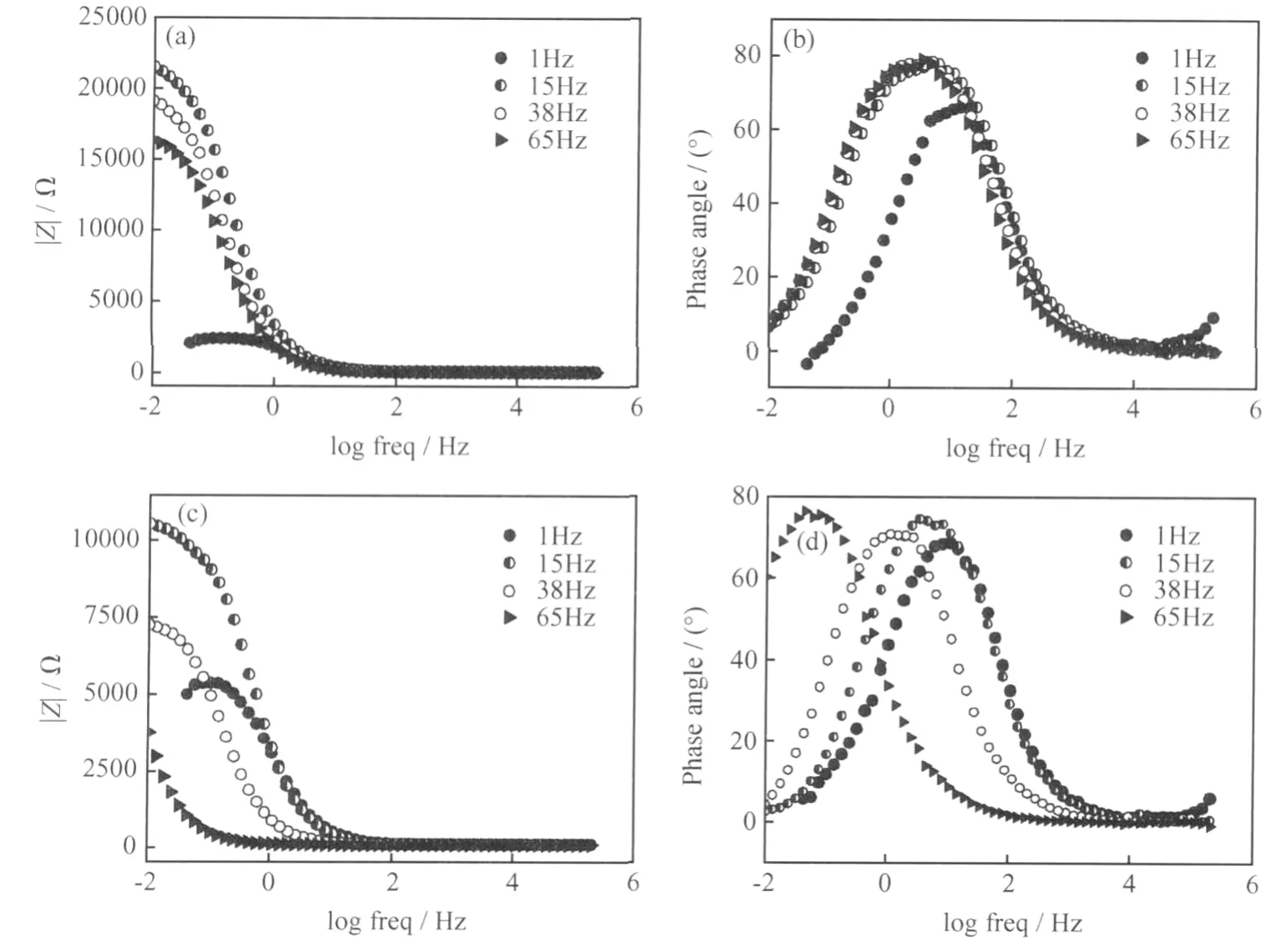
图1 Q235 钢在两种培养基中的电化学阻抗谱(a),(b)培养基Ⅰ;(c),(d)培养基ⅡFig.1 EIS of Q235 steel immersed in two cultures (a),(b)culture Ⅰ;(c),(d)culture Ⅱ
从图1 可见,浸泡15h 及以后,阻抗及时间常数和浸泡1h 相比均有较大不同,说明此时电极表面状态发生了变化,可能是由于表面覆盖了完整的生物膜。金属表面生物膜的形成是一个积累过程,当金属浸入到水环境中便立即开始。在很短的时间内(几分钟或者几小时,取决于金属浸没的水环境),微生物及其产物EPS 形成生物膜[11]。为进一步分析电化学阻抗谱,采用图2 中的两个等效电路对培养基Ⅰ和培养基Ⅱ中的电化学阻抗谱进行拟合。浸泡1h,试样表面生物膜覆盖少,用图2a 中的等效电路拟合;浸泡15h及以后,生物膜覆盖试样表面,用图2b 中的等效电路拟合,拟合结果见图3。

图2 用于拟合图4中电化学阻抗谱的等效电路Fig.2 Equivalent circuit used to adjust the Nyquist spectra of Fig.4(a)1h;(b)15h,38h,65h
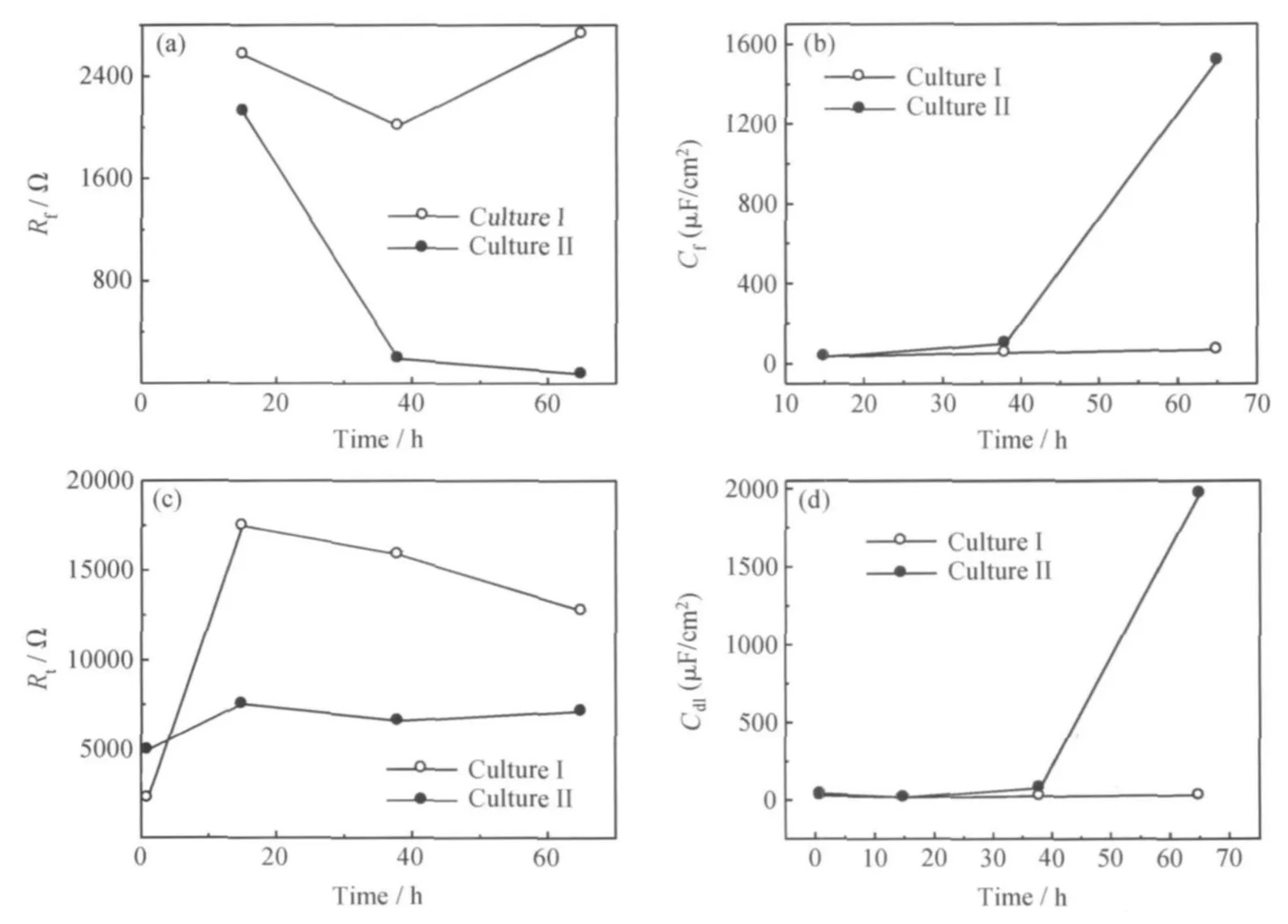
图3 Q235钢在两种培养基中膜电阻Rf、膜电容、Cf、反应电阻Rt和反应电容Cdl随时间的变化Fig.3 Rf,Cf,Rp and Ct of Q235 immersed on two culture:(a)Rf;(b)Cf;(c)Rp;(d)Cdl
从图3(a,b)中可见,培养基Ⅰ中Q235 钢表面膜层电阻高于培养基Ⅱ,电容则低于培养基Ⅱ,表明培养基Ⅰ中形成的膜层比培养基Ⅱ中形成的膜层隔绝性好,保护性好。培养基Ⅱ的膜层电阻随时间延长而减小,电容随时间延长而快速增大,可能是因为膜层中的电活性物质增加所致,这会导致膜层保护性降低。
从图3(c,d)可见,培养基Ⅱ中试样的反应电阻比培养基Ⅰ低很多,表明在培养基Ⅱ中腐蚀反应更容易进行。培养基Ⅱ中试样的反应电容随时间延长迅速增大,浸泡65h 培养基Ⅱ中试样的反应电容远大于培养基Ⅰ,说明此时培养基Ⅱ试样的金属/膜层界面处离子含量远高于培养基Ⅰ;又由图3(a,c)可知,Q235 钢在两种培养基中的反应电阻均大于膜电阻,两种介质中电化学反应为控制步骤,因此培养基Ⅱ中试样的金属/膜层界面处离子含量高不是由于离子扩散受膜层阻碍,而是由于反应速度增加,故培养基Ⅱ中浸泡65h 的试样腐蚀应更严重。
2.2 金相显微组织及腐蚀过程跟踪
图4a 图4b 为试验用Q235 钢抛光后原始形貌及显微组织。钢中有碳化物及硫化物夹杂,显微组织为铁素体加珠光体。从图1 图2 可知,Q235 钢在两种介质中浸泡1h 的阻抗及时间常数比较接近,这与显微镜观察结果相符。在显微镜下观察两种培养基中浸泡2h 的试样,腐蚀形态均为均匀腐蚀及点蚀,腐蚀程度差异不大。浸泡36h,培养基Ⅰ中的试样腐蚀程度加重,但仍可见金属基体,培养基Ⅱ中的试样表面被黑色腐蚀产物覆盖,腐蚀情况较培养基Ⅰ中的试样严重,验证了对电化学阻抗谱的分析。

图4 Q235 钢原始组织及不同浸泡时间显微照片 (a)抛光;(b)显微组织;(c)培养基Ⅰ,2h;(d)培养基Ⅰ,36h;(e)培养基Ⅱ,2 小时;(f)培养基Ⅱ,36hFig.4 Optical microscopy of Q235 steel with original and different immersing time:a,polished;b,microstructure;c,culture Ⅰ,2h;d,culture Ⅰ,36h;e,culture Ⅱ,2h;f,culture Ⅱ,36h
2.3 FIB 形貌与成分
图5 是在FIB 下对在两种介质中浸泡65h 后的Q235 钢试样观察结果及能谱。从图中可见,两种介质中的试样表面均形成一层生物膜。
在培养基Ⅰ中试样表面生物膜厚度小于100nm,较为致密,隔在SRB 与金属之间。试样表面附着细菌较少,这是因为金属表面形成有机物膜降低了可湿性,使细菌-金属的附着力降低[12]。金属基体与生物膜在界面处结合紧密平整,腐蚀轻微,未见点蚀等局部腐蚀形态。能谱的分析结果显示表面成分主要是铁。
在培养基Ⅱ中的试样表面生物膜厚度约为1um,大于培养基I。生物膜形态疏松多孔,覆盖了SRB 菌体,试样表面附着细菌较多。能谱的分析结果显示表面成分主要是铁和硫,由腐蚀产物的颜色和成分推断试样表面生物膜中包含腐蚀产物FeS。FeS 具有电活性,会导致生物膜电容增加电阻减小。从生物膜的截面可见金属基体与生物膜的界面处不平整,生物膜下金属出现很多点蚀孔洞,腐蚀情况较培养基Ⅱ中的试样严重。对电化学阻抗谱的推断与FIB 及成分分析结果符合。
从以上结果可见,Fe2+会促进碳钢的SRB 腐蚀。根据Von Wolzogen 等人的研究,铁的SRB 腐蚀步骤如下[3]:

在培养基Ⅰ中生物膜致密,电阻大电容小,隔绝性高,不具有电活性,阻碍了SRB 的附着和反应产物及电子的传输,抑制了阴极反应从而使腐蚀反应受到抑制。同时SRB 的代谢产物S2-的积累抑制了介质中SRB 的生长。
碳钢腐蚀速率与SRB 代谢产物积累的量有关[13]。Fe2+是阳极反应产物,S2-是阴极反应产物。在培养基Ⅱ中,Fe2+和S2-生成FeS 沉淀在试样表面,增加了金属与SRB 之间的静电吸引。SRB 附着在金属表面,代谢产物形成较厚生物膜,可以将SRB包裹在其中,膜中的化学条件物质浓度等会与外部有很大不同[14]。Fe2+和S2-生成FeS 沉淀,消耗了生物膜下的Fe2+和S2-,反应还使生物膜中的pH 值升高,形成了有利于SRB 生长的环境,促进了SRB的代谢,形成自催化过程。

图5 Q235 钢在两种不同介质中浸泡68h 后的FIB 照片及成分。(a)(b)(c)培养基Ⅰ,(d)(e)(f)培养基ⅡFig.5 FIB and EDS of Q235 steel immersed in different mediums:(a)(b)(c),culture Ⅰ,68h;(d)(e)(f)culture Ⅱ,68h
3 结论
在本实验条件下,Fe2+会极大的降低生物膜电阻,增加生物膜电容,使生物膜保护性劣化,使铁的溶解持续进行。
在本实验条件下,Fe2+的存在会造成生物膜成分和形态的不同,影响金属基体的腐蚀形态。Fe2+促进了细菌的附着、生物膜的形成和腐蚀反应的进行,改变了生物膜的内部环境。
电化学实验结果与形貌观察及成分分析实验结果一致,Fe2+的存在使生物膜形成不同于溶液的微观环境,降低了反应电阻,促进了铁的溶解。Fe2+对Q235 钢的SRB 腐蚀具有催化作用。
[1]BEECH Iwona B,SUNNER Jan. Biocorrosion:towards understanding interactions between biofilms and metals[J].Current Opinion in Biotechnology,2004,15(3):181 -186.
[2]BEECH I B,CHEUNG C W S. Interactions of exopolymers produced by sulphate-reducing bacteria with metal ions[J]. International Biodeterioration & Biodegradation,1995,35(1 -3):59 -72.
[3]任南琪. 废水厌氧处理硫酸盐还原菌生态学[M]. 北京:科学出版社,2009.
[4]RAO T S,SAIRAM T N,VISWANATHAN B,et al. Carbon steel corrosion by iron oxidising and sulphate reducing bacteria in a freshwater cooling system[J]. Corrosion Science,2000,42(8):1417 -1431.
[5]ZUO R,ORNEK D,SYRETT B C,et al. Inhibiting mild steel corrosion from sulfate-reducing bacteria using antimicrobial-producing biofilms in Three-Mile-Island process water[J]. Appl Microbiol Biotechnol,2004,64:275 -283.
[6]NERIA-GONZ'LEZ Isabel,WANG En tao,RAM'REZ Florina,et al.,Characterization of bacterial community associated to biofilms of corroded oil pipelines from the southeast of Mexico[J]. Anaerobe,2006,12(3):122 -133.
[7]BEECH Iwona B,CAMBELL Sheelagh A,Accelerated low water corrosion of carbon steel in the presence of a biofilm harbouring sulphate-reducing and sulphur-oxidising bacteria recovered from a marine sediment[J]. Electrochimica Acta,2008,54(1):14 -21.
[8]CLELAND J H,Corrosion risks in ships'ballast tanks and the IMO pathogen guidelines[J]. Engineering Failure Analysis,1995,2(1):79 -84.
[9]JOHANSSON Leena-Sisko,SAASTAMOINEN Tuomas,Investigating early stages of biocorrosion with XPS:AISI 304 stainless steel exposed to Burkholderia species[J]. Applied Surface Science,1999,144 -145:244 -248.
[10]MARCHAL Re’my,CHAUSSEPIED Bernard,WARZYWODA Michel,Effect of ferrous ion availability on growth of a corroding sulfate-reducing bacterium[J]. International Biodeterioration & Biodegradation,2001,47(3):125-131.
[11]VIDELA,Héctor A,HERRERA,et al. Microbiologically influenced corrosion-looking to the future[J]. International Journal of Hydrogen Energy,2005,8:169 -180.
[12]SHENG Xiao-xia,TING Yen-peng,PEHKONEN Simo olavi. The influence of ionic strength,nutrients and pH on bacterial adhesion to metals[J]. Journal of Colloid and Interface Science,2008,321(2):256 -264.
[13]KUANG Fei,WANG Jia,YAN Li,et al,Effects of sulfate-reducing bacteria on the corrosion behavior of carbon steel[J]. Electrochimica Acta,2007,52(20):6084 -6088.
[14]LEE A K,NEWMAN D K. Microbial iron respiration:impacts on corrosion processes[J]. Appl Microbiol Biotechnol,2003,62:134 -139.

