植酸结合胶红酵母对桃果采后根霉病的控制
杨其亚,张红印,庞水秀,靳莎莎
(江苏大学食品与生物工程学院,江苏镇江212013)
植酸结合胶红酵母对桃果采后根霉病的控制
杨其亚,张红印*,庞水秀,靳莎莎
(江苏大学食品与生物工程学院,江苏镇江212013)
为了寻找一种能够代替化学杀菌剂控制桃果采后病害的方法,研究了植酸与胶红酵母结合使用对桃果采后根霉病的控制效果。结果表明,0.15%植酸与胶红酵母结合使用能显著降低桃果采后根霉病发病率,防治桃果自然腐烂的发生,并且对果实贮藏品质没有产生不利影响;能诱导桃果多酚氧化酶(PPO)、过氧化物酶(POD)活性的提高,同时可以抑制丙二醛(MDA)含量的增加。
植酸,胶红酵母,桃果,根霉病,控制
水果采后病害造成的损失是巨大的[1],长期以来,世界上对水果病害包括采后病害的控制主要依赖于化学杀菌剂[2],杀菌剂的长期和大量使用,严重污染环境,有损于人体健康。过去十多年,公众和科学界对于食品和环境中农药(尤其杀菌剂)残留问题的关注日益增加。近年来,我国政府对食品的安全性非常重视,各地都在推行放心菜、放心肉、放心水果工程,不使用化肥农药的绿色水果深受广大消费者欢迎。另外,我国已加入WTO,国外对水果上的农药残留有严格的规定,特别是有些国家为了保护本国的经济利益,实行贸易壁垒,对水果上的农药和化学杀菌剂残留实行近乎苛刻的规定。所有这一切都要求我们开发安全、无公害、高效的水果生物保鲜剂。生物保鲜剂既能减轻有害微生物对果蔬侵染,又能保护环境,是生产安全性食品的有效方法。胶红酵母是被证明的能有效控制水果采后病害的酵母拮抗菌[3],但其对水果采后病害的防治效力与化学杀菌剂相比仍有较大的差距,因此如何提高拮抗酵母菌的拮抗效力,是提高其对水果采后病害控制水平,并将其应用于水果贮藏保鲜的重要策略之一。植酸作为一种从天然植物中提取的安全、多功能的新型食品添加剂,无致毒性,安全可靠,对果蔬具有良好的保鲜效果。本文研究了植酸结合胶红酵母对桃果采后根霉病病害的抑制效果,对桃果自然腐烂及贮藏品质的影响以及植酸增强胶红酵母对桃果采后病害防治效力的机制。
1 材料与方法
1.1 实验材料
样品 正常商业成熟度的桃(Prunus persica Batsch.)果实,品种为大久保,购买于江苏省句容市,早晨采摘后立即运到实验室进行实验,选择无机械损伤、未感染、大小和成熟度等外观品质基本一致的果实,分组待用;胶红酵母(Rhodotorula mucilaginosa) 本实验室保存菌种,在250mL的三角瓶中装入50mL的NYDB(牛肉浸膏8g,酵母浸膏5g,葡萄糖10g,水1000mL)种子培养基,用接种环接入两环活化好的R.mucilaginosa,在200r/min,28℃条件下培养20h;将上述培养混合物在7000×g条件下,离心10min,无菌生理盐水洗涤两次,去除培养介质,并用无菌生理盐水重新悬浮酵母细胞,血球记数板调节细胞浓度为5×108cells/mL。在250mL的三角瓶中装入50mL NYDB培养基,加入上述浓度的酵母细胞培养液1mL(植酸含量分别为0、0.05%、0.1%、0.15%、0.2%、0.25%),然后在200r/min,28℃条件下培养24h;上述不同处理酵母培养混合物在7000×g条件下,离心10min,并用无菌生理盐水洗涤2次,去除培养介质,再用无菌生理盐水稀释到所需浓度;匍枝根霉(Rhizopus stolonifer) 分离自腐烂的桃果果实,在PDA培养基(200g去皮马铃薯加水煮沸20min后过滤,滤液中加入20g葡萄糖,20g琼脂,用蒸馏水定容至1000mL)28℃下培养7d后,将其悬浮在无菌水中,用血球计数板在显微镜下对病原菌孢子数目进行测定,并根据需要用无菌水调节至所需浓度。
1.2 实验方法
1.2.1 不同浓度植酸对桃果根霉病采后病害的抑制效果 果实处理后,用消过毒的打孔器在每个果实表面赤道部位形成5mm(直径)×3mm(深)的伤口。每个伤口处等量加入30μL不同浓度的植酸溶液(0.05%~0.25%),3h后在每个伤口处加入30μL等量的病原菌孢子(R.stolonifer浓度为1×104spores/mL)。自然晾干后,将果实放入塑料筐并用保鲜膜密封,恒温恒湿培养箱中培养(25℃,RH 95%)。每处理重复3次,每次重复12个果实,整个实验重复2次。经过若干天的培养,计算发病率,以此评价不同浓度植酸的抑菌效果。
1.2.2 植酸结合胶红酵母对桃果根霉病采后病害的抑制效果 果实处理后,用消过毒的打孔器在每个果实表面赤道部位形成5mm(直径)×3mm(深)的伤口。每个伤口处等量加入30μL溶液:a.1×108cells/mL的酵母菌(含0.05%~0.25%植酸);b.1×108cells/mL的酵母菌;c.无菌水(作为对照)。3h后在每个伤口处加入30μL等量的病原菌孢子(R.stolonifer浓度为1×104spores/mL)。自然晾干后,将果实放入塑料筐并用保鲜膜密封,恒温恒湿培养箱中培养(25℃,RH 95%)。每处理重复3次,每次重复12个果实,整个实验重复2次。经过若干天的培养,计算发病率,以此评价胶红酵母菌种(Rhodotorula mucilaginosa)的抑菌效果。
1.2.3 植酸与胶红酵母结合对桃果自然腐烂及贮藏品质的影响 实验水果采摘后直接用以下处理浸泡果实30s:a.1×108cells/mL的酵母菌(含0.15%植酸);b. 1×108cells/mL的酵母菌;c.0.15%植酸;d.无菌水(作为对照)。然后将果实放在塑料筐内,风干后用保鲜膜密封。贮藏于4℃冰柜,30d后转入25℃培养箱贮藏,7d后观察果实腐烂情况,计算腐烂率,并进行贮藏品质分析。每处理重复3次,每次重复10个果实,整个实验重复2次。
贮藏品质分析方法如下:采用称重法测定失重;采用TA-XT2i质构分析仪测试硬度;参照Larrigaudière等的方法[4]测定总可溶性固形物;参照郝建军等的方法[5]测定可滴定酸度;采用紫外快速测定法[6]测定维生素C的含量;采用改进的Lee的方法[7]测定褐变度。1.2.4 植酸与胶红酵母结合对果实抗性相关酶活性及脂质过氧化作用的影响 果实处理后,用消过毒的打孔器在每个果实表面赤道部位形成5mm(直径)×3mm(深)的伤口,每个伤口处等量加入30μL以下处理液:a.1×108cells/mL的酵母菌(含0.15%PA);b.1× 108cells/mL的酵母菌;c.PA(0.15%);d.无菌水。处理后果实放在塑料筐内,用保鲜膜密封,25℃贮藏,并定期取样对果实抗性相关酶活性及脂质过氧化作用进行测定。每处理重复3次,整个实验重复2次。
酶液的提取:取样时先用无菌刀片刮去伤口表面组织,然后用9mm(直径)×10mm(深)的打孔器从6个果实伤口处取2g的新鲜果肉组织置于预冷的研钵中。加入10mL 4℃预冷的50mmol/L含1.33mmol/L EDTA和1%PVPP的提取缓冲液。加入少量石英砂在冰浴中充分碾磨,破碎组织,12000×g,4℃条件下离心10min,取上清液作为酶活性等指标样品。每个处理重复3次,整个实验重复2次。
PPO活性测定采用邻苯二酚法[8],POD活性测定采用愈创木酚法[9],丙二醛(malondialdehyde,MDA)含量测定参照Du和Bramlage的方法[10],略有改动。
1.3 数据处理
实验结果采用SPSS/PC统计软件进行邓肯式多重比较差异分析(取P=0.05)。
2 结果与分析
2.1 不同浓度植酸对桃果根霉病的抑制效果
如图1所示,与对照组相比,植酸单独使用可以降低桃果由匍枝根霉引起的根霉病的发病率,且0.15%植酸对桃果伤口根霉病侵染的抑制效力最为显著。

图1 不同浓度植酸对桃根霉病的抑制效果Fig.1 Inhibition effect of different concentration phytic acid on peaches Rhizopus decay
2.2 植酸与胶红酵母结合对桃果根霉病的抑制效果
如图2所示,与对照组相比,胶红酵母单独使用可以降低桃果由匍枝根霉引起的根霉病的发病率,且胶红酵母与0.15%植酸结合使用对桃果伤口根霉病侵染的抑制效力显著增强。经胶红酵母与0.15%植酸结合处理的桃果,其根霉病发生率仅为对照组的30.5%,为胶红酵母单独处理的57.9%。当植酸浓度为0.05%、0.1%、0.2%、0.25%与胶红酵母结合使用,与酵母单独使用并没有显著差异。
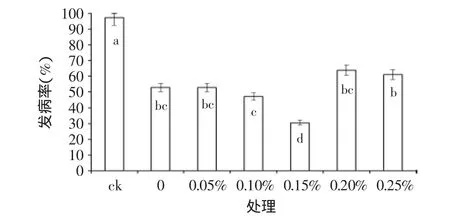
图2 不同浓度植酸与胶红酵母结合对桃根霉病的抑制效果Fig.2 Inhibition effect of different concentration phytic acid combination with Rhodotorula mucilaginosa on peaches Rhizopus decay
2.3 植酸与胶红酵母结合对桃果自然腐烂及贮藏品质的影响
如图3所示,0.15%植酸结合胶红酵母处理对桃果自然腐烂的抑制作用显著,其处理的桃果自然腐烂率约为胶红酵母单独处理的桃果腐烂率的71.4%。同时,如表1所示,与对照组桃果相比,经0.15%植酸与胶红酵母结合处理的桃果其硬度、可溶性固形物含量无显著差异,VC含量显著增加,失重率及褐变度显著降低,对各项品质指标均不产生有害影响。

图3 植酸与胶红酵母结合对桃果自然腐烂的抑制效果Fig.3 Effect of R.mucilaginosa combination with PA treatment on natural rotten percent of peach fruits
2.4 植酸结合胶红酵母对桃果抗病性酶活及脂质过氧化作用的影响
2.4.1 对桃果POD活性的影响 过氧化物酶(POD)能够氧化自由基和活性氧,所以常作为植物抗氧化胁迫的重要指标。POD是多功能酶,在果实衰老和抗性生理中都具有重要调节作用,高POD活性被认为是植物果实抗性诱导的一个生理生化标志。从图4可以看出,胶红酵母单独处理和与植酸结合处理的桃果POD活性从开始就快速上升,在第2d达到最高值,结合处理的桃果POD活性除第2d时稍低于胶红酵母单独处理,其余都高于其它几种处理。植酸单独处理和对照处理的桃果POD活性变化不大。胶红酵母单独处理和与植酸结合处理的桃果POD活性与对照相比,显著提高了伤口组织中POD的活性。
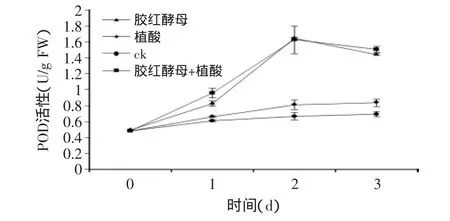
图4 植酸和胶红酵母结合对桃果POD活性的影响Fig.4 Effect of R.mucilaginosa and PA on POD activity of peach

图5 植酸和胶红酵母结合对桃果PPO活性的影响Fig.5 Effect of R.mucilaginosa and PA on PPO activity of peach

表1 植酸与胶红酵母结合对桃果储藏品质的影响Table 1 Effect of R.mucilaginosa and PA treatments on quality parameters of intact peach fruits
2.4.2 对桃果PPO活性的影响 多酚氧化酶(PPO)可催化木质素及其他酚类氧化产物的形成,构成保护性屏蔽而抵抗病菌的入侵,也可以通过形成醌类物质直接发挥抗病作用。酚类物质在植物抗病机理中具有重要作用,多酚氧化酶(PPO)催化酚类物质形成对病原菌更具毒性的醌[11]。增强的PPO活性与植物抗病性相关[12-13]。从图5可以看出,各个处理的桃果实PPO含量整体呈先上升后下降趋势。胶红酵母与植酸结合处理桃果伤口的PPO活性迅速增加,在第2d时达到最大值,是对照处理的1.32倍。胶红酵母单独处理在第2d达到最大值后保持稳定状态。植酸单独处理在第2d时PPO活性最大且含量接近胶红酵母单独处理的。对照处理的PPO活性在第2d达到最大值后迅速下降,在整个实验阶段对照处理的PPO活性都是最低。胶红酵母与植酸结合处理的PPO含量除第0d与对照处理无显著差异,其余时间都显著高于对照。2.4.3 对桃果MDA含量的影响 植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛(MDA)是多不饱和脂肪酸的分解产物,会严重损伤生物膜,通常利用它作为脂质过氧化作用的生物标记,MDA含量可以反映细胞脂质过氧化程度和植物衰老指标及对逆境条件的反应的强弱。从图6可以看出,胶红酵母单独处理的、胶红酵母与植酸结合处理和植酸单独处理桃果的MDA含量在第1d下降到最低后逐渐上升,而对照处理桃果伤口处MDA含量在第1d先稍微下降,然后上升,在第2d达到最大值。胶红酵母与植酸结合处理除在第0d外,都处于较低水平,且一直都低于对照,显著抑制了桃果果实组织中MDA含量的积累。
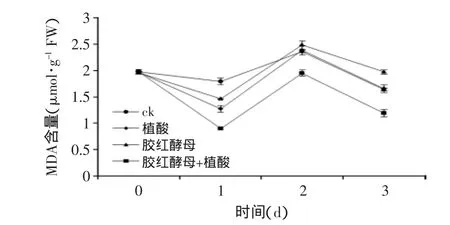
图6 植酸和胶红酵母结合对桃果MDA含量的影响Fig.6 Effect of R.mucilaginosa and PA on MDA concent of peach
3 结论
植酸由于其独特的结构而具有螯合能力,这种对多价阳离子的强螯合性能,有可能抑制某些酶的活性,从而对病原菌的生长起到抑制作用。本实验中,不同浓度植酸对实验菌均有抑制作用,低浓度时抑菌程度不一,0.15%植酸对桃果采后根霉病的抑制效果最佳。植酸作为食品保鲜剂,能有效地提高食品贮存功能和改善食品质量,使其色、香、味保持较长时间而营养不变[12]。本实验中,胶红酵母与0.15%植酸结合处理显著降低桃果贮藏时的褐变度。
本研究表明,0.15%植酸单独处理对桃果采后根霉病的拮抗效力与对照相比,有显著提高;且胶红酵母和0.15%植酸结合处理,对桃果采后根霉病的拮抗效力与单独使用胶红酵母相比,有显著提高。胶红酵母与0.15%植酸结合处理对桃果自然状况下病害的发生有显著的抑制作用,并且对果实贮藏品质没有产生不利影响。植酸与胶红酵母结合通过激发果实对病原菌的抗性,诱导果实抗性相关的酶活性,通过诱导了POD、PPO活性的增加,降低了MDA含量来减缓果实贮藏过程中的衰老和病原菌侵入。考虑到植酸是从植物中或植物加工后剩余物中提取的,应用植酸不存在对人体健康和环境的安全性问题,所以植酸作为天然提取物增强酵母拮抗活性的方法是一种有效而且安全的新方法。
[1]Sholberg P L,Conway W S.Postharvest Pathology[M].In Agriculture Handbook Number 66:The Commercial Storage of Fruits,Vegetables,and Florist and Nursery Stocks.Edited by:Gross K C,Wang C Y,and Saltveit M.Published on line(http://usna. usda.gov/hb66/contents.html)by the U.S.Department of Agriculture(USDA),the Agricultural Research Service(ARS),Washington D.C,USA,2004.
[2]EI Ghaouth A,Wilson C L,Wisniewski M,et al.Biological control of postharvest diseases of citrus fruits[M].Biological Control of Crop Diseases(Edited by Gnanamanickam,S S).Marcel Dekker,Inc.New York,USA,2002:289-312.
[3]Li R P,Zhang H Y,Liu W M,et al.Biocontrol of postharvest gray and blue mold decay of apples with Rhodotorula mucilaginosa and possible mechanisms of action[J].International Journal of Food Microbiology,2011.
[4]Larrigaudière C,Torres R,Usall J.Storage performance of clementines treated with hot water,sodium carbonate and sodium bicarbonate dips[J].Journal of Horticultural Science and Biotechnology,2002,77(3):314-319.
[5]郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2007.
[6]周德庆,韩雅珊.紫外分光光度法快速测定果蔬及饮料中维生素含量的研究[J].中国农业大学学报,1997,2(5):7-13.
[7]Lee C Y,Kagan V,Jaworski A W,et al.Enzymic browning in relation to phenolic compounds and polyphenoloxidase activity among various peach cultivars[J].Journal of Agricultural and Food Chemistry,2002,38(1):99-101.
[8]Aquino-Bolaños E N,Mercado-Silva E.Effects of polyphenol oxidase and peroxidase activity,phenolics and lignin content on the browning of cut jicama[J].Postharvest Biology and Technology,2004,33(3):275-283.
[9]Lurie S,Fallik E,Handros A,et al.The possible involvement of peroxidase in resistance to Botrytis cinereain heat treated tomato fruit[J].Physiological and Molecular Plant Pathology,1997,50(3):141-149.
[10]Du D,Bramlage W J.Modified thiobarbituric acid assay for measuring lipid oxidation in sugar-rich plant tissue extracts[J]. Journal of Agricultural and Food Chemistry,1992,40:1566-1570.
[11]Mayer A M,Harel E.Polyphenol oxidases in plants[J]. Phytochemistry,1979,18(2):193-215.
[12]Mohammadi M,Kazemi H.Changes in peroxidase and polyphenol oxidase activities in susceptible and resistant wheat heads inoculated with Fusarium graminearum and induced resistance[J].Plant Science,2002,162(4):491-498.
[13]Jung W J,Jin Y L,Kim Y C,et al.Inoculation of Paenibacillus illinoisensis alleviates root mortality,activates of lignification-related enzymes,and induction of the isozymes in pepper plants infected by Phytophthora capsici[J].Biological Control,2004,30(3):645-652.
[14]李好管.植酸的生产及应用开发[J].上海化工,2001,20:33-36.
Control of postharvest Rhizopus decay of peaches by phytic acid in combination with Rhodotorula mucilaginosa
YANG Qi-ya,ZHANG Hong-yin*,PANG Shui-xiu,JIN Sha-sha
(School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China)
In order to search for an alternative to synthetic fungicides for the control of postharvest decay of peach fruits,the potential of using phytic acid in combination with Rhodotorula mucilaginosa for the control of postharvest Rhizopus decay of peaches was investigated.The results showed that the combined treatment of 0.15%PA with R.mucilaginosa significantly decreased Rhizopus decay incidence of peaches,remarkably controled the natural development of decay of peaches and did not impair postharvest quality parameters of these fruits under normal shelf-life condition.The combined treatment increased the activity of POD,PPO and reduced the content of MDA of peaches.
phytic acid;Rhodotorula mucilaginosa;peaches;Rhizopus decay;control
TS205
A
1002-0306(2012)05-0352-04
2011-05-16 *通讯联系人
杨其亚(1983-),女,硕士研究生,研究方向:食品微生物学。
江苏省自然科学基金(BK2009214);江苏高校优势学科建设工程资助项目。

