单增李斯特菌免疫磁珠的制备研究
徐金亭,李志清,向军俭,唐 勇,杨红宇
(暨南大学分子免疫学与抗体工程研究中心,广东广州510632)
单增李斯特菌免疫磁珠的制备研究
徐金亭,李志清,向军俭*,唐 勇,杨红宇
(暨南大学分子免疫学与抗体工程研究中心,广东广州510632)
目的:制备可高效、特异地分离单增李斯特菌的免疫磁珠。探讨羧基修饰磁珠与多克隆抗体的不同偶联条件和免疫磁珠捕获单增李斯特菌的能力。方法:以单增李斯特菌作为抗原,免疫新西兰兔,获得兔源多克隆抗体,鉴定其与单增李斯特菌体的结合能力;选择6种不同的偶联缓冲溶液,设置了6个主要偶联时间和6组偶联温度,通过比较磁珠与抗体偶联后上清中剩余的抗体量来确定最佳偶联条件。结果:制备的多克隆抗体效价为1.3×105,该抗体与单增李斯特菌体有较好的结合,抗体与1mg羧基修饰磁珠在pH6.0的0.01mol/L一水吗啉乙磺酸缓冲溶液(MES)中,37℃偶联2h,偶联抗体的量为160μg;制得的免疫磁珠的捕获率可达77.0%。结论:获得羧基磁珠与抗体偶联的最佳条件,该免疫磁珠用于食品中单增李斯特菌的检测,与常规的平皿增菌培养显色法比较,检测时间至少缩短20h。
免疫磁珠,单增李斯特菌,偶联
单增李斯特菌(Listeria monocytogenes,LMO)是一种分布广泛的食源性致病菌,其几乎可以污染所有的食物。因此在上世纪90年代,LMO被世界卫生组织列为食品中四大致病菌之一[1]。目前现有针对LM的检测方法有传统分离培养与鉴定法,双抗夹心ELISA法,PCR以及荧光量子点法等[2-4]。上述这些方法都涉及到样品前处理过程,增菌培养是样品前处理的重要步骤。该步骤耗时较长,而且容易受到样品残渣以及杂菌的影响。因此,建立一种快速、高效的样品前处理方法,对用于食品中LMO以及其他致病菌的检测具有重大的意义。免疫磁珠分离技术(Immunomagnetic separation)始于上世纪80年代,并获得迅速的发展,已广泛运用于DNA提取、细胞分选、蛋白提取及纯化和微生物分离检测[5-7]。在微生物分离检测中,免疫磁珠通过表面偶联的抗体可以特异性的捕获目标物,起到分离、富集的作用。通过与其他检测方法结合使用[8],提高了检测方法灵敏度的同时也实现检测方法的快速、简便及现场适用性。目前国内对免疫磁珠的制备研究较少,而是用进口试剂盒,成本较高。本研究运用自制兔抗LMO纯化的多抗与磁珠进行偶联制备免疫磁珠,探讨并优化抗体与磁珠偶联的最佳条件,并用于捕获试样中的LMO菌体,以实现快速检测食品中LMO。
1 材料与方法
1.1 材料与仪器
新西兰大白兔 购于广东省医学实验动物中心;单增李斯特菌(菌株编号CMCC54002,简称LMO54002)由广东微生物研究所提供;羧基修饰磁珠PM3-020上海奥润微纳新材料科技有限公司;BCATM protein试剂盒 美国Thermo公司;弗氏完全佐剂和弗氏不完全佐剂 美国Gibco公司;牛津琼脂基础OXA、OXA添加剂 青岛海博生物技术有限公司;TSA-YE培养基广东环凯微生物科技有限公司;碳二亚胺(EDC) 美国Sigma公司;N-羟基琥珀酰亚胺(NHS) 美国Pierce公司;其他试剂均为国产分析纯。
8孔磁性分离器 陕西北美基因股份有限公司;混匀仪Dynal-MIX1 美国Invitrogen公司;荧光倒置显微镜 日本OLYMPUS公司;UV-2550紫外-分光光度计 Shimadzu公司;Multiskan MK3酶标仪 美国Thermo公司;Biofuge primoR离心机 德国Heraeus公司;纳米激光粒度仪 英国Malvern公司;透射电子显微镜、扫描电子显微镜 荷兰PHILIP公司。
1.2 实验方法
1.2.1 抗原的制备 将冻存的LMO菌种复苏后,接种至100mL TSA-YE培养基中,37℃振荡培养24h,4500r/min离心15min收集菌体。用无菌生理盐水洗涤两次,然后加入含有0.3%甲醛的生理盐水100mL,37℃灭活菌体24h。离心收集菌体,并以无菌生理盐水重悬菌体。采用麦氏比浊法对菌体进行计数,然后分装,-20℃冻存备用[9-10]。
1.2.2 抗LMO多克隆抗体的制备及鉴定 新西兰大白兔(雌雄各一只,2.0kg左右)适应性饲养一周后,耳静脉采血1~1.5mL,保留作为阴性血清。用灭活LMO全菌免疫新西兰兔,每次免疫间隔两周,免疫抗原体积为0.5mL,分多次背部皮下注射。初次免疫剂量为4×108CFU/只,以后四次免疫剂量逐渐加强,末次加强免疫剂量为3×109CFU/只[11]。每次免疫前一周耳缘静脉采血,间接ELISA方法测定血清效价。末次免疫7d后颈动脉采集全部血液[12]。对获得的兔抗血清采用辛酸-硫酸铵纯化[13]。
1.2.3 磁珠性状分析 采用纳米激光粒度仪以及透射电子显微镜测量并观察羧基磁珠(PM3-020)粒径大小及其分布[14]。
1.2.4 羧基磁珠与抗体偶联条件优化
1.2.4.1 羧基磁珠与抗体偶联步骤[14]活化:取100μL羧基修饰磁珠至1.5mL离心管中,用500μL 0.01mol/L一水吗啉乙磺酸吐温溶液(MEST,pH6.0,0.05%Tween-20)洗涤三次,用磁力架分离后吸出上清。用4℃贮存的0.01mol/L一水吗啉乙磺酸溶液(MES,pH6.0)分别配制5mg/mL的碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)溶液,向磁珠中分别加入100μL EDC和NHS溶液,置于混匀仪上保持磁珠悬浮,37℃活化45min,离心管置于磁力架上磁分离,移除上清,加入500μL MEST,将磁珠转移至新的离心管中,加入500μL MEST,重新洗涤2次,最后移除上清。偶联:将抗体与活化的磁珠混合,用偶联缓冲液调节总体积至500μL,置于混匀仪上混匀活化磁珠和抗体悬液。封闭:将离心管取下置于磁力架上磁分离,移除上清,加入1mL 0.04mol/L含1%牛血清白蛋白(BSA)的硼酸盐吐温溶液(BST,pH9.0)重悬磁珠,置于混匀仪上37℃封闭45min。保存:取下离心管置于磁力架上磁分离,移除上清,磁珠用500μL BST洗涤四次,用含0.02%Na3N的保存缓冲液溶液重悬磁珠,保存于4℃备用。
1.2.4.2 偶联缓冲液 取等量的活化磁珠,加入等量的抗体500μg,以六种缓冲液:磷酸盐溶液(PBS,pH7.4)、磷酸盐吐温溶液(PBST,pH7.4,0.05%Tween-20)、一水吗啉乙磺酸溶液(MES,pH6.0)、一水吗啉乙磺酸吐温溶液(MEST,pH6.0,0.05%Tween-20)、硼酸盐溶液(BS,pH9.0)、硼酸盐吐温溶液(BST,pH9.0,0.05% Tween-20)构成反应体系,在37℃分别偶联2h,每种缓冲液设置3个平行。最后用BCA试剂盒在OD570nm下检测上清中剩余抗体的量,以确定抗体与磁珠偶联的最佳偶联缓冲液体系。
1.2.4.3 偶联时间 取等量的活化磁珠于各离心管中,分别加入等量用偶联缓冲液稀释的抗体400μg,在37℃分别偶联0.5、1、1.5、2、2.5、3h,保持磁珠处于悬浮状态,每个时间设置3个平行。最后用BCA试剂盒检测上清中剩余抗体的量,以确定抗体与磁珠偶联的最佳反应时间。
1.2.4.4 偶联温度 取等量的活化磁珠,加入等量用偶联缓冲液稀释的抗体500μg,设定偶联温度为4、15、25、37、45、55℃,偶联2h,保持磁珠处于悬浮状态,每个温度设置3个平行。最后用BCA试剂盒检测上清中剩余抗体的量,以确定抗体与磁珠偶联的最佳反应时间。
1.2.4.5 抗体偶联量 取相同活化磁珠1mg,加入不同量的纯化抗体50、100、200、400、500、800、1000、1500、2000、3000μg,在最佳缓冲体系中进行偶联。偶联后用BCA法检测上清剩余抗体量,由此获得单位质量磁珠偶联抗体的量。
1.2.5 免疫磁珠(Immunomagnetic beads,IMBs)捕获LMO
1.2.5.1 LMO与IMBs结合观察 LMO增菌方法同1.2.1。用无菌生理盐水10倍稀释菌体为10-12。随后取三份样品,各为20μL,一份按传统细菌计数方法涂布于显色平皿,剩余二份用无菌生理盐水稀释至200μL,加入20μL免疫磁珠,保持免疫磁珠处于混匀状态,37℃孵育45min。将离心管置于磁力架上,去除上清后将免疫磁珠转移至新离心管中,并用含0.1%牛血清白蛋白的0.01mol/L PBS缓冲液洗涤三次。最后用20μL PBS缓冲液重悬免疫磁珠,其中一份用于扫描电子显微镜观察,另一份涂于显色平皿,置于37℃烘箱中培养18h,取出观察。统计平板上的菌落数。
1.2.5.2 单位量IMBs的捕获能力 用无菌生理盐水稀释菌体至10-7~10-12,分别取100μL菌液,并向其中加入制备的IMBs20μL。按上述磁珠分离法分离后,用20μL PBS缓冲液重悬免疫磁珠,涂显色平皿,置于37℃烘箱中培养18h,取出观察。统计平板上的菌落数。
2 结果与讨论
2.1 多克隆抗体效价
新西兰兔经五次免疫后,用间接ELISA检测其效价,以多克隆抗体的吸光值2.1倍于阴性血清吸光值时,多克隆抗体的最大稀释倍数为其效价[9]。由图1可知多克隆抗体的效价约为1.3×105。
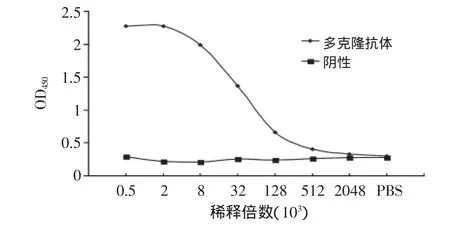
图1 多克隆抗体效价曲线Fig.1 Titer curve of polyclonal antibody
2.2 多抗与LMO菌体的结合
为探讨该多抗能与LMO菌体特异性结合,在多抗与LMO菌体孵育1h后,使用FITC标记的羊抗兔二抗处理,然后在荧光显微镜下观察LMO菌体的发光情况。结果显示,多抗能与LMO菌体有较好的特异性结合,见图2。

图2 多抗与LMO菌体结合Fig.2 Combination of the polyclonal antibody and Listeria monocytoenes
2.3 磁珠粒径检测

图3 羧基磁珠PM3-020 TEM扫描图(17500×)Fig.3 TEM of carboxylate-modified magnetic beads(17500×)
用激光粒度仪对羧基磁珠粒径进行测量。粒径测试条件为:25℃。磁珠在分散缓冲液中的浓度为0.2mg/mL。结果表明,羧基修饰磁珠PM3-020的粒径分布较为均匀,其平均粒径为175nm,分散指数(PDI)为0.236。同时用透射电子显微镜(TEM)观察PM3-020。从图3可以看出,该磁珠有较好的分散性,且磁珠大小较为均匀。
2.4 羧基磁珠与抗体偶联条件优化
2.4.1 最佳偶联缓冲体系 图4结果显示,MES缓冲液体系的OD570值要低于PBS和BS缓冲液体系,说明在MES缓冲液体系中,上清剩余抗体量少于其他两种缓冲液中的抗体剩余量,即表明磁珠偶联上抗体的量在MES缓冲液体系中达到最大。另外,在三种相同的缓冲液中,加入Tween-20后,OD570均大于不加Tween-20的缓冲体系,说明Tween-20对磁珠与抗体偶联起抑制作用。因此最佳的活化磁珠与抗体偶联的缓冲体系为MES缓冲液(0.01mol/L,pH6.0)。
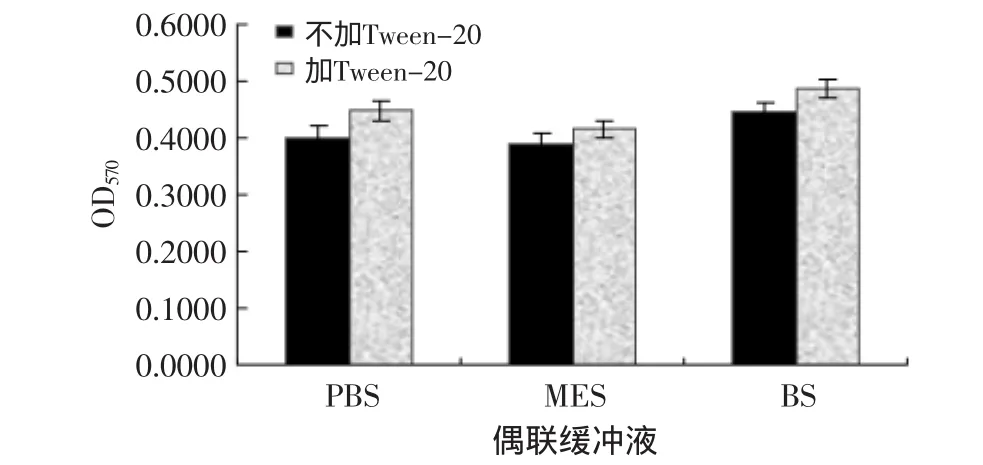
图4 缓冲液对偶联效果的影响Fig.4 Effect of buffer on coupling
2.4.2 偶联时间 活化磁珠与抗体经过不同偶联时间后,用BCA试剂盒在OD570检测上清中剩余抗体的含量,结果如图5。偶联时间在0.5~1.5h内时,上清剩余抗体量递减迅速,当超过2h后,上清抗体量趋向稳定,说明偶联到磁珠上的抗体达到饱和。因此,选择2h作为活化磁珠与抗体的偶联时间。
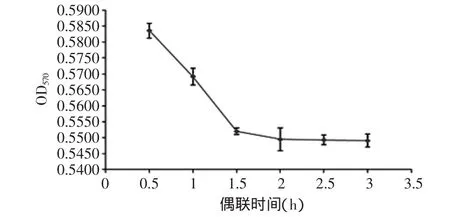
图5 时间对偶联效果的影响Fig.5 Effect of time on coupling
2.4.3 偶联温度 图6结果显示,在4~15℃内,OD570变化不明显,说明活化磁珠与抗体偶联受到抑制,且在实验中观察到磁珠发生聚集,形成肉眼可见的褐色颗粒状沉淀,见图7B;在15~37℃,OD570变化加剧,说明偶联到磁珠上的抗体量增加;当温度超过37℃,OD570变化再次趋向稳定,表明磁珠表面偶联上的抗体量达到饱和,由此选择37℃作为偶联的最适温度,同时37℃也是抗体保持较好活性的最佳温度,制得的免疫磁珠在溶液中分散性好,且具有较好的稳定性(图7A)。
2.4.4 单位磁珠抗体偶联量 由上述确定磁珠与抗体偶联的最佳偶联时间、温度和缓冲液,摸索单位质量磁珠偶联抗体的量,结果如图8所示。当加入的抗体量在50~400μg之间时,1mg活化磁珠偶联上的抗体量逐渐增加,当加入的抗体量大于500μg时,偶联至活化磁珠上的抗体趋向饱和,此时1mg磁珠偶联上的抗体量为160μg。
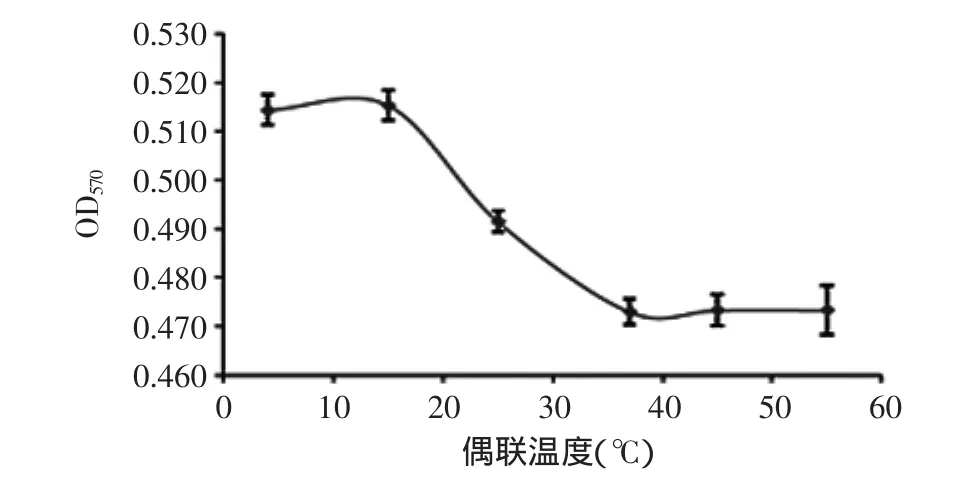
图6 温度对偶联效果的影响Fig.6 Effect of temperature on coupling
图7 温度对偶联效果的影响Fig.7 Effect of temperature on coupling
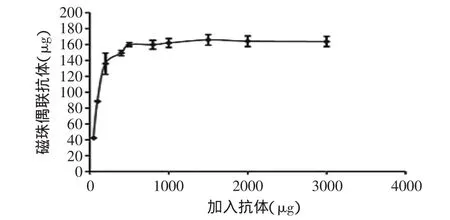
图8 加入抗体量对偶联效果的影响Fig.8 Effect of antibodies amount on coupling
2.5 IMBs捕获LMO

图9 免疫磁珠与菌体作用SEM扫描图Fig.9 SEM of combination between immunomagnetic beads and Listeria monocytoenes
2.5.1 IMBs捕获LMO观察 将制备得到的IMBs与LMO菌体作用后,用扫描电子显微镜(SEM)观察两者的结合情况,结果见图9。SEM扫描图显示,粒径为200nm左右的IMBs通过其表面的抗体与LMO菌体牢固的结合,说明制备的IMBs能捕获到LMO。观察平皿LMO的生长状况。20μL稀释菌液直接涂布平皿后,观察到的LMO菌落数为39个,而用无菌生理盐水稀释十倍,再用制备的免疫磁珠捕获,观察到的LMO菌落数为30个。由此可知20μL免疫磁珠的捕获率为77%。2.5.2 单位量IMBs捕获能力 在10倍稀释的100μL LMO菌液中,加入20μL制备的IMBs,经18h培养后,其捕获的LMO菌体数见图10。从图中可知,当LMO菌体数量增加时,20μL IMBs捕获菌体的量也逐渐增加,并在LMO菌体稀释倍数为10-10时,其捕获的LMO菌体能力趋于饱和,其捕获到的菌体数目在165~174个之间。因此,20μL IMBs捕获LMO的最大量为174。

图10 免疫磁珠捕获能力实验结果Fig.10 The capture ability of immunomagnetic beads
3 讨论
免疫磁珠分离技术已广泛运用于食品中食源性致病菌的分离检测,已有文献报道在大肠杆菌O157∶H7检测中运用免疫磁珠,其检测时间可以缩短到1.5h[15]。2008年中国国家质量监督检验检疫总局发布的进出口食品中单核细胞增生李斯特氏菌检测方法中明确提出采用免疫磁珠分离技术作为样品的前处理方法[16]。由此可见免疫磁珠分离技术在今后食品安全检测中将发挥重要作用。目前只有Invitrogen公司市售抗LMO免疫磁珠试剂盒,且价格相对昂贵。本研究探索了抗LMO免疫磁珠制备的最佳条件及免疫磁珠捕获菌体的效率。
通过激光粒度仪分析,选择粒径分布均匀且分散性好的羧基磁珠作为制备免疫磁珠的材料。磁珠与抗体偶联所选用的缓冲体系及其pH,偶联的时间和温度直接影响磁珠与抗体的偶联效果以及制备的免疫磁珠的捕获能力。本研究表明,在MES缓冲液中(pH6.0),抗体偶联至磁珠表面的量最大,因为羧基磁珠在偏酸性的环境下,保持较好的分散性,磁珠的比表面积也最大化。同时证明,在偶联2h时即完成抗体偶联的最大化。在偶联温度实验中发现,较低的偶联温度不利于抗体与磁珠的偶联,且会出现磁珠的聚集,形成颗粒状沉淀,影响免疫磁珠的保存及使用。当温度超过37℃,抗体偶联量趋于稳定。在上述探索的偶联条件下,1mg磁珠可以偶联160μg抗体。
本实验将制备的抗LMO免疫磁珠与常规的平皿培养显色法结合,检测时间至少缩短20h,免疫磁珠的捕获率可达77%。目前本实验室正在探讨定量的免疫磁珠在大体积实样中的捕菌能力并建立与化学显色法结合的检测技术,为LMO快速、灵敏和特异的检测技术的发展奠定基础。
[1]冯家望,五小伦,黄云君,等.食品中单核增生李斯特菌的PCR快速检测研究[J].中国食品卫生杂志,2005,17(3):234-237.
[2]段霞,黄欣,黄岭芳,等.双抗夹心ELISA方法检测食品中单核细胞增生李斯特氏菌[J].食品卫科学,2010,31(24):272-276.
[3]Yang H,Qu L W,Wimbrow A N,et al.Rapid detection of Listeria monocytogenes by nanoparticle-based immunomagnetic separation and real-time PCR[J].International Journal of Food Microbiology,2007,118:132-138.
[4]翁文川,杨汝德,焦红,等.免疫磁珠分离-荧光PCR应用在肉来单增李斯特氏菌的检测[J].中国人兽共患病学报,2006,22(6):547-550.
[5]Hardingham J E,Kostasek D,Farmer B,et al.Immunobead-PCR:A technique for the detection of circulating tumor cells using immunomagnetic beads and the polymerase chain reaction [J].Cancer Research,1993,53:3455-3458.
[6]Tu S I,Reed S A,Gehring A G,et al.Detection of salmonella enteriditis from egg components using different immunomagnetic beads and time-resolved fluorescence[J].Food Anal Methods,2009(2):14-22.
[7]Chu P T,Hsieh M F,Yin S Y,et al.Development of a rapid and sensitive immunomagnetic-bead based assay for detecting Bacillus cereus in milk[J].European Food Research and Technology,2009,229:73-81.
[8]Wadud S,Leon-Velarde C G,Larson N,et al.Evaluation of immunomagnetic separation in combination with ALOA Listeria chromogenic agar for the isolation and identification of listeria monocytogenes in ready-to-eat foods[J].Journal of Microbiological Methods,2010,81:153-159.
[9]窦勇,宁喜斌.副溶血弧菌间接ELISA快速检测法的建立[J].食品工业科技,2007,28(6):205-209.
[10]孙会芳.单核细胞增生性李斯特杆菌单克隆抗体的制备[D].兰州:西北民族大学,2007.
[11]熊国华.单增李斯特菌及溶血素O与葡萄球菌三种肠毒素免疫胶体金检测技术研究[D].沈阳:沈阳农业大学,2007.
[12]Larry H S,Paul M,Mies CS,et al.Development and partial characterization of high-affinity monoclonal antibodies for botulinum toxin type A and their use in analysis of milk by sandwich ELISA[J].Journal of Immunologal Methods,2008,336(1):1-8.
[13]王志祥,王静梅,王耀峰.单核增多性李氏杆菌多克隆抗体的制备及纯化[J].石河子大学学报,2003,7(1):4-6.
[14]刘辉荣,徐宏,古宏晨,等.简便高效分离细胞新型免疫磁珠制备[J].中国公共卫生,2008,24(11):1349-1351.
[15]Liu YC,Li Y B.Detection of Escherichia coli O157:H7 using immunomagnetic separation and absorbance measurement[J]. Journal of Microbiological Methods,2002,51:369-377.
[16]吴斌,李振荣,胡传伟,等.SN/T 0184.3-2008进出口食品中单核细胞增生李斯特氏菌检测方法[S].北京:中国标准出版社,2008.
Study on preparation of immunomagnetic beads used for Listeria monocytoenes separation
XU Jin-ting,LI Zhi-qing,XIANG Jun-jian*,TANG Yong,YANG Hong-yu
(Antibody Engineering Center,Jinan University,Guangzhou 510632,China)
Objective:To prepare the immunomagnetic beads which separated Listeria monocytogenes efficiently and specifically,and to investigate the optimal conditions of coupling reaction for carboxylate-modified magnetic beads and polyclonal antibody,and to evaluate the capture capacity of immunomagnetic beads. Methods:The cell of Listeria monocytogenes was used as antigen for immunization of rabbit to prepare polyclonal antibody and binding affinity between polyclonal antibody,and Listeria monocytogenes was determined.Three main options were set:6 different coupling buffers,6 main coupling time and 6 groups coupling temperature.The optimal coupling conditions were obtained by comparing the antibody surplus of supernatant after coupling.Results:The titer of purified polyclonal antibody which had high binding affinity with Listeria monocytoenes was about 1.3×105.With the coupling buffer of 0.01mol/L 2-(N-Morpholino)ethanesulfonicacid(MES,pH6.0),purified polyclonal antibody was coupled with 1mg carboxylate-modified magnetic beads for 2h at 37℃,and the amount of coupled antibody was 160μg.The capture ratio of newly produced immunomagnetic beads was about 77%.Conclusion:The optimal conditions of coupled reaction were achieved and the immunomagnetic beads were prepared successfully.Comparing with the traditional culture-based methods,the entire procedure for listeria monocytogenes detection could be reduced at least 20 hours prepared with immunomagnetic beads.
immunomagnetic beads;Listeria monocytoenes;coupling
TS201.3
A
1002-0306(2012)05-0323-05
2011-04-06 *通讯联系人
徐金亭(1985-),男,硕士研究生,研究方向:食品安全检测。
广东省科技计划项目(2009B030803010)。

