体外诱导人羊膜上皮细胞分化为角膜上皮样细胞的初步研究△
姚 敏 陈 剑 王文娟 张晓玲 杨筱曦 周 清 徐锦堂
角膜是眼主要的屈光介质,角膜病,尤其是位于中央角膜的病灶,严重影响视力。角膜上皮作为角膜的第一道屏障,易受外伤、炎症的损伤,一旦遭受角膜缘、大面积或累及上皮基底细胞的损伤,上皮难以再生修复保持完整,角膜将失去透明性。
角膜移植术是目前角膜盲最为有效的治疗手段,但因供体的匮乏及免疫排斥反应,研究寻找有效的替代物显得尤为迫切。组织工程领域已有大量研究表明:人羊膜上皮细胞(human amniotic epithelial cells,hAEC)具有胚胎干细胞特性,拥有多能分化潜能,且具有免疫赦免性,是未来组织工程领域理想的种子细胞[1-3]。本实验旨在探索利用人永生化角膜上皮细胞(immortalized human corneal epithelial cells,ihCEC)培养液模拟角膜上皮细胞微环境,诱导hAEC分化为角膜上皮样细胞的可行性。
1 材料与方法
1.1 实验材料 HIV、甲肝、乙肝、衣原体、梅毒等血清学检查均为阴性,(37±1)周妊娠产妇剖宫产羊膜,取自暨南大学附属第一医院。产妇知情同意,本实验经医院医学伦理委员会批准同意。ihCEC株由中山大学眼科中心王智崇教授馈赠。
1.2 主要试剂和仪器 DMEM干粉(Gibco公司,美国),胎牛血清(FBS,杭州四季青公司),胶原酶Ⅱ、Dnase(Sigma公司,美国),胰蛋白酶干粉(Hyclone公司,美国),乙二胺四乙酸二钠(EDTA;Sigma公司,美国),羊抗人 CK12(Santa Cruz公司,美国),驴抗羊IgG二抗异硫氰酸荧光素标记(FITC,康为世纪),CCK8试剂盒(Dojindo公司,日本),丝裂霉素(浙江海正药业);倒置相差显微镜、荧光显微镜(Leica公司,德国),FAC-SCalibur流式细胞仪(Becton Dickinson公司,美国),酶标仪(Safire2公司,瑞士)。
1.3 方法
1.3.1 hAEC的提取、原代及传代培养 无菌条件下取剖宫产术中新鲜羊膜,浸泡于含400×103U·L-1庆大霉素的灭菌PBS中,超净台内用含100×103U·L-1青霉素和100×103U·L-1链霉素的PBS漂洗,轻轻刮去血液、黏液及组织碎屑,漂洗干净后将其剪成1 mm×1 mm大小;加入足量2 g·L-1胶原酶Ⅱ +0.05 g·L-1Dnase孵箱内消化4 h,离心,倒去上清;加入适量 2.5 g·L-1胰酶 +0.2 g·L-1EDTA孵箱内消化5 min,加入完全培养液终止消化,离心,吸去上清,加入含体积分数10%FBS的DMEM培养液,轻轻吹打,形成单细胞悬液,以109L-1密度接种于25 cm2培养瓶中,置含体积分数5%CO2、37℃细胞培养箱内静置培养48 h全量换液,以后每2~3 d换液1次。倒置显微镜观察细胞形态及生长状态。待细胞达80%~90%融合时,以1∶1~2比例传代。
1.3.2 流式细胞仪检测hAEC表面抗原 将生长状态良好的第2-3代hAEC消化后离心收集单细胞悬液,800 r·min-1离心5 min,PBS漂洗 2次,适当稀释,流式细胞仪检测 CD29、CD90、CD105、CD34、HLA-DR。
1.3.3 ihCEC的复苏及传代培养 -80℃取出冻存管,37℃水浴1 min迅速解冻,加入装有8 mL含体积分数10%FBS的DMEM培养液中,轻轻吹打混匀,800 r·min-1离心 5 min,倒去上清,PBS 重悬,再次离心,弃去上清,加完全培养基培养箱内静置培养,第2天换液。待细胞达80%融合时,以1∶3~5比例传代。
1.3.4 不同浓度丝裂霉素对ihCEC增殖活性的影响 将ihCEC以每孔10×103接种于96孔板,实验分5组,每组5个复孔,待贴壁后分别以0 mg·L-1、10 mg·L-1、20 mg·L-1、30 mg·L-1、40 mg·L-1丝裂霉素处理ihCEC 2 h,吸去丝裂霉素,每孔加200 μL含体积分数10%FBS的DMEM培养液培养72 h,CCK8测吸光度,计算增殖抑制率。此后实验组于隔天继续测吸光度,观察不同浓度丝裂霉素作用的稳定性及持续时间。
1.3.5 丝裂霉素处理的 ihCEC细胞培养液对hAEC增殖活性的影响 待ihCEC接近70%融合时,以 10 mg·L-1、20 mg·L-1丝裂霉素作用 ihCEC 2 h后完全培养基继续培养,分别培养12 h、24 h后收集各浓度组培养液,4℃保存备用。取生长状态良好的hAEC以每孔3000个细胞接种于96孔板,实验设5组,分别为A(对照组)、B(10 mg·L-1丝裂霉素培养12 h后培养液组)、C(10 mg·L-1丝裂霉素培养24 h后培养液组)、D(20 mg·L-1丝裂霉素培养12 h后培养液组)、E(20 mg·L-1丝裂霉素培养24 h后培养液组),每组5个复孔,于培养后第1天、第3天、第5天、第7天、第9天CCK8法测各组吸光度,绘制生长曲线。
1.3.6 条件培养基的配制 待ihCEC接近70%融合时吸去培养液,20 mg·L-1丝裂霉素处理细胞2 h后换新鲜培养液,每12 h收集培养液,4℃保存,持续收集5 d,将收集的培养液1000 r·min-1离心3 min。上清以40 μm细胞滤器过滤,除去培养液中杂质及细胞团或碎屑。过滤后的细胞培养液4℃保存1个月内用完或-20℃保存3个月内用完。使用时与完全培养基以1∶1比例混合,即为条件培养基(conditioned media,CM)。
1.3.7 诱导分化实验及间接免疫荧光鉴定 取生长状态良好的P2-3 hAEC,以100×103cm-2密度接种到放有载玻片的6孔板内,待贴壁后换CM培养10 d,40 g·L-1多聚甲醛固定 15 min,3 g·L-1Triton-100破膜30 min,体积分数5%驴血清封闭1 h,加CK12一抗4℃孵育过夜,洗去孵育液,加FITC荧光二抗,室温孵育40 min,洗去孵育液,加DAPI核染,室温孵育30 min,洗去孵育液,滴抗荧光淬灭剂封片,4℃冰箱避光保存,荧光显微镜下观察拍照。以ihCEC为阳性对照,诱导前hAEC为阴性对照,操作步骤同上。
1.4 统计学方法 SPSS 13.0软件包分析处理,1.3.4 所得数据采用单因素方差分析,1.3.5 所得数据采用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 hAEC和ihCEC形态观察 hAEC原代培养细胞片状生长,呈圆形、椭圆形、三角形,细胞边界圆钝,胞浆丰富,胞核饱满,具有很强的立体感,细胞聚集处可见铺路石样外观;其间夹杂少量羊膜间充质细胞,传代时,间充质细胞短时间内即可脱壁,根据这一特点,可在传代过程中获得纯化的hAEC;hAEC原代培养生长缓慢,7~9 d可传代;传代培养后,细胞增殖较为活跃,可见有丝分裂后整齐排列的成对子代细胞(图1A)。ihCEC大小均一,体积较小,初呈三角形、短梭形或不规则多边形,待接近80%融合时,细胞形态一致,呈不规则多边形;生长迅速,3 d即长满呈铺路石样外观;可复层,但最终因接触抑制,细胞迅速凋亡(图1B-C)。
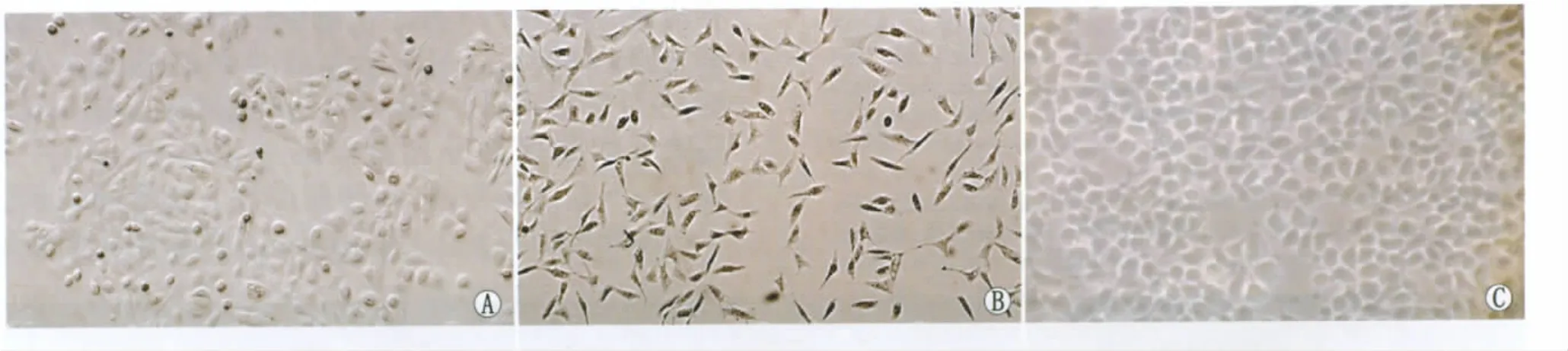
Figure 1 Morphology of hAEC and ihCEC.A:Primary hAEC cultured for 5 days in vitro(×50);B:ihCEC recovered 24 hours(×50);C:ihCEC cultured for 3 dayshAEC和ihCEC形态观察。A:原代hAEC体外培养5 d(×50);B:ihCEC复苏24 h(×50);C:ihCEC培养3 d
2.2 hAEC流式细胞仪鉴定 hAEC可表达胚胎干细胞表面标记分子:CD29(94.87%)、CD90(93.94%)、CD105(33.28%);不表达 CD34(0.12%)、HLA-DR(0.10%)。表明 hAEC 具有干细胞特性可能,且无免疫原性(图2)。

Figure 2 Detection of stem cell surface markers by flow cytometry showed the expression of CD29(94.87%),CD90(93.94%),CD105(33.28%),CD34(0.12%),HLA-DR(0.10%) 流式细胞仪分析 hAEC 表达 CD29(94.87%)、CD90(93.94%)、CD105(33.28%)、CD34(0.12%)、HLA-DR(0.10%)
2.3 丝裂霉素对ihCEC增殖活性的影响 经不同浓度丝裂霉素处理后,ihCEC增殖活性受到不同程度的抑制。处理后培养72 h,增殖抑制率分别为10 mg·L-1(65.48% ±1.03)、20 mg·L-1(77.01% ±0.99)、30 mg·L-1(75.25% ± 0.71)、40 mg·L-1(76.90% ±0.97);10 mg·L-1丝裂霉素增殖抑制作用最小(P<0.05),其他各组差异无统计学意义(P >0.05)。随着时间的延长,10 mg·L-1、30 mg·L-1、40 mg·L-1丝裂霉素组存活细胞大量减少,20 mg·L-1丝裂霉素组抑制作用相对稳定(图3)。
2.4 ihCEC细胞培养液对hAEC增殖活性的影响
B组、C组、D组、E组细胞培养液可促进hAEC增殖(P<0.05),其中 D组促增殖作用最强(P<0.05),而E组培养5 d后明显不利于hAEC的生长(P<0.05)。促增殖各组于培养第3天进入对数增长期,第7天后增殖速度减慢(图4)。

Figure 3 Effects of different concentrations of mitomycin on proliferation activity of ihCEC 不同浓度丝裂霉素对ihCEC增殖活性的影响
2.5 诱导分化实验及间接免疫荧光鉴定 诱导分化10 d,hAEC体积较诱导前变大,细胞边缘锐利,界线明显,呈不规则多边形或三角形;细胞较诱导前变得扁平,细胞表面欠光滑(图5)。间接免疫荧光检测,诱导前hAEC不表达角膜上皮细胞特异性标记物CK12,诱导10 d后hAEC可表达CK12(图6)。

Figure 4 Effects of culture media collected from ihCEC on proliferation activity of hAEC ihCEC培养液对hAEC增殖活性的影响
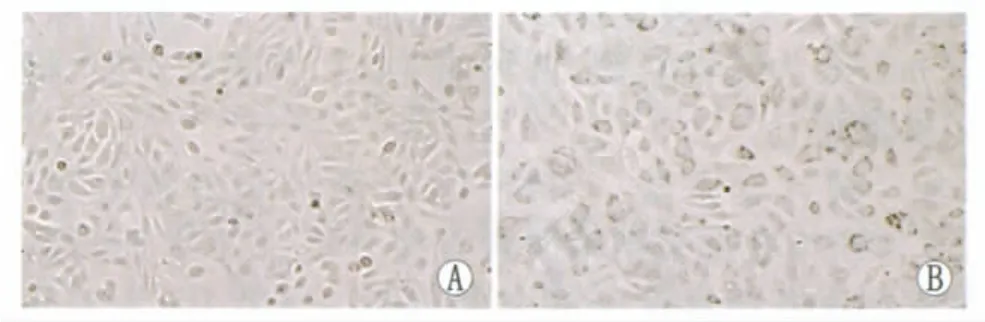
Figure 5 Morphology of hAEC before and after differentiation(×50).A:Before differentiation;B:Differentiating of 10 days hAEC诱导前后的形态观察(×50)。A:诱导前;B:诱导分化10 d
3 讨论
羊膜位于胎盘最内层,为一半透明薄层组织,含有两种细胞成分:羊膜上皮细胞(AEC)、羊膜间充质干细胞(AMSC)。AEC为紧密排列的单层立方细胞,系外胚层来源。Miki等[4-5]研究发现:hAEC表达胚胎干细胞保持分化潜能的关键基因OCT-4和nanog,不表达端粒酶,无肿瘤源性。在不同生长因子和微环境调控下,hAEC可向三个胚层组织细胞分化[3,6]。hAEC 不表达 HLA-A、-B、-C、-DR 和 β2 微球蛋白(β2 m),具有免疫赦免性[7]。Li等[8]研究发现:hAEC分泌可溶性炎症抑制因子,调控固有免疫和适应性免疫。羊膜来源广泛且无道德伦理争议。刘小勇等[9]研究表明:hAEC可向角膜上皮细胞分化。hAEC的以上特性说明其有望成为组织工程角膜的种子细胞。
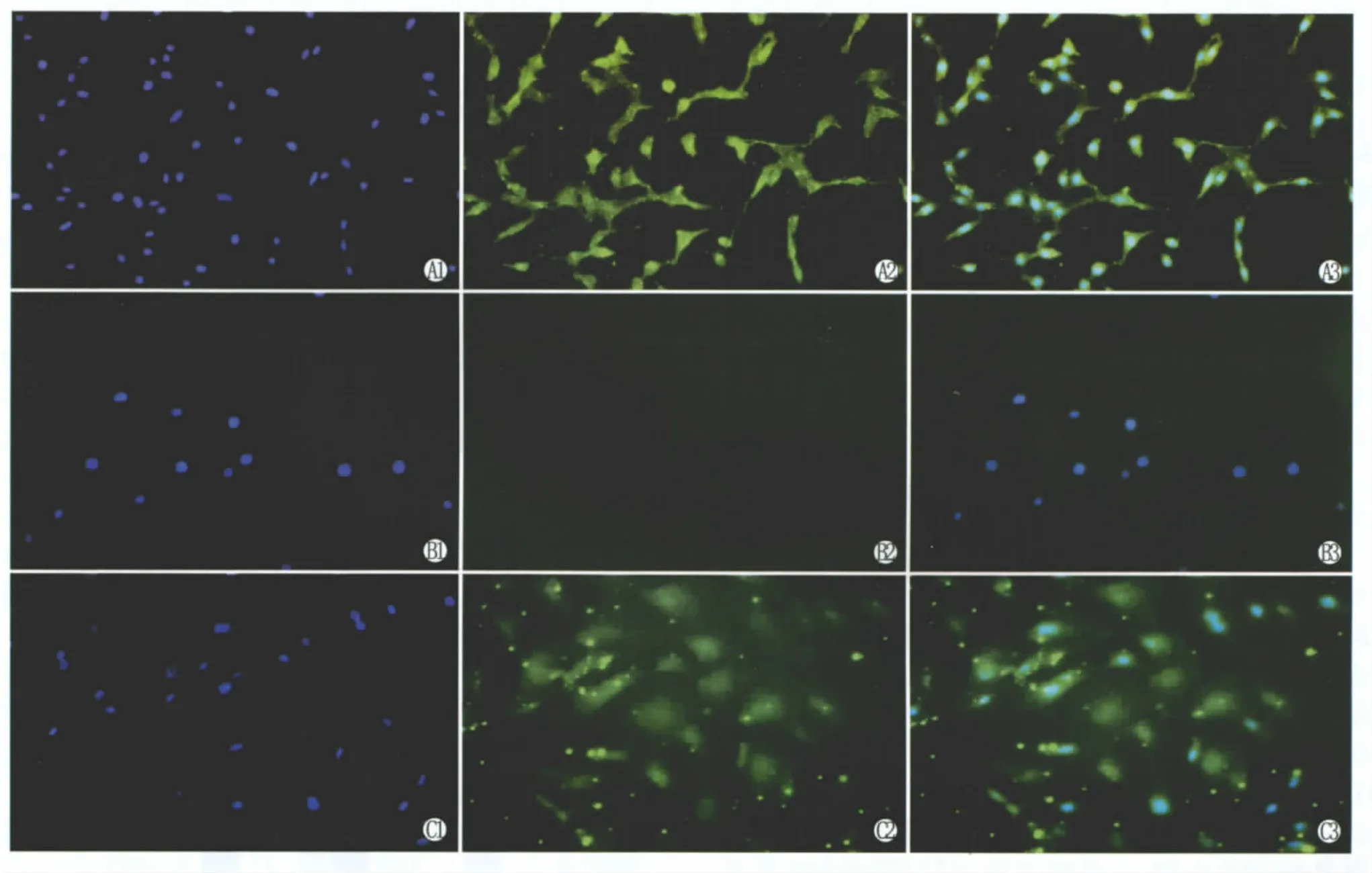
Figure 6 Immunocytochemistry images of CK12 expression before and after differentiation.A:ihCEC expressed CK12(green);B:hAEC expressed no CK12 before differentiation;C:hAEC expressed CK12 after differentiating hAEC of 10 days(1:DAPI staining-blue;2:CK12-FITC staining-green;3:Merge)hAEC诱导前后CK12的免疫荧光细胞化学染色。A:ihCEC表达CK12(绿色);B:诱导前hAEC不表达CK12;C:hAEC诱导分化10 d后可表达CK12(1:DAPI核染:蓝色;2:CK12-FITC染色:绿色;3:DAPI-FITC融合)
Jiang等[10]研究发现:诱导骨髓间充质干细胞转分化为角膜上皮样细胞后再行移植治疗鼠碱烧伤角膜缘干细胞缺乏(LSCD)模型,较未诱导组可明显增加角膜透明度,减少角膜新生血管。由此可见探索向角膜上皮细胞转分化的优化条件具有一定研究价值。细胞所处的微环境决定了细胞增殖、分化及移行能力[11]。近年来大量研究表明:将具有多能分化潜能的种子细胞以目的细胞所处的微环境条件培养,可成功获得阳性表达目的细胞特异性标记物的转分化细胞。国内外研究者提取角膜上皮细胞[12]、角膜基质细胞[10]、角膜缘成纤维细胞[13-14],以收集培养液、非接触共培养或混合培养的方式,模拟角膜上皮细胞微环境,诱导多能干细胞转分化为角膜上皮样细胞。虽然可成功诱导,但是由于人源性角膜组织难以获得,实验多采用动物角膜组织,如兔、鼠、猪、牛等,这就面临着异种移植免疫排斥反应的可能。即使得到人源性角膜组织,细胞提取和培养较为复杂、困难,耗时较长,花费高,且细胞不能无限增殖传代。因此,为了避免以上缺陷,本实验尝试以ihCEC细胞培养液模拟角膜上皮细胞微环境,探索其在组织工程领域应用的可行性。
ihCEC增殖迅速,可无限传代,表达角膜上皮特异性细胞角蛋白[15]。目前ihCEC主要用于药物研究领域,因其致瘤性可能及缺乏屏障功能,在组织工程领域研究应用较少。本实验所用的ihCEC系经改善培养条件、通过连续传代的方法获得的永生化细胞株,未经任何病毒转染或基因逆转录,具有一定安全性[16]。参照 Ahmad 等[13]的实验方法,先用不同浓度丝裂霉素处理ihCEC,抑制其迅速增殖能力,探索最佳浓度,以充分争取时间大量收集细胞培养液。将不同浓度丝裂霉素处理ihCEC后于不同时间收集细胞培养液用以培养hAEC,CCK8法测hAEC生长曲线,结果表明20 mg·L-1丝裂霉素作用12 h收集的细胞培养液具有明显的促增殖作用,说明此浓度此时间收集的细胞培养液含有大量促增殖的可溶性细胞因子;细胞培养液作用7 d后细胞增殖减慢,有进入平台增长期的趋势,符合hAEC生长的一般规律。间接说明该法收集的细胞培养液无致瘤性。将收集的细胞培养液以等比例与完全培养基混合制成CM用于培养hAEC,经形态学观察及免疫细胞化学染色,hAEC可分化为角膜上皮样细胞,说明CM中含有某些成分可以诱导多能干细胞定向朝角膜上皮样细胞分化,但具体是哪些成分还需要进一步深入研究。
本实验为初步研究,仅对转分化后hAEC进行了形态学观察及CK12的检测,不能说明hAEC完全分化为角膜上皮细胞,分化后是否具有角膜上皮细胞的功能亦需进一步研究证实。
1 Insausti CL,Blanquer M,Bleda P,Iniesta P,Majado MJ,Castellanos G,et al.The amniotic membrane as a source of stem cells[J].Histol Histopathol,2010,25(1):91-98.
2 Toda A,Okabe M,Yoshida T,Nikaido T.The potential of amniotic membrane/amnion-derived cells for regeneration of various tissues[J].J Pharmacol Sci,2007,105(3):215-228.
3 Díaz-Prado S,Muiños-Loópez E,Hermida-Gómez T ,Rendal-Vázquez ME,Fuentes-Boquete I,de Toro FJ,et al.Multilineage differentiation potential of cells isolated from the human amniotic membrane[J].J Cell Biochem,2010,111(4):846-857.
4 Miki T,Lehmann T,Cai H,Stolz DB,Strom SC.Stem cell characteristics of amniotic epithelial cells[J].Stem Cells,2005,23(10):1549-1559.
5 Miki T,Strom SC.Amnion-derived pluripotent/multipotent stem cells[J].Stem Cell Rev,2006,2(2):133-142.
6 Parolini O,Alviano F,Bagnara GP,Bilic G,Buhring HJ,Evangelista M ,et al.Concise review:isolation and characterization of cells from human term placenta:outcome of the first international workshop on placenta derived stem cells[J].Stem Cells,2008,26(2):300-311.
7 Adinolfi M,Akle CA,McColl I,Fensom AH,Tansley L,Connolly P,et al.Expression of HLA antigens,beta 2-microglobulin and enzymes by human amniotic epithelial cells[J].Nature,1982,295(5847):325-327.
8 Li H,Niederkorn JY,Neelam S,Mayhew E,Word RA,McCulley JP,et al.Immunosuppressive factors secreted by human amniotic epithelial cells[J].Invest Ophthalmol Vis Sci,2005,46(3):900-907.
9 刘小勇,陈 剑,周 清,吴 静,王彦平,金 玲,等.人羊膜上皮细胞体外培养重建角膜上皮的实验研究[J].中国病理生理杂志,2012,28(4):689-693.
10 Jiang TS,Cai L,Ji WY,Hui YN,Wang YS,Hu D,et al.Reconstruction of the corneal epithelium with induced marrow mesenchymal stem cells in rats[J].Mol Vis,2010,16:1304-1316.
11 Watt FM ,Hogan BL.Out of Eden:stem cells and their niches[J].Science,2000,287(5457):1427-1430.
12 Yu L,Ge J,Wang Z,Huang B,Yu K,Long C,et al.The preliminary experimental study of induced differentiation of embryonic stem cells into corneal epithelial cells[J].Yan Ke Xue Bao,2001,17(3):138-143.
13 Ahmad S,Stewart R,Yung S,Kolli S,Armstrong L,Stojkovic M,et al.Differentiation of human embryonic stem cells into corneal epithelial-like cells by in vitro replication of the corneal epithelial stem cell niche[J].Stem Cells,2007,25(5):1145-1155.
14 Blazejewska EA,Schlötzer-Schrehardt U,Zenkel M,Bachmann B,Chankiewitz E,Jacobi C ,et al.Corneal limbal microenvironment can induce transdifferentiation of hair follicle stem cells into corneal epithelial-like cells[J].Stem Cells,2009,27(3):642-652.
15 Araki-Sasaki K,Ohashi Y,Sasabe T,Hayashi K,Watanabe H,Tano Y,et al.An SV40-immortalized human corneal epithelial cell line and its characterization[J].Invest Ophthalmol Vis Sci,1995,36(3):614-621.
16 王智崇,刘敬波,葛 坚,宋 革,黄 冰,高 楠,等.人角膜上皮细胞系的建立及其特性的研究.中国科技论文在线,2006:1-11.

