钛硅酸钠(Na2Ti2O3SiO4·2H2O)对Cs的吸附热力学分析
王保柱,张 东,石正坤,吴 涛
(1.西南科技大学,四川 绵阳 621010;2.中国工程物理研究院,四川 绵阳 621900)
1989年,美国Sandia国家实验室和Texas A&M 大学的Anthony等联合制备了一种无机离子吸附剂,取名为钛硅酸钠(Crystalline sillicotitanate,CST)。1993年,Anthony 等将此类新的CST 命名为TAM-5。1994年Anthony等和美国环球油品公司(Universal Oil Products Company,UOP)合作,将TAM-5商业化,并推出商用粉末产品IE-910及用于柱分离的粒状产品IE-911[1]。CST 的晶体结构与天然矿物Sitinakite 晶体结构十分相似,CST 的孔道半径与137Cs+的半径相似,CST 和137Cs+的离子交换是不可逆的[2],因此,CST 对137Cs+有很强的选择吸附性。美国能源部、太平洋西北实验室、萨凡纳河基地、橡树岭国家实验室、洛斯阿拉莫斯实验室等用CST 对美国各地所贮存的高放废液中137Cs+的吸附测试,均取得巨大成功[3-9]。由于CST 具有良好的物理化学性质及热稳定性,pH 的适应范围广、负载性好,能很好地用于含137Cs+废液处理后的最终处置。但是在我国,对这类材料缺乏系统的研究,目前,只有清华大学[10-12]和四 川大学[13]有相关 研究,而且还只是停留在实验室阶段,诸多技术远远落后于西方等发达国家。本工作拟从反应平衡时间、反应液浓度,以及温度等方面对CST 吸附Cs的热力学进行研究,为进一步研究CST 对Cs的吸附机理提供有益参考。
1 主要实验材料
1.1 主要仪器与装置
BP211D 型精密电子天平:精度为0.01mg,德国赛多利斯公司;HG-310SC型远红外辐射恒温干燥箱:成都天宇试验设备有限公司;Z-8200型原子吸收分光光度计(AAS):日本日立公司;DZKW-4型电子恒温水浴锅:北京中心伟业仪器有限公司;TDZ5-WS 型自动平衡离心机:赛特湘仪离心机仪器有限公司;pH/cond 340i型手提式pH/电导测试仪:德国WTW 公司。
1.2 主要材料与试剂
钛硅酸钠(Na2Ti2O3SiO4·2H2O,CST):白色粉末状晶体,由西南科技大学合成;HNO3:分析纯,成都市欣海兴化工试剂厂产品;NaOH:分析纯,北京化工厂产品;CsNO3:分析纯,天津市科密欧化学试剂有限公司产品。
2 实验方法
将一定体积预定Cs+浓度的CsNO3溶液放入反应容器中,之后加入一定量的CST,反应平衡后,将其离心并取上清液进行稀释,使得稀释后的溶液中Cs+浓度小于10 mg/L,然后用Z-8200型原子吸收分光光度计(AAS)测量稀释后溶液中Cs+的浓度。
吸附量计算公式为:Q=(C0-C)V/m。式中,C0和C分别为吸附前后溶液中离子浓度,mg/L;V是吸附前溶液的体积,mL;m为吸附材料CST 的质量,mg。
2.1 平衡时间
将250mgCST放入500mL装有250mLCsNO3溶液(Cs+初始浓度C0为50mg/L)的锥形瓶中,用pH/cond 340i型手提式pH/电导测试仪测反应溶液的pH 为6.75,用DZKW-4型电子恒温水浴锅将温度控制在298.15K,每隔一定时间从锥形瓶中取出0.5mL 溶液稀释,离心后作为样品,测量溶液中Cs+的浓度。
2.2 热力学实验
将20mgCST放入装有20mLCsNO3溶液的离心管中,用pH/cond 340i型手提式pH/电导测试仪测反应溶液的pH 为6.75。分别将CsNO3溶液中Cs+的初始浓度设定为10、50、100、200、1 000 及2 000 mg/L,将这些已加入CST 的CsNO3溶液分别放入温度为298.15、313.15、328.15K 的恒温水浴锅中,当达到平衡时间时,将其离心,取上清液,测量溶液中Cs+的浓度。
3 结果与讨论
3.1 吸附时间的确定
在C0=50mg/L、T=298.15K、pH=6.75时,吸附时间对吸附的影响示于图1。由图1可以看出,在吸附反应的前12h,随着吸附时间的延长,吸附量呈线性增长;12~30h,吸附量增加的比较缓慢;30h 以后,吸附量几乎没有变化,可认为此时吸附达到平衡。为了达到更佳的吸附效果,以下实验中Cs的吸附时间均设定为48h。
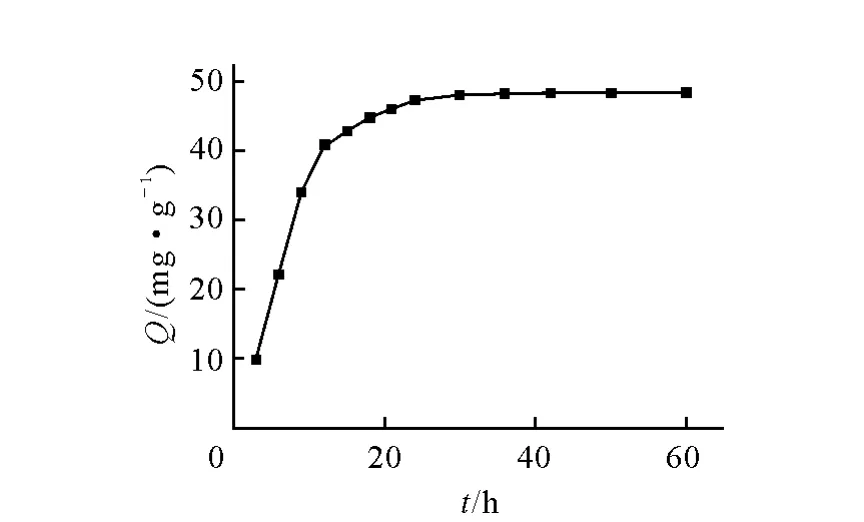
图1 时间对CST吸附Cs的影响
3.2 吸附等温线
CST 在不同温度下吸附Cs+的等温线示于图2。从图2 中可以看出,随着浓度的升高,吸附量也随之增加,浓度较小,曲线的斜率较大,吸附量增加的快;浓度增大,吸附量增加的较缓慢。而且,随着温度的升高吸附量也逐渐增大,这说明CST 对Cs+的吸附是个吸热反应过程。
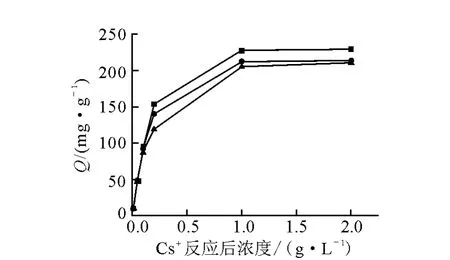
图2 CST吸附Cs的等温线
设C为反应后溶液中离子浓度Qm为饱和吸附量;Q为平衡吸附量。以C/Q对C作图,可得到Langmuir模型的吸附曲线,结果示于图3。图3中直线斜率为1/Qm,截距为1/KLQm。KL为经验常数。以lnQ对lnC作图,可得到Freundlich模型的吸附曲线,结果示于图4。图4中直线斜率为1/n,截距为lnKf。Kf和n为经验常数。
Langmuir方程和Freundlich方程分别列于(1)、(2)式:
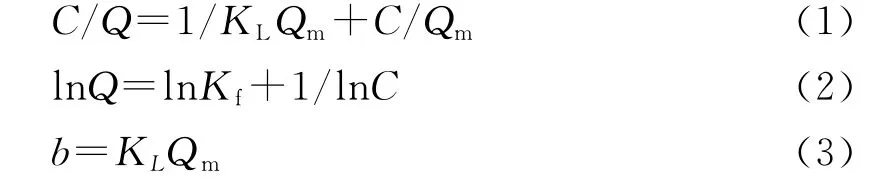
(3)式中,b为Langmuir常数。
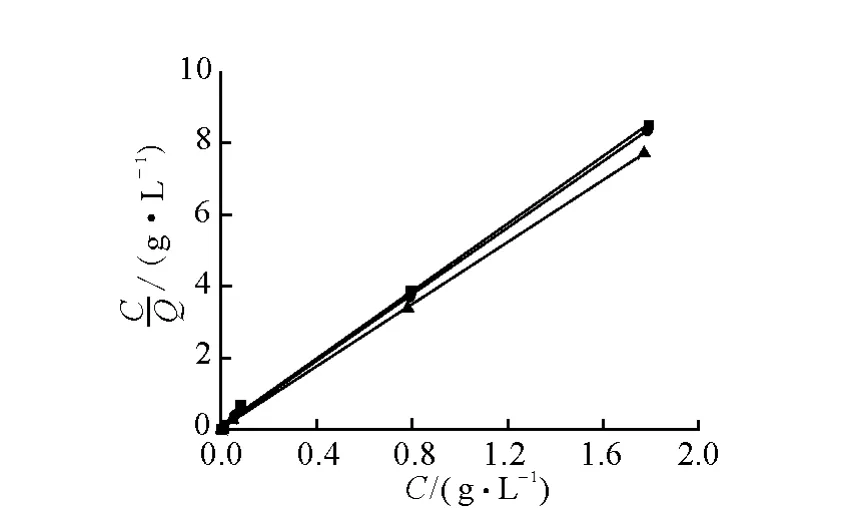
图3 Langmuir方程拟合
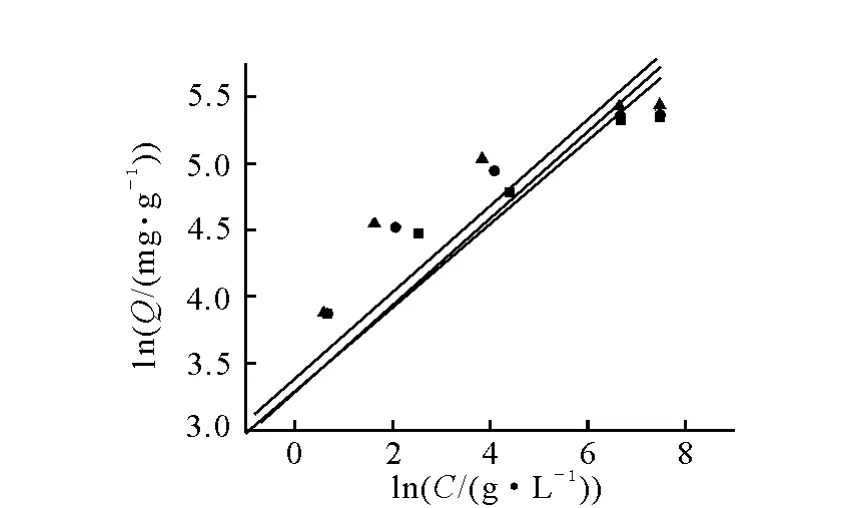
图4 Freundlich方程拟合
通过图3中直线斜率1/Qm,截距1/KLQm,可以得出饱和吸附量Qm和经验常数KL,通过图4中直线斜率1/n,截距lnKf,可以得出经验常数Kf和n。Langmuir方程和Freundlich 方程拟合结果分别列于表1和表2。

表 g方程拟合结果

表2 Freundlich方程拟合结果
比较表1和表2的拟合数据可知,Freundlich方程的线性较差,无法得出线性曲线,因此CST 对Cs的吸附更符合Langmuir吸附模型,当温度为298.15、313.15和328.15K 时,相关系数r2分别为0.999 1、0.999 8和0.999 9。此时对应的饱和吸附量分别为212.8、217.4 和232.6mg/g。
3.3 吸附热力学
为了得出吸附焓和吸附自由能,在不考虑温度对ΔH和ΔS影响的情况下,可近似用吉布斯方程和Langmuir常数求得热力学参数:
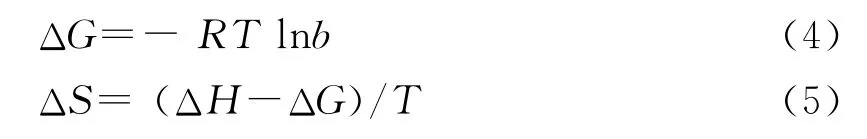
结合(4)、(5)两式可得(6)式:
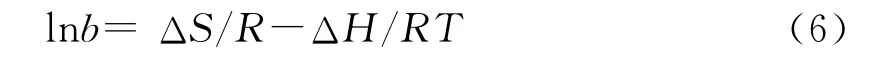
式中,ΔG为吸附自由能,kJ/mol;ΔH为吸附热,kJ/mol;ΔS为吸附熵,J/(K·mol),R为气体常数,J/(K·mol)。
以lnb对1/T作图,结果示于图5。图5中直线斜率为-ΔH/R,截距为ΔS/R。由图5可得出热力学参数吸附热ΔH和吸附熵ΔS。
lnb对 1/T拟合的方程为:y=-255 9.2x+10.802(r2=0.982 9),即-ΔH/R=-255 9.2,ΔS/R=10.802。将气体常数R=8.314J/(K·mol)导入,得到不同温度下的ΔH和ΔS,再用公式(5)求出ΔG,结果列于表3。
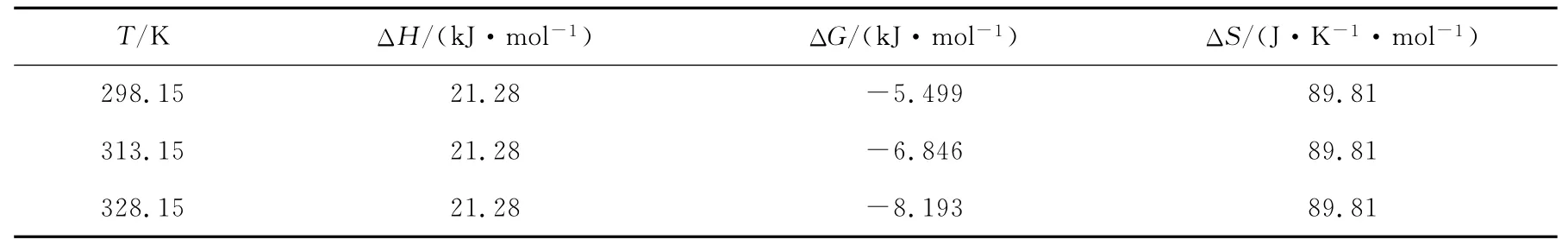
表3 Cs在CST上吸附的热力学参数
由表3可见,ΔG<0,表明吸附过程是自发进行的。温度升高时,-ΔG越大,吸附过程越容易进行,跟前面分析的此吸附过程为吸热反应比较符合。当ΔH<20kJ/mol时,属于物理吸附,当80kJ/mol<ΔH<400kJ/mol时,属于化学吸附[14]。实验中,由于ΔH=21.28kJ/mol,所以此吸附过程既有物理吸附又有化学吸附。
4 结论
(1)本工作实验条件下,在前12h,CST 对Cs的吸附速率较快,当达到30h以后,可认为基本达到吸附平衡。
(2)在pH=6.75,温度为298.15、313.15和328.15K 时,CST 对Cs的最大吸附量分别为212.8、217.4和232.6mg/g。
(3)CST 对Cs的吸附比较符合Langmuir吸附模型。
(4)CST 对Cs的吸附是一个自发的吸热过程,由于ΔH=21.277kJ/mol,所以此吸附过程既有物理吸附又有化学吸附。
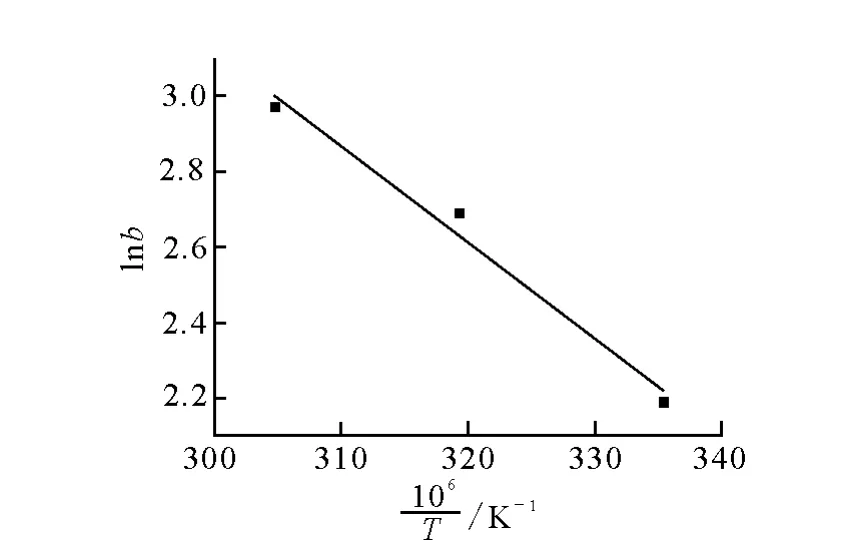
图5 温度对吸附平衡系数的影响
[1]Miller JE,Brown NE.Development and properties of crystalline silicotitanate(CST)ion exchangers for radioactive waste applications[R].Sandia Report,SAND 97-0771.California:Sandia National Laboratory,1997.
[2]Celestian AJ,Clearfield A.The origin of ion exchange selectivity in a porous framework titanium silicate[J].Journal of Materials Chemistry,2007,17(46):4 839-4 842.
[3]Celestian AJ,Kubicki JD,Jonathon Hanson,et al.The mechanism responsible for extraordinary Cs ion selectivity in crystalline silicotitanate[J].Journal of the American Chemical Society,2008,130(35):11 689-11 694.
[4]Oji LN,Martin KB,Hobbs DT.Development of prototype titanate ion-exchange lode-membranes for strontium,cesium and actinide decontamination from aqueous media[J].Journal of Radioanalytical and Nuclear Chemistry,2009,279(3):847-854.
[5]Hamm LL,HangT.Preliminary ion exchange mo-deling for removal of cesium from hanford waste using hydrous crystalline silicotitanate material[R].WSRC-TR-2001-00400,DE-AC09-96SR1850.Aiken,Savannah River Technology Center,Westinghouse Savannah River Company,2002.
[6]Kaminski MD,Nunez L,Pourfarzaneh M,et al.Cesium separation from contaminated milk using magnetic particles containing crystalline silicotitanates[J].Separation and Purification Technology,2000,21:1-8.
[7]Hritzko BJ,Douglas Walker D,Linda Wang NH.Design of a carousel process for cesium removal using crystalline silicotitanate[J].AIChE Journal,2000,46(3):552-564.
[8]US Department of Energy.Vitrification of ion exchange materials[R].Innovative Technology summary report:DOE/EM-0451.South Carolina:Office of Science and Technology,1999.
[9]Venkatesan KA,Sukumaran V,Antony MP,et al.Studies on the feasibility of using crystalline silicotitanates for the separation of cesium-137 from fast reactor high-level liquid waste[J].Journal of Radioanalytical and Nuclear Chemistry,2009,280(1):129-136.
[10]Yu Bo,Chen Jing,Song Cong-li.Crystalline silicotitanatea new type of ion exchange for Cs removal from liquid waste[J].J Master Sci Technol,2002,18(3):206-210.
[11]于波,陈靖,宋崇立.新型除铯环境材料硅钛酸钠孔道结构化合物合成及结构表征[J].无机化学学报,2003,19(2):119-124.
[12]张继荣,鲍卫民,宋崇立.水热法合成钛硅酸盐新型无机离子交换剂[J].离子交换与吸附,2000,16(4):318-323.
[13]杜晓燕.钛硅酸钠无机离子交换材料的制备及对艳的吸附效果研究[D].成都:四川大学,2005.
[14]陈东莲,白丽娟,黄增尉.三聚磷酸二氢铝对Cs+的吸附动力学和热力学[J].环境科学与技术,2011,34(3):105-108.

