类风湿关节炎患者外周血单个核细胞Sonic Hedgehog信号通路表达的初步研究*
王明霞, 黄建林△, 朱尚玲, 彭蔚湘, 谢宝钊, 林灼锋, 古洁若
(1中山大学附属第三医院风湿科,广东 广州 510630;2温州医学院药学院,浙江 温州 325035 )
1000-4718(2012)03-0483-05
2011-09-21
2011-11-02
国家自然科学基金资助项目(No.81072480);广东省自然科学基金资助项目(No.10151008901000210)
△通讯作者 黄建林 Tel:020-85252194;E-mail:jianlin_h@163.com;林灼锋 E-mail:lzfwh@126.com
类风湿关节炎患者外周血单个核细胞Sonic Hedgehog信号通路表达的初步研究*
王明霞1, 黄建林1△, 朱尚玲1, 彭蔚湘1, 谢宝钊1, 林灼锋2△, 古洁若1
(1中山大学附属第三医院风湿科,广东 广州 510630;2温州医学院药学院,浙江 温州 325035 )
目的初步探讨类风湿关节炎(RA)患者外周血单个核细胞(PBMCs)和滑膜组织中Sonic Hedgehog(Shh)信号通路相关因子表达及意义。方法收集符合1987年美国风湿病学会(ACR)RA分类标准、28个关节疾病活动度评分(DAS28)≥3.2,病情活动RA患者(35例)及年龄、性别相匹配的健康志愿者(35例)外周血2 mL,分离PBMCs,提取总RNA,采用实时荧光定量PCR(real-time PCR)检测Shh信号通路中信号肽Shh、膜受体Ptch1和核转录因子Gli1 mRNA的表达。收集10例病情中度活动(DAS28≥3.2)RA患者的滑膜组织,同时收集5例外伤或半月板损伤(无关节炎)者滑膜组织作为对照组,免疫组化检测Shh、Ptch1和Gli1的蛋白表达情况。结果RA患者PBMCs中Shh和Gli1 mRNA的相对表达量分别为1.36±1.48和1.15±0.68,对照组上述信号分子的mRNA表达量分别为0.47±0.25和0.49±0.05,2组差异有统计学意义(P<0.05),Ptch1 mRNA表达在2组间的差异无统计学意义(P>0.05);免疫组化示Shh和Gli1蛋白表达的阳性细胞百分率均高于对照组(P<0.05),Ptch1蛋白表达阳性细胞百分率2组无显著差异(P>0.05)。结论RA患者PBMCs与滑膜组织中检测到Shh通路相关信号分子Shh和Gli1的表达上调,提示RA患者中可能存在Shh信号通路的激活,其在RA发病机制中的作用值得进一步研究。
关节炎,类风湿; Sonic Hedgehog通路; 单核细胞; 滑膜
类风湿关节炎(rheumatoid arthritis, RA)是一种好发于青壮年、以对称性多关节炎为主要表现的异质性、系统性自身免疫性疾病[1]。迄今为止,RA的发病机制未能完全阐明,治疗方面也缺乏特别有效的方法。有研究表明成纤维样滑膜细胞过度增殖以及滑膜血管新生是RA滑膜炎和关节破坏的最主要原因[2]。在肿瘤中Sonic Hedgehog(Shh)信号通路与肿瘤血管生成密切相关[3]。Shh信号通路主要由3部分组成:Hedgehog(Hh)配体Shh、Indian Hedgehog(Ihh)和Desert Hedgehog(Dhh),跨膜受体Patched(Ptch)和Smoothened(Smo)及核转录因子脑胶质细胞瘤相关原癌基因家族glioma-associated oncogene-1(Gli1)、glioma-associated oncogene-2(Gli2)和glioma-associated oncogene-3(Gli3)[4-5]。其中Hh是启动因子;Ptch是效应细胞膜表面受体;Gli是转录效应器。当缺乏Hh时,Ptch与Smo结合并抑制Smo的活性,Gli复合物以非全长的形式发挥转录抑制功能;当Hh存在时,则Hh与Ptch结合,解除了Ptch对Smo的抑制作用,激活下游的Gli转录因子,以全长形式转入核内引起靶基因的转录[6]。
Jorgensen等[7]曾推测Hedgehog 基因家族可能参与RA的发病,但是具体机制未进一步阐明。本研究采用实时荧光定量PCR(real-time PCR)法检测了病情活动的RA患者外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)中Shh信号通路中信号肽Shh、膜受体Ptch1和核转录因子Gli1 mRNA表达,并用免疫组化方法检测了RA滑膜中上述信号分子的蛋白表达情况。
材 料 和 方 法
1材料
人淋巴细胞分离液购自天津灏洋生物,Trizol购自Invitrogen。无水乙醇、异丙醇、三氯甲烷购自广州东征公司。明胶购自Sigma,DNA marker购自北京天根生物。PrimeScript RT reagent Kit、SYBR Premix Ex Tap Kit购自TaKaRa。免疫组化试剂:Ⅰ抗Shh(mouse IgG)抗体购自Sigma,Gil1(rabbit IgG)和Ptch1(goat IgG)抗体购自Santa Cruz;Ⅱ抗购自Dako。
2研究对象
收集2010年1月~2011年6月在我院门诊和住院的符合1987年美国风湿病学会(ACR)RA分类标准的病情中度活动(DAS28评分均≥3.2)的RA患者共35例,其中女性28例,男性7例,年龄26~66岁,中位年龄48岁。以健康志愿者(35名)作为对照组,其中女性27例,男性8例,年龄25~67岁,中位年龄46岁。2组年龄、性别差异无统计学意义(P>0.05)。获得病人及志愿者的知情同意后抽静脉血2 mL,采用肝素抗凝。
收集10例我院关节外科住院且病情中度活动(DAS28≥3.2)需行关节置换手术RA患者的滑膜组织,同时收集5例外伤或半月板损伤(无关节炎)者滑膜组织作为对照。滑膜组织用4 %多聚甲醛固定,石蜡包埋。
3方法
3.1Real-time PCR检测信号分子的表达 肝素抗凝静脉血2 mL,常规密度梯度离心法分离PBMCs,Trizol法提取总RNA,紫外分光光度计检测标本浓度及纯度,要求A260/280在1.8~2.0,按TaKaRa两步法试剂盒提供的说明书进行逆转录及定量PCR操作。Real-time PCR检测Shh、Ptch1和Gli1mRNA的表达。引物序列如下:(1)GAPDH正义链5’-GCACCGTCAAGGCTGAGAAC-3’,反义链5’-TGGTGAAGACGCCAGTGGA-3’;(2)Shh:正义链5’-TCCAGAAACTCCGAGCGATTTAAG-3’,反义链5’- CACTCCTGGCCACTGGTTCA-3’;(3)Ptch1,正义链5’-CTGCGTCAGCAGAGTGATTC-3’,反义链5’-AGCTGAGGGTGTCCTGTGTC -3’,(4)Gli1正义链5’-AGGGAGTGCAGCCAATACAG-3’,反义链5’-CCGGAGTTGATGTAGCTGGT -3’。PCR反应条件:95 ℃ 30 s ,95 ℃ 5 s,60 ℃ 31 s,循环40次。融解曲线:95 ℃ 15 s,60 ℃ 60 s, 95 ℃ 15 s。反应在ABI 7000定量荧光PCR仪上进行,每一轮反应均设置复孔及阴性对照。应用比较Ct法进行相对定量,目标基因的相对定量用2-ΔΔCt来计算。反应结束后取每对样品的PCR产物8 μL,行1. 5%琼脂糖凝胶电泳(120V、20 min),凝胶成像系统拍摄进行验证。
3.2免疫组织化学检测 石蜡包埋的组织经脱蜡,0.3% H2O210 min 阻断内源性过氧化酶活性。微波炉抗原热修复处理。10%正常山羊血清室温湿盒封闭30 min。滴加Ⅰ抗4 ℃过夜,PBS洗5 min,3次。Ⅱ抗室温湿盒40 min。DAB显色后,苏木素复染,脱水,透明,中性树胶封片。每项实验都有阴性对照(缺少Ⅰ抗),胞内、胞膜或胞核出现棕黄色颗粒为阳性表达。每张玻片在400倍高倍镜下观察5个视野,计数阳性细胞数和总细胞数,计算阳性细胞表达率。阳性表达率(%)= 阳性细胞数/总细胞数×100%。评判标准如下:未见阳性细胞者为阴性(-);< 25%为弱阳性(+); 25% ~ 75%为中度阳性(++);> 75%为强阳性(+++)。
4统计学处理
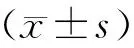
结 果
1Real-timePCR检测Shh信号分子Shh、Ptch1和Gli1mRNA在PBMCs中的表达
从表1中可见,与对照组相比,RA组的Shh mRNA和Gli1 mRNA的表达量升高,差异有统计学意义(P<0.05);而Ptch1 mRNA的表达量2组之间无明显差异(P>0.05)。同时对PCR产物进行了琼脂糖凝胶电泳,以验证目的基因的图谱,见图1,结果与real-time PCR产物大小相符。
2RA滑膜组织免疫组织化学结果
图2可见Shh蛋白在滑膜组织以胞膜及胞质均可见表达,以胞膜为主,见图2A。Ptch1蛋白在滑膜组织以胞膜表达为主,见图2C。Gli1蛋白在滑膜组织以胞核表达为主,见图2E。

Figure 1. The PCR results for Shh, Ptch1 and Gli1.Lane 1, 6: marker; Lane 2, 7: Shh; Lane 4, 9: Ptch1; Lane 5, 10: Gli1; Lane 3, 8: GAPDH.
图1PCR产物凝胶电泳图
表1Shh、Ptch1和Gli1mRNA在PBMCs中的表达结果


GroupShhPtch1Gli1RA1.36±1.48*1.22±0.691.15±0.68*Control0.47±0.251.18±0.850.49±0.05
*P<0.05vscontrol.

Figure 2. The immunohistochemical staining of synovial tissues from RA and control groups (DAB, ×400). A, C, E and G: RA group; B, D, F and H: control group; A, B: Shh; C, D: Ptch1; E, F: Gli1; G, H: negative control.
图2类风湿关节炎和对照组滑膜组织的免疫组化结果
表2为类风湿关节炎组和对照组滑膜组织Shh、Ptch1和Gli1蛋白表达的半定量分析。RA组Shh和Gli1蛋白中度阳性表达率分别为80%(8/10)和20%(2/10),明显高于对照组的40%(2/5)和0(0/5),P<0.05。Ptch1蛋白中度阳性表达RA组为4/10、对照组为2/5,比率均为40%,差异无统计学意义(P>0.05);3种蛋白均未见强阳性表达。RA组表达Shh和Gli1蛋白的阳性百分率均高于对照组,差异有统计学意义(P<0.05)。虽然RA组Ptch1蛋白表达阳性率较对照组稍高,但差异无统计
学意义(P>0.05)。
讨 论
Shh信号通路是一个进化保守的信号家族,首先在果蝇中发现[8-9],随后又在脊椎动物中被证实。正常情况下Shh信号通路调控着胚胎期组织细胞的生长分化,胚胎发育成熟后,进入失活状态。近来研究发现在人类多种肿瘤中Shh信号通路存在异常激活[10-17],而Shh通路激活后其下游血管内皮生长因子(VEGF)合成增加[18],促进肿瘤血管的增生。RA基本病理改变为关节滑膜慢性炎症,形成侵袭性血管翳,后者可破坏软骨、骨与周围组织。
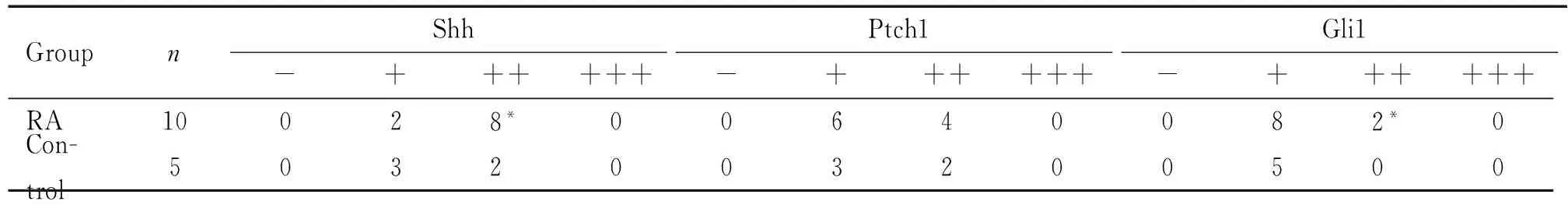
表2 RA及对照组Shh、Ptch1和Gli1蛋白的表达半定量分析
*P<0.05vscontrol.
目前认为,Shh信号通路主要由Hh配体、2个膜受体Ptch和Smo及下游的转录因子Gli组成[19]。本研究采用实时荧光定量PCR方法检测Shh通路中的信号肽Shh,膜受体Ptch1和核转录因子Gli1 mRNA的表达情况。结果发现RA组外周血PBMCs的Shh与Gli1 mRNA的表达量明显高于对照组,而Ptch1 mRNA的表达与对照组相比无明显差异。提示Shh信号通路在活动性RA患者的PBMCs中存在基因转录增多激活。RA患者PBMCs细胞中是否有蛋白水平的翻译表达尚需进一步验证。
本研究采用免疫组化的方法从蛋白角度检测了Shh通路中的信号肽Shh,膜受体Ptch1和核转录因子Gli1在滑膜组织的表达情况。结果发现Shh和Ptch1蛋白在滑膜组织以细胞膜表达为主。Gli1蛋白在滑膜组织中以细胞核表达为主,其蛋白表达位置与肿瘤组织相似[20-21]。此外,本研究还显示RA滑膜组织中Shh和Gli1蛋白中度阳性表达率均高于对照组,进一步提示Shh信号通路在RA滑膜组织可能存在异常激活。
Hedgehog信号通路激活有几种表现:配体依存性和非配体依存性。本研究发现RA患者中配体Shh的表达在基因与蛋白水平都较正常对照组升高,提示该通路为配体依存性激活。配体表达水平改变而导致通路的激活可能是Sonic Hedgehog信号通路在RA的主要作用机制。
有研究[22-23]发现,Shh通路参与器官的急慢性损伤,在慢性肺损伤与急性脑损伤时均可引起此通路的激活。对照组5例滑膜组织亦可见蛋白的弱阳性表达,可能是由于对照组虽无明显关节炎,但是急慢性炎症损伤可能激活机体相应的保护机制,从而导致此通路的部分表达。
总之,本实验通过real-time PCR和免疫组化方法从基因和蛋白水平对RA患者PBMCs和滑膜组织中Shh信号通路相关分子进行了检测,初步证明了RA患者中可能存在Shh信号通路的激活。其在RA发病机制中所扮演的角色值得进一步研究。
[1] Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J]. Ann Rheum Dis, 2010, 69(9):1580-1588.
[2] 王建竹, 孔祥英, 林 娜. ERK信号转导通路与类风湿关节炎[J]. 中国病理生理杂志, 2011, 27(2):398-402.
[3] Wicking C, Smyth I, Bale A. The hedgehog signalling pathway in tumorigenesis and development[J]. Oncogene, 1999, 18(55):7844-7851.
[4] Ruiz i Altaba A, Snchez P, Dahmane N. Gli and hedgehog in cancer: tumours, embryos and stem cells[J]. Nat Rev Cancer, 2002, 2(5):361-372.
[5] Sengupta A, Banerjee D, Chandra S, et al. Deregulation and cross talk among Sonic hedgehog, Wnt, Hox and Notch signaling in chronic myeloid leukemia progression[J]. Leukemia, 2007, 21(5):949-955.
[6] Varjosalo M, Taipale J. Hedgehog: functions and mechanisms[J]. Genes Dev, 2008, 22(18):2454-2472.
[7] Jorgensen C, Noel D, Gross G. Could inflammatory arthritis be triggered by progenitor cells in the joints[J]. Ann Rheum Dis, 2002, 61(1):6-9.
[8] Parisi MJ, Lin H. The role of the hedgehog/patched signaling pathway in epithelial stem cell proliferation: from fly to human[J]. Cell Res, 1998, 8(1):15-21.
[9] Fan H, Oro AE, Scott MP, et al. Induction of basal cell carcinoma features in transgenic human skin expressing Sonic Hedgehog[J]. Nat Med, 1997, 3(7):788-792.
[10]Daya-Grosjean L, Couve-Privat S. Sonic hedgehog signaling in basal cell carcinomas[J]. Cancer Lett, 2005, 225(2):181-192.
[11]Berman DM, Karhadkar SS, Hallahan AR, et al. Medulloblastoma growth inhibition by hedgehog pathway blockade[J]. Science, 2002, 297(5586):1559-1561.
[12]Watkins DN, Berman DM, Burkholder SG, et al. Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer[J]. Nature, 2003, 422(6929):313-317.
[13]Mori Y, Okumura T, Tsunoda S, et al. Gli-1 expression is associated with lymph node metastasis and tumor progression in esophageal squamous cell carcinoma[J]. Oncology, 2006, 70(5):378-389.
[14]Ten HA, Bektas N, von SS, et al. Expression of theglioma-associatedoncogenehomolog(GLI) 1 in human breast cancer is associated with unfavourable overall survival[J]. BMC Cancer, 2009, 9:298.
[15]Karhadkar SS, Bova GS, Abdallah N, et al. Hedgehog signalling in prostate regeneration, neoplasia and metastasis[J]. Nature, 2004, 431(7009):707-712.
[16]Liao X, Siu MK, Au CW, et al. Aberrant activation of hedgehog signaling pathway in ovarian cancers: effect on prognosis, cell invasion and differentiation[J]. Carcinogenesis, 2009, 30(1):131-140.
[17]Feng YZ, Shiozawa T, Miyamoto T, et al. Overexpression of hedgehog signaling molecules and its involvement in the proliferation of endometrial carcinoma cells[J]. Clin Cancer Res, 2007, 13(5):1389-1398.
[18]Kasper M, Schnidar H, Neill GW, et al. Selective modulation of Hedgehog/GLI target gene expression by epidermal growth factor signaling in human keratinocytes[J]. Mol Cell Biol, 2006, 26(16):6283-6298.
[19]周昱男, 胡 波. Shh基因在胚胎发育过程中的调控作用[J]. 中国病理生理杂志, 2008, 24(6):1240-1243.
[20]车 利, 任 军, 袁艳华, 等. Sonic Hedgehog信号传导通路基因在肝癌中的表达[J]. 北京大学学报:医学版, 2008,40(6):616-623.
[21]许秋然, 郑 鑫, 姚英民, 等. Hedgehog通路下游转录因子Gli1在肝细胞癌中的表达及其临床意义[J]. 细胞与分子免疫学杂志, 2011, 27(4):428-432.
[22]Amankulor NM, Hambardzumyan D, Pyonteck SM, et al. Sonic hedgehog pathway activation is induced by acute brain injury and regulated by injury-related inflammation[J]. J Neurosci, 2009, 29(33):10299-10308.
[23]Stewart GA, Hoyne GF, Ahmad SA, et al. Expression of the developmental Sonic hedgehog (Shh) signalling pathway is up-regulated in chronic lung fibrosis and the Shh receptor patched 1 is present in circulating T lymphocytes[J]. J Pathol, 2003, 199(4):488-495.
PreliminarystudyofSonicHedgehogsignalingpathwayinrheumatoidarthritis
WANG Ming-xia1, HUANG Jian-lin1, ZHU Shang-ling1, PENG Wei-xiang1, XIE Bao-zhao1, LIN Zhuo-feng2, GU Jie-ruo1
(1DepartmentofRheumatology,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China;2PharmacySchool,WenzhouMedicalCollege,Wenzhou325035,China.E-mail:jianlin_h@163.com;zflwh@126.com)
AIM: To investigate the expression of Sonic Hedgehog (Shh) signaling pathway-associated factors in peripheral blood mononuclear cells (PBMCs) and synovial tissues of rheumatoid arthritis (RA).METHODSThe mRNA expression levels of Shh, Ptch1 and Gli1 in PBMCs of 35 RA patients, and 35 age-and sex-matched healthy controls were analyzed by real-time PCR. The expression of Shh, Ptch1 and Gli1 in synovial tissues was detected by immunohistochemisty assay in 10 RA patients and 5 patients with traumatic or meniscal injury (no arthritis) as control group. All patients accorded with the American College of Rheumatology (ACR) 1987 revised classification criteria for determining RA, and the score of DAS28 was ≥3.2.RESULTSThe results of real-time PCR showed that the expression of Shh and Gli1 mRNA in RA patients was higher than that in the controls (Shh and Gli1 in RA were 1.36±1.48 and 1.15±0.68, while Shh and Gli1 in control group were 0.47±0.25 and 0.49±0.05, respectively). The mRNA expression of Ptch1 between the 2 groups had no significant difference. Similarly, the results of immunohistochemistry assay showed that the positive staining rates of Shh and Gli1 in RA group were higher than those in control group. However, no difference of Ptch1 positive staining rate between the 2 groups was observed (P>0.05).CONCLUSIONThe positive expression of Shh and Gli1 indicates the activation of Shh signaling pathway in the RA patients.
Arthritis, rheumatoid; Sonic Hedgehog pathway; Monocytes; Synovial membrane
R593
A
10.3969/j.issn.1000-4718.2012.03.017

