上调SMYD3对人胆管癌FRH0201细胞中DNMT3B表达及细胞增殖的影响*
程 帝, 李志花△, 陈汝福, 郭 宁, 廖巧芳, 郑礼平, 周泉波, 周嘉嘉
(中山大学孙逸仙纪念医院 1肿瘤科,2肝胆外科,广东 广州 510120)
1000-4718(2012)03-0415-05
2011-10-31
2012-01-09
国家自然科学基金资助项目(No.30872485)
△通讯作者Tel:020-81332107;E-mail: chenrf63@163.com
上调SMYD3对人胆管癌FRH0201细胞中DNMT3B表达及细胞增殖的影响*
程 帝1, 李志花1△, 陈汝福2, 郭 宁2, 廖巧芳1, 郑礼平1, 周泉波2, 周嘉嘉2
(中山大学孙逸仙纪念医院1肿瘤科,2肝胆外科,广东 广州 510120)
目的研究人胆管癌细胞株FRH0201中SET和MYND结构域含有蛋白3(SET and MYND domain-containing protein 3,SMYD3)过度表达对DNA甲基化转移酶3B(DNA methyltransferase 3B,DNMT3B)表达及细胞增殖能力的影响。方法瞬时转染SMYD3真核表达质粒后, RT-PCR检测细胞中DNMT3B mRNA水平的变化;Western blotting检测细胞中DNMT3B蛋白水平的变化;CCK-8检测细胞增殖能力的改变;流式细胞术检测细胞周期的改变。结果以未处理组为对照,胆管癌细胞FRH0201在转染pEGFP-C3-SMYD3质粒后,DNMT3B蛋白及mRNA表达均显著上升(P<0.01);细胞的增殖能力显著提高、细胞增殖速度加快(P<0.05);进入G2/M期的细胞明显增多(P<0.05)。结论过度表达SMYD3,可引起细胞中DNMT3B的表达上调并增强细胞增殖能力。
FRH0201细胞; 甲基化; 组蛋白甲基化转移酶; DNA甲基化转移酶
SET和MYND结构域含有蛋白3(SET and MYND domain-containing protein 3,SMYD3)是一种具有组蛋白H3-K4特异性甲基化活性的甲基化转移酶。SMYD3可特异性结合下游靶基因启动子区域5′-CCCTCC-3′序列,发挥转录调节活性,上调靶基因的表达[1]。研究发现,SMYD3在结肠癌、肝癌、乳腺癌及肝门部胆管癌中均呈现过表达[1-3]。DNA甲基化转移酶3B(DNA methyltransferase 3B,DNMT3B)是DNA甲基化转移酶家族成员之一,表现出从头甲基化的作用。DNMT3B在正常的成体细胞中丰度较低,主要存在于胚胎细胞及肿瘤细胞中[4-5]。本研究通过上调细胞中SMYD3的表达,探讨过度表达的组蛋白甲基化转移酶SMYD3能否引起DNMT3B的表达上调,及对肝门部胆管癌细胞增殖活性的影响。
材 料 和 方 法
1材料
人肝门部胆管癌细胞株FRH0201由山东大学齐鲁医院吴小鹏教授惠赠;胎牛血清、RPMI-1640培养基及胰蛋白酶购自Gibco;脂质体Lipofectamine LTX with Plus Reagent购自Invitrogen;SMYD3真核表达质粒pEGFP-C3-SMYD3由本实验室构建;SMYD3兔抗人多克隆抗体购自Santa Cruz;DNMT3B兔抗人多克隆抗体购自Abcam;总RNA 提取试剂Trizol购自Invitrogen;逆转录聚合酶链反应(RT-PCR)试剂购自TaKaRa;CCK-8试剂购自日本同仁化学研究所。
2方法
2.1细胞培养及转染 将FRH0201细胞用含10%胎牛血清的RPMI-1640培养基,在37 ℃、体积分数5%CO2和相对湿度95%的恒温培养箱中培养。转染前24 h,取对数生长期细胞消化、重悬,调整单细胞悬液的细胞密度为5×108cells/L,以2 mL/well细胞悬液接种于6孔培养板中。待细胞生长24h后,细胞汇合度约70%时开始转染。转染前2h更换新鲜培养基。取2.5 μg质粒DNA溶于500 μL Opti MEM中,混匀;取2.5 μL Plus混匀于Opti MEM-质粒DNA混合液中,静止5 min;取7.5 μL LTX混匀于Opti MEM-质粒DNA-Plus混合液中,静止30 min;最后将Opti MEM-质粒DNA-Plus-LTX预混液加入各孔培养液中,混匀。转染后8 h更换新鲜培养基。实验设计分3组:未处理组、转染pEGFP-C3空白载体组、转染pEGFP-C3-SMYD3质粒组。
2.2RT-PCR检测SMYD3、DNMT3B的mRNA表达 转染后24 h,Trizol法抽提细胞总RNA。按照RT-PCR试剂操作说明合成cDNA。以cDNA为模板进行PCR反应。SMYD3上游引物5′-TGGCAAACTGCAGCTACATCAAG-3′,下游引物5′-CTGATGTTGGCGTCGCATTC-3′,产物为150 bp;DNMT3B上游引物5′-GGCCACCTTCAATAAGCTCGTC-3′,下游引物5′-CCACTCCAACATGGGCTTCA-3′,产物为139 bp;β-actin上游引物5′-TGGCACCCAGCACAATGAA-3′,下游引物5′- CTAAGTCATAGTCCGCCTAGAAGCA-3′,产物为186 bp。PCR反应参数:94 ℃ 3 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,共30个循环,72 ℃ 10 min。PCR产物经20 g/L琼脂糖凝胶电泳鉴定,凝胶成像系统拍摄并分析结果。
2.3Western blotting 检测SMYD3、DNMT3B的蛋白表达 转染后48 h,收集细胞提取细胞总蛋白,BCA法测定蛋白浓度。配制8% SDS-PAGE凝胶,各上样孔加入30 μg定量后的蛋白样品,60 V电泳30 min,100 V电泳90 min。300 mA转膜120 min。将转印好的PVDF膜置于50 g/L的脱脂奶粉中封闭2 h。然后分别加入SMYD3 兔抗人多克隆抗体(1∶400)、DNMT3B兔抗人多克隆抗体(1∶1 000)4 ℃孵育过夜。TBST洗涤10 min,重复3次后。再加入辣根过氧化物酶标记的山羊抗兔抗体(1∶5 000),室温孵育1 h。TBST洗涤10 min,重复3次。最后用ECL显影,胶片曝光。扫描胶片成像,图片经Quantity One软件分析灰度值。取SMYD3、DNMT3B与tubulin灰度值之比作为蛋白的相对表达量。
2.4CCK-8检测细胞增殖能力变化 取对数生长期细胞,用含10%胎牛血清的RPMI-1640培养基重悬为单细胞悬液,调整细胞密度为5×106cells/L,以100 μL/well细胞悬液接种于96孔培养板中。置于37 ℃、体积分数5%CO2和相对湿度95%的恒温培养箱中培养24 h,待细胞汇合度约70%时,开始转染。转染过程中,Opti MEM、质粒DNA、Plus、LTX的使用剂量分别调整为:20 μL、0.1 μg、0.1 μL、0.3 μL,其余操作步骤同“2.1 细胞培养及转染”。实验分为3组:未处理组、转染pEGFP-C3空白载体组、转染pEGFP-C3-SMYD3质粒组。分别在转染8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h后,更换为不含抗生素的新鲜培养基,并向每孔加入10 μL CCK-8溶液。37 ℃孵育2 h,用酶标仪测定在450 nm处的吸光度(A值)。计算细胞增殖率,细胞增殖率(%)=(处理组孔A值-空白孔A值)/(对照组孔A-空白孔A)×100%。
2.5流式细胞仪检测转染效率、分析细胞周期 取对数生长期细胞,调整细胞密度为5×108cells/L,以2 mL/well单细胞悬液接种于6孔培养板中。转染前6 h,将6孔板中的培养基更换为无血清的RPMI-1640培养基,于培养箱中培养6 h,使各孔细胞的细胞周期同步化。其余转染步骤同“2.1 细胞培养及转染”。转染24 h后,用胰酶消化收集细胞,PBS洗2遍,离心后弃上清,加入1 mL 70%预冷乙醇,吹打均匀,4 ℃固定过夜。上机前离心收集细胞,PBS洗涤,用含RNA酶的1%碘化丙啶(propidium iodide,PI,Sigma)染色30 min。采用流式细胞仪检测分析细胞周期。
3统计学处理
结 果
1SMYD3对DNMT3BmRNA表达的影响
RT-PCR结果显示:转染pEGFP-C3-SMYD3质粒组的SMYD3及DNMT3B mRNA表达水平均较未处理组明显升高,吸光度比值分别为6.721±0.105和4.105±0.093,差异有统计学意义(P<0.01);而转染pEGFP-C3空白载体组与未处理组的SMYD3及DNMT3B mRNA表达水平则无明显差异,吸光度比值分别为1.180±0.043和1.007±0.047,差异无统计学意义(P>0.05),见图1。
2SMYD3对DNMT3B蛋白表达的影响
Western blotting结果显示:转染pEGFP-C3-SMYD3质粒组的SMYD3及DNMT3B 蛋白表达水平较未处理组明显升高,灰度比值分别为1.708±0.102和2.547±0.114,差异有统计学意义(P<0.01);而转染pEGFP-C3空白载体组与未处理组的SMYD3及DNMT3B 蛋白表达水平则无明显差异,灰度比值分别为0.915±0.077和1.002±0.102,差异无统计学意义(P>0.05),见图2。
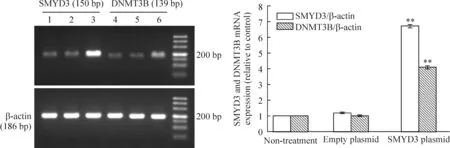
Figure 1. Effect of SMYD3 over-expression on expression of DNMT3B mRNA.1,4: non-treatment; 2,5: empty plasmid; 3,6: SMYD3 plasmid.**P<0.01vsnon-treatment.
图1SMYD3对DNMT3BmRNA表达的影响
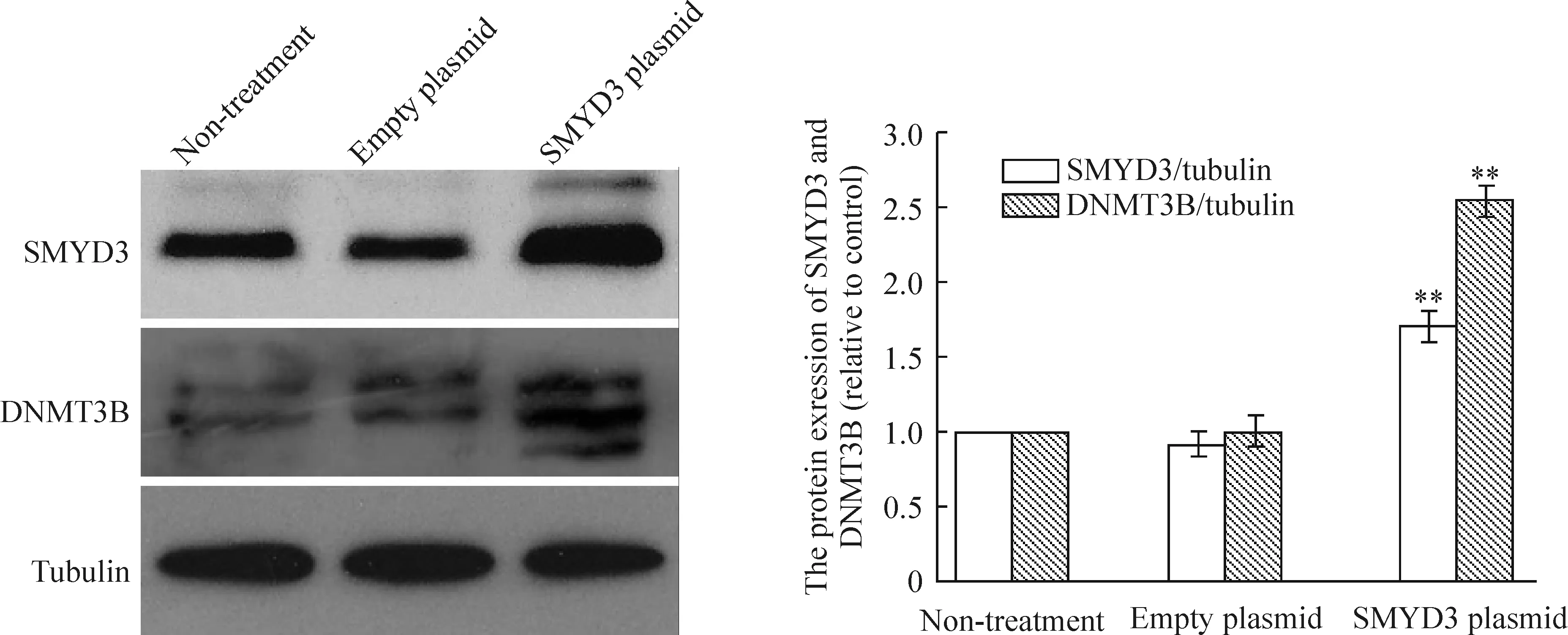
Figure 2. Effect of SMYD3 over-expression on expression of DNMT3B protein.**P<0.01vsnon-treatment.
图2SMYD3对DNMT3B蛋白表达的影响
3SMYD3对细胞生长曲线的影响
CCK-8检测细胞生长曲线,结果显示:转染pEGFP-C3-SMYD3质粒的FRH0201细胞生长曲线较陡,斜率较大。20~40 h,吸光度值始终显著高于未处理组的细胞,细胞增殖能力显著强于未处理组细胞,差异有统计学意义(P<0.05);而转染pEGFP-C3空白载体的FRH0201细胞则与未转染细胞无显著差异(P>0.05),见图3。
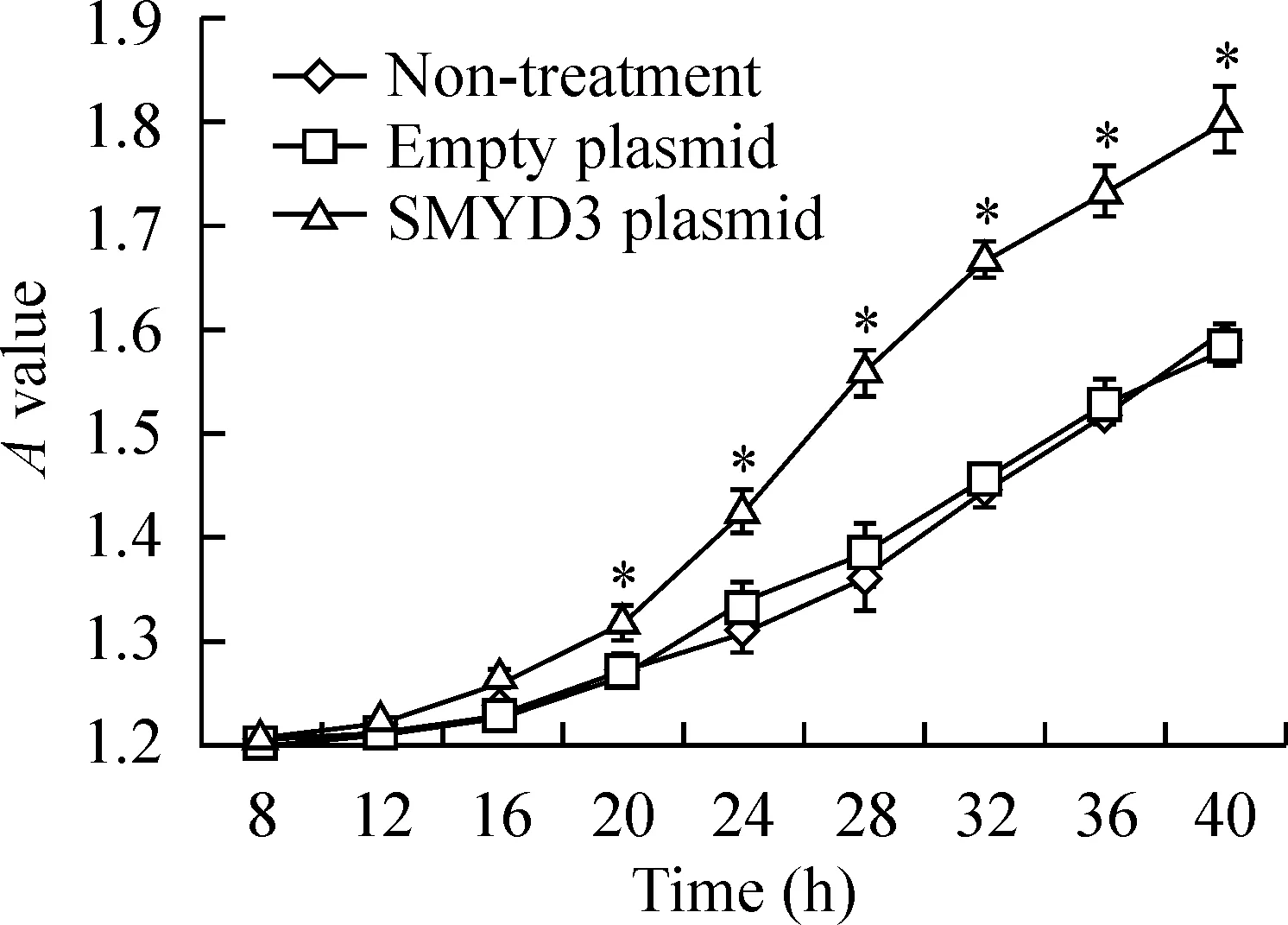
Figure 3. Effect of SMYD3 over-expression on proliferation of FRH0201 cells.*P<0.05vsnon-treatment.
图3SMYD3对细胞增殖能力的影响
4SMYD3对细胞周期的影响
流式细胞仪分析显示:以未处理组细胞G2/M期[(8.40±1.78)%]为对照,转染pEGFP-C3-SMYD3质粒的细胞有(36.84±2.72)%进入了G2/M期,差异有统计学意义(P<0.05);而转染pEGFP-C3空白载体的细胞进入G2/M期仅有(9.18±1.58)%,差异无统计学意义(P>0.05),见图4。这表明SMYD3对细胞增殖及细胞周期的影响主要是通过缩短S 期并促进细胞从S期向G2期过渡实现的。
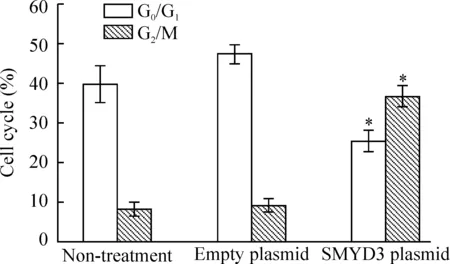
Figure 4. Effect of SMYD3 over-expression on cell cycle of FRH0201 cells.*P<0.05vsnon-treatment.
图4SMYD3对细胞周期的影响
讨 论
肿瘤抑制基因的异常甲基化是肿瘤发生过程中的显著特征,DNMT3B在肿瘤组织中表达丰度异常升高,过表达的DNMT3B可引起肿瘤抑制基因启动子区域CpG岛异常甲基化,导致肿瘤抑制基因转录失活[4, 6];而下调DNMT3B在肿瘤细胞中的表达,可促进肿瘤的凋亡[7]。这说明DNA甲基化转移酶的过度表达可促进细胞生物学行为恶性化、维持癌细胞永生化。基因甲基化修饰的另一个重要因素——组蛋白甲基化是染色质结构改变和基因转录的重要调控机制[8-9]。SMYD3可特异性结合下游靶基因启动子区域5′-CCCTCC-3′序列,发挥转录调节活性,上调靶基因的表达[1]。通过软件分析发现,DNMT3B基因启动子区域存在4个以上5′-CCCTCC-3′重复序列,这为SMYD3直接调节DNMT3B基因的转录、表达提供可能性。本研究结果显示:以未处理组为对照,胆管癌细胞FRH0201在转染pEGFP-C3-SMYD3质粒后,DNMT3B蛋白及mRNA表达均显著上升;而转染pEGFP-C3空白载体的细胞与未处理组之间没有明显差异。这一结果说明,上调SMYD3表达可以提高细胞中DNMT3B蛋白的表达丰度。SMYD3可能通过特异性结合DNMT3B基因启动子区域5′-CCCTCC-3′序列,发挥转录调节活性。
SMYD3通过其转录调节活性,直接或间接改变原癌基因(c-met、c-jun、Wnt10B等)、细胞周期调节基因(CDK2、DNA拓扑异构酶Ⅱβ等)、信号转导相关基因(RAB40C、GnRF2等)在细胞中的表达量[1,10-11]。过度表达的SMYD3通过对上述一系列基因的异常调节,促进细胞增殖及细胞永生化[12-13]。本研究中,CCK-8检测细胞生长曲线显示:以未处理组为对照,胆管癌细胞FRH0201在转染pEGFP-C3-SMYD3质粒后,细胞的增殖能力显著提高,增殖速度加快。而转染pEGFP-C3空白载体的细胞与未处理组之间没有明显差异。细胞周期是细胞生命活动的基本过程,主要分为4个时期:G1期、S期、G2期和M期。在细胞周期中,细胞周期蛋白依赖性蛋白激酶(cyclin-dependent kinase, CDK)2对细胞周期G1/S期的转换及S期的进程具有十分重要的作用;DNA拓扑异构酶Ⅱβ通过调节DNA空间拓扑结构,在DNA复制和转录过程中发挥着重要的作用。研究发现,SMYD3的高度表达将导致CDK2和DNA拓扑异构酶Ⅱβ表达上调[1]。这与本研究中的细胞周期结果一致:转染pEGFP-C3-SMYD3质粒后,进入G2/M期的细胞较未处理组明显增多;而转染pEGFP-C3空白载体的细胞与未处理组之间没有明显差异。这说明SMYD3 对细胞增殖及细胞周期的影响主要是通过缩短S 期并促进细胞从S期向G2期的过渡实现的。
综上所述,SMYD3过度表达可引起DNMT3B的表达升高、细胞增殖能力增强及细胞周期的改变。SMYD3对DNMT3B的表达调节机制可能为:过度表达的SMYD3通过结合DNMT3B基因启动子区域5′-CCCTCC-3′序列,上调DNMT3B的转录活性,使DNMT3B的表达水平上升。DNMT3B也可能参与了SMYD3对细胞增殖及细胞周期的调节。
[1] Hamamoto R, Furukawa Y, Morita M, et al.SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells[J]. Nat Cell Biol, 2004, 6(8):731-740.
[2] Hamamoto R, Silva FP, Tsuge M, et al. Enhanced SMYD3 expression is essential for the growth of breast cancer cells[J]. Cancer Sci, 2006, 97(2):113-118.
[3] Guo N, Chen R, Li Z, et al. Hepatitis C virus core upregulates the methylation status of the RASSF1A promoter through regulation of SMYD3 in hilar cholangiocarcinoma cells[J]. Acta Biochim Biophys Sin (Shanghai), 2011, 43(5):354-361.
[4] Xie S, Wang Z, Okano M, et al. Cloning, expression and chromosome locations of the humanDNMT3 gene family[J]. Gene, 1999, 236(1):87-95.
[5] Okano M, Bell DW, Haber DA, et al. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development[J]. Cell, 1999, 99(3):247-257.
[6] Robertson KD, Uzvolgyi E, Liang G, et al. The human DNA methyltransferases (DNMTs) 1, 3a and 3b: coordinate mRNA expression in normal tissues and overexpression in tumors[J]. Nucleic Acids Res, 1999, 27(11):2291-2298.
[7] Beaulieu N, Morin S, Chute IC, et al. An essential role for DNA methyltransferase DNMT3B in cancer cell survival[J]. J Biol Chem, 2002, 277(31):28176-28181.
[8] Nielsen SJ, Schneider R, Bauer UM, et al. Rb targets histone H3 methylation and HP1 to promoters[J]. Nature, 2001, 412(6846):561-565.
[9] Jenuwein T, Allis CD. Translating the histone code[J]. Science, 2001, 293(5532):1074-1080.
[10]Sims RR, Reinberg D. From chromatin to cancer: a new histone lysine methyltransferase enters the mix[J]. Nat Cell Biol, 2004, 6(8):685-687.
[11]Zou JN, Wang SZ, Yang JS, et al. Knockdown of SMYD3 by RNA interference down-regulates c-Met expression and inhibits cells migration and invasion induced by HGF[J]. Cancer Lett, 2009, 280(1):78-85.
[12]Ren TN, Wang JS, He YM, et al. Effects of SMYD3 over-expression on cell cycle acceleration and cell proliferation in MDA-MB-231 human breast cancer cells[J]. Med Oncol, 2011, 28 (Suppl 1):S91-S98.
[13]Luo XG, Xi T, Guo S, et al. Effects of SMYD3 overexpression on transformation, serum dependence, and apoptosis sensitivity in NIH3T3 cells[J]. IUBMB Life, 2009, 61(6):679-684.
EffectofSMYD3over-expressiononDNMT3BlevelsandproliferationabilityinhumancholangiocarcinomacelllineFRH0201
CHENG Di1, LI Zhi-hua1, CHEN Ru-fu2, GUO Ning2, LIAO Qiao-fang1, ZHENG Li-ping1, ZHOU Quan-bo2, ZHOU Jia-jia2
(1DepartmentofOncology,2DepartmentofHepatobiliarySurgery,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:chenrf63@163.com)
AIM: To explore the effect of SET and MYND domain-containing protein 3 (SMYD3) over-expression on the expression of DNA methyltransferase 3B (DNMT3B) and the proliferation ability in human cholangiocarcinoma cell line FRH0201.METHODSTransient transfection of SMYD3 eukaryotic expression plasmid pEGFP-C3-SMYD3 into human cholangiocarcinoma cell line FRH0201 was performed. The expression of DNMT3B at mRNA and protein levels was detected by RT-PCR and Western blotting,respectively. Cell proliferation was examined by CCK-8 method and cell cycle situation was checked by flow cytometry.RESULTSAfter transfected with SMYD3 eukaryotic expression plasmid pEGFP-C3-SMYD3, the over-expression of SMYD3 in FRH0201 cells was observed. Compared with the untransfected cells, the expression of DNMT3B was significantly increased (P<0.01), the proliferation rate was obviously accelerated (P<0.05) and the number of the cells in G2/M phase was significantly increased (P<0.05) in FRH0201 cells transiently transfected with pEGFP-C3-SMYD3 plasmid.CONCLUSIONThe transient transfection of pEGFP-C3-SMYD3 plasmid induces over-expression of DNMT3B and promotes the proliferation of human cholangiocarcinoma cell line FRH0201.
FRH0201 cells; Methylation; Histone methyltransferase; DNA methyltransferase
R735.8
A
10.3969/j.issn.1000-4718.2012.03.006

