近足月胎兔持续宫内缺氧缺血性脑损伤模型的建立*
王能里, 南 燕, 柳艳丽, 林 素, 叶 伟, 唐震海, 林 锦, 林振浪
(温州医学院附属育英儿童医院新生儿科,浙江 温州 325027)
1000-4718(2012)04-0760-06
2011-10-05
2011-12-27
浙江省自然科学基金资助项目(No.Y2101067);浙江省科技厅钱江人才计划项目(No.2009R10054);温州市科技局对外科技合作交流项目(No.H2008055)
△通讯作者 Tel: 0577-88816211; E-mail: linzhenlang@hotmail.com
·实验技术·
近足月胎兔持续宫内缺氧缺血性脑损伤模型的建立*
王能里, 南 燕, 柳艳丽, 林 素, 叶 伟, 唐震海, 林 锦, 林振浪△
(温州医学院附属育英儿童医院新生儿科,浙江 温州 325027)
目的建立近足月(29 d胎龄)胎兔持续宫内缺氧缺血性脑损伤模型,为深入研究新生儿缺氧缺血性脑损伤发病机制和治疗提供合适模型。方法选择孕29 d健康新西兰白兔24只,联合全身麻醉和腰麻对孕兔进行麻醉,从左侧股动脉插入4F Fogarty动脉取栓导管,实验组向导管球囊内注入生理盐水0.3 mL阻断孕兔子宫血供,阻断时间分别为20 min、25 min、28 min、30 min和40 min,每组4只;对照组插管后不注入生理盐水,共4只。24 h后行剖宫产,记录新生兔一般情况,评估新生兔神经行为学和脑组织病理学改变。结果麻醉过程中孕兔生命体征稳定,未发生低氧血症,对麻醉耐受性良好。实验组向导管球囊内注入生理盐水0.3 mL后孕兔右侧股动脉搏动消失,血压测不出;而对照组血压无明显波动(P>0.05)。持续阻断子宫血供导致胎兔和新生兔死亡,存活新生兔神经行为学异常,脑细胞发生凋亡。阻断子宫血供20 min时,未发现死胎,新生兔行为学和脑组织病理学改变不明显;阻断子宫血供25 min和28 min时,死胎率分别为12.9%和40.6%,存活新生兔出现不同程度的神经行为异常,脑组织切片发现神经元细胞肿胀,小胶质细胞活化,脑细胞凋亡;而阻断子宫血供超过30 min时,死胎率高达80.0%。结论持续阻断孕兔子宫血供导致胎兔死亡、新生兔神经行为学异常及脑组织病理学改变,且不同阻断时间引起不同程度的脑损伤;持续阻断子宫血供25~28 min,可为缺氧缺血性脑损伤的相关研究提供合适的胎儿期全身性缺氧缺血性脑损伤胎兔模型。
缺氧缺血,脑; 模型,动物; 兔
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)是围生期窒息引起脑组织缺氧缺血性损害,是导致新生儿伤残的重要原因之一[1-2],严重威胁新生儿的生命健康[3]。深入研究HIBD的发病机制和寻找有效的防治策略是国内外围生医学领域的重要课题[4],因此模拟新生儿HIBD的临床过程,建立胎儿期全身性HIBD动物模型具有十分重要的意义,胎兔宫内HIBD模型正是这样一种模型。本研究模拟急性胎盘功能不全的临床过程,建立近足月(29 d胎龄)胎兔持续宫内缺氧缺血性脑损伤模型,为深入研究新生儿缺氧缺血性脑损伤发病机制和防治措施提供合适动物模型。
材 料 和 方 法
1材料
1.1动物及分组 孕29 d健康新西兰白兔24只,体重为3.3~3.8 kg,由上海实验动物中心提供。24只孕兔随机分为实验组20只和对照组4只。实验组按阻断子宫血供时间随机分为20 min组、25 min组、28 min组、30 min组和40 min组(各4只),分别记为E20、E25、E28、E30和E40组。
1.2主要仪器设备和试剂 血气/电解质分析仪(Instrumentation Laboratory);BeneView T5生命体征监测仪(深圳迈瑞生物医疗电子股份有限公司);WZS-50F微量输液泵(浙江大学医学器械厂);YP-90新生儿培养箱(宁波戴维器械有限公司);Fogarty动脉取栓导管(4F, Edwards Lifesciences);Griffoniasimplicifoliaisolectin B4(IB4)(Vector Labs);TUNEL试剂盒(InSituCell Death Detection Kit, POD; Roche)。
2方法
2.1HIBD模型的建立
2.1.1麻醉及补液 联合全身麻醉和腰麻对孕兔进行麻醉。全身麻醉分为诱导麻醉和维持麻醉2个阶段,左侧耳缘静脉内持续泵入给药。诱导麻醉给予芬太尼(0.075 mg·kg-1·h-1)和氟哌利多(3.75 mg·kg-1·h-1),泵入5~10 min;维持麻醉给予芬太尼(0.025~0.05 mg·kg-1·h-1)和氟哌利多(1.25~2.5 mg·kg-1·h-1),泵入至实验结束。腰麻以L4~L5椎间隙为进针点,向蛛网膜下腔内注入0.75%布比卡因0.3~0.5 mL。葡萄糖生理盐水溶液按10~15 mL·kg-1·h-1耳缘静脉内持续泵入。
2.1.2阻断孕兔子宫血供 沿左侧腹股沟中点切开皮肤,游离左侧股动脉并做一纵向切口,插入4F Fogarty动脉取栓导管,约10 cm,此时球囊位于肾动脉开口下端,子宫动脉开口上端[5]。实验组向球囊内注入生理盐水0.3 mL扩张球囊,对照组不注入生理盐水,分别保留20、25、28、30、40 min后拔出导管,缝合血管、皮肤。
2.1.3术中监测 孕兔左侧耳中动脉置入静脉留置针(20G),连接有创血压监测仪,监测外周动脉血压;右侧耳缘连接经皮氧饱和度监测仪;人工计数呼吸频率,根据监测结果及时调整麻醉药物给药剂量。在全身麻醉前、诱导麻醉完成后10 min、股动脉插管前10 min、拔管后10 min、拔管后4~5 h从孕兔左侧耳中动脉采血,30 min内送检血气分析,记录呼吸频率、心率、血氧饱和度(SpO2)和血气分析结果。同时监测孕兔右侧股动脉搏动及血压。
2.2新生兔的评估
2.2.1阻断孕兔子宫血供24 h后行剖宫产,新生兔置入预热的新生儿培养箱中保暖(箱温为35 ℃),记录单窝产崽数、死胎率、出生体重等。
2.2.2活产新生兔立即进行神经行为学评分:主要评估项目包括姿势、翻正反射、肌张力、运动能力、吮吸和吞咽协调能力、对刺激的反应[6-7]。但如果活产新生兔在神经行为学评估前或评估过程中发生死亡,其评分结果视为无效评分,不被纳入统计范畴。
2.3病理学观察
2.3.1HE染色 待行为学评估完成后,立即腹腔内注射5%水合氯醛(250 mg/kg),4%多聚甲醛心脏灌注,断头取脑组织,制作石蜡标本,切片,行HE染色。
2.3.2标记小胶质细胞 石蜡切片常规脱蜡、逐级水化,用3%H2O250 μL孵育20 min,加入50 μL生物素标记的IB4(2.5 mg/L)孵育30 min,滴加HRP标记的链霉卵蛋白50 μL孵育30 min。
2.3.3标记凋亡的脑细胞 按TUNEL试剂盒设计的程序进行:加蛋白酶K(20 mg/L)50 μL孵育5 min,滴加TUNEL反应液(Enzyme solution 5 μL,Label solution 45 μL)50 μL孵育1 h;加POD转化液50 μL孵育30 min。
2.3.4以上各步均用0.01 mol/LPBS 充分冲洗。DAB显色;苏木素复染,常规脱水、透明、封固,显微镜下观察,对存活新生兔脑组织海马CA1区、纹状体、大脑矢状旁区皮质每高倍视野内阳性细胞进行计数。
3统计学处理
结 果
1孕兔一般情况
对照组和各实验组孕兔体重、单窝产崽数比较差异无统计学意义(P>0.05)。任意监测时点,各组孕兔呼吸频率、心率、PaO2、PaCO2、SpO2和外周动脉血压比较差异无统计学意义(P>0.05)。心率、SpO2和外周动脉血压在整个实验过程中无明显波动,但诱导麻醉导致孕兔呼吸频率和PaO2明显降低,PaCO2增高(P<0.05),进入维持麻醉阶段后孕兔呼吸频率、血PO2和PCO2逐渐趋向稳定。实验组向导管球囊注入生理盐水0.3 mL,孕兔右侧股动脉搏动消失,血压测不出,但置管前和拔管后血压比较差异无统计学意义(P>0.05);拔管后实验组孕兔动脉血乳酸水平高于对照组,分别为(2.13±0.82)mmol/L和(1.34±0.39) mmol/L(P<0.05)。在整个实验过程中,对照组右侧股动脉均可触及明显波动,血压波动不明显。孕兔一般情况见表1,这些数据对在国内建立胎兔宫内HIBD模型有重要意义。
2胎兔及新生兔存活情况
对照组产崽共31只;实验组E20、E25、E28、E30和E40分别产崽32只、31只、32只、25只和31只。对照组所有胎兔存活,实验组阻断子宫血供造成部分胎兔死亡,且阻断时间越长,活产新生兔的数量越少,死胎率越高(P<0.05),见表2。E20组和对照组活产新生兔活力较好,无新生兔死亡;而E25组、E28组和E30组部分活产新生兔活力较差,生后不久即发生死亡,其中E30组所有活产新生兔生后不久均死亡,其原因可能是发生严重缺氧缺血性脑损伤的新生兔没有ICU监护较难存活[6]。

表1 孕兔一般情况
PaO2:arterial oxygen partial pressure;SpO2:pulse oxygen saturation;PaCO2:arterial carbon dioxide partial pressure.*P<0.05vsbefore anesthesia.

表2 胎兔及新生兔存活情况
3新生兔行为学评估
本研究各组有效的神经行为学评分例数分别为:对照组31例、E20组32例、E25组25例、E28组14例,而E30组活产新生兔生后不久均发生死亡,没有有效的神经行为学评分结果。比较神经行为学评分结果发现,实验组新生兔的姿势、翻正次数、翻正得分、运动能力、吮吸和吞咽协调能力及嗅觉刺激等项目评分均低于对照组,且宫内缺氧缺血时间越长,神经行为学评分越低(P<0.05),见表3;E20组新生兔神经行为学评分较对照组有降低趋势,但差异无统计学意义(P>0.05)。另外,所有存活新生兔均未出现肌张力增高,同样证实肌张力增高仅见于早产胎兔缺氧缺血性脑损伤模型[6],这可能与不成熟脑白质对缺氧缺血敏感有关[8-9],原因可能是不成熟脑白质中的前体少突胶质细胞对缺氧缺血产生的氧自由基极度敏感[10-11]。
4大体标本及免疫组织化学
实验组新生兔颅缝较对照组增宽,E30组增宽最为明显,顺产极可能增加死胎率[6]。存活新生兔脑组织标本经HE染色,见图1,对照组大脑矢状旁区脑细胞排列整齐,细胞形态规整,细胞间隙清晰;实验组脑细胞肿胀,排列紊乱,胞质、胞核染色不均,细胞间隙不清。脑组织切片经IB4染色后,对照组和实验组均可见呈棕色的阳性细胞,但对照组阳性细胞形态学上呈树枝状,为静息态小胶质细胞;实验组阳性细胞呈椭圆形或阿米巴样,为活化的小胶质细胞[7],见图2。

表3 存活新生兔神经行为学评分
★P<0.05vscontrol;◆P<0.05vsE20;●P<0.05vsE25.
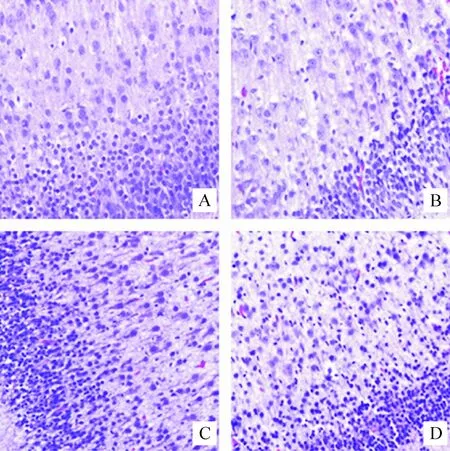
Figure 1. The morphological changes of brain cells in sagittal brain areas of newborn rabbits (HE staining,×200). A: control group, most brain cells with regular shape and uniform staining; B, C, D: E20, E25 and E28 groups, respectively, with swelling brain cells and unclear cell gaps.
图1HE染色显示大脑矢状旁区脑细胞形态学改变

Figure 2. The morphological changes of microglia in hippocampus CA1 of newborn rabbits(IB4 staining,×400). A: control group, the microglial cells were highly ramified (arrows). B, C, D: E20, E25 and E28 groups, respectively, the microglial cells showed amoeboid morphology (arrows).
图2IB4染色后海马CA1区小胶质细胞的形态学变化
实验组存活新生兔脑组织切片中可见较多TUNEL阳性细胞(呈棕色),对照组未发现或仅有极少量TUNEL阳性细胞,见图3;其中海马、纹状体、大脑矢状旁区皮质等部位凋亡现象较为突出,每高倍视野内阳性细胞数较对照组明显增多(数据未给出),且随阻断子宫血供时间的延长逐渐增加(P<0.05)。
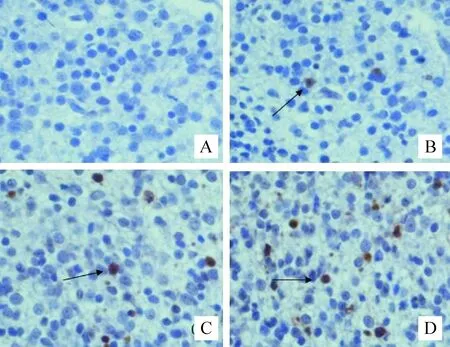
Figure 3. The apoptosis of brain cells in striaturn in newborn rabbits (TUNEL,×400). A: control group, no apoptotic brain cells; B, C, D: E20, E25 and E28 groups, respectively,the positive cells were apoptotic brain cells (arrows).
图3TUNEL染色后纹状体内脑细胞凋亡情况
讨 论
建立缺氧缺血性脑损伤(HIBD)动物模型的方法较多,最为经典的是Rice法[12],但由于是通过结扎新生鼠一侧颈动脉建立的局部单侧缺氧缺血性脑损伤模型,不能模拟宫内窒息所致的胎儿全身性缺氧缺血的临床过程。Matthew等[7]利用孕兔,模拟胎盘功能不全的临床过程,通过暂时性阻断孕兔子宫血供造成胎兔宫内缺氧缺血,建立起胎儿期全身性胎兔HIBD模型。而兔脑发育与人类极为相似,被认为是人脑发育的缩略图[6],且胎兔模型具有较典型的神经行为学损害[6-7],胎兔宫内HIBD模型被认为是深入研究新生儿HIBD发病机制和防治措施的合适的模型[13]。Sidhartha等[6]已成功建立了早产胎兔持续宫内缺氧缺血性脑损伤模型和近足月胎兔间歇宫内缺氧缺血性脑损伤模型,而对近足月胎兔持续宫内缺氧缺血性脑损伤模型阻断孕兔子宫血供的时间没有明确定义;持续阻断孕29 d孕兔子宫血供50 min,可造成胎兔脑细胞损伤和坏死[14],但由于可造成100%的死胎率,无法进行缺氧缺血后神经行为学及干预疗效相关研究,故持续阻断孕29 d孕兔子宫血供50 min,不能建立理想的近足月胎兔持续宫内缺氧缺血性脑损伤模型。本研究拟建立近足月(29 d胎龄,约92.1%孕龄)胎兔持续宫内缺氧缺血性脑损伤模型。
建立胎兔宫内缺氧缺血性脑损伤模型的技术关键主要有两个,其一是避免孕兔发生低氧血症和死亡。文献报道对孕兔进行麻醉时,需要使用呼吸机或者复苏囊-面罩加压通气维持通气[6-7,14],这不利于胎兔宫内缺氧缺血性脑损伤模型的推广。本研究诱导麻醉采用耳缘静脉泵入,诱导剂量完成后加用大剂量维持,5 min后改用小剂量维持到实验结束。我们实时监测孕兔的呼吸、心率、经皮SPO2、外周动脉血压、动脉血气分析等,及时评估孕兔的麻醉深度,并根据监测结果及时调整麻醉给药剂量。在无任何辅助通气的情况下,本研究所有孕兔均未出现严重呼吸抑制,无低氧血症、高碳酸血症发生,有效避免因麻醉过度发生死亡。
实现子宫血供中断造成适度的宫内缺氧缺血,是建立胎兔HIBD模型的另一个技术关键。文献报道向球囊内注入0.4 mL或0.3 mL生理盐水[13,15],均可实现子宫血供的中断。我们的前期研究表明,向球囊内注入0.4 mL生理盐水,部分孕兔出现腹主动脉破裂,迅速死亡;而注入0.3 mL生理盐水未出现此现象。本研究向球囊内注入0.3 mL生理盐水,导管充盈后,孕兔右侧股动脉脉搏消失、血压测不出,与Sidhartha等[6]报道一致;拔除导管后,孕兔循环中的乳酸水平明显增高,这与球囊以下血供(包括子宫)被阻断发生无氧代谢有关,提示实现孕兔子宫血供中断。但由于乳酸等酸性物质有可能加重胎兔脑损伤[16-17],本研究给予适当补液,维持稳定的外周动脉灌注压,增加孕兔肾血流量,促进酸性物质排出[18],减少非实验因素对实验结果的影响。拔除导管4~5 h后,孕兔动脉血乳酸水平恢复至术前水平。
由于阴道产可增加死胎率,且存在食崽现象[6],本研究采用剖宫产希望得出更为准确的死胎率。与文献报道[9]不同,本研究发现持续阻断子宫血供40 min,死胎率为100%;降低阻断时间至30 min时,死胎率仍高达80.0%;当降至28 min时,死胎率为40.6%,过高的死胎率不利于科学研究,故本研究认为阻断子宫血供的时间不宜超过28 min。当阻断子宫血供时间为25~28 min时,死胎率分别为12.9%和40.6%,存活新生兔出现不同程度的神经行为学异常,病理切片可见明显肿胀的脑细胞、活化的小胶质细胞及发生凋亡的脑细胞,脑损伤较为典型[7],提示阻断子宫血供25~28 min是建立29d胎龄胎兔持续宫内缺氧缺血性脑损伤模型的合理时间。继续降低阻断时间至20 min,存活新生兔的神经行为学评估结果与对照组比较差异无统计学意义,脑组织病理切片仅可见活化的小胶质细胞,凋亡现象不明显,提示阻断子宫血供20 min可引起小胶质细胞大量活化[19],未造成或仅造成轻微的神经系统损伤,因此持续阻断子宫血供20 min或小于20 min不是建模的合理时间。
综上所述,本研究有效避免呼吸机的应用及孕兔死亡,进一步减少非实验因素对研究结果的影响。持续阻断孕兔子宫血供导致胎兔死亡、新生兔神经行为学异常及脑组织病理学改变,且不同阻断时间引起不同程度的脑损伤;持续阻断子宫血供25~28 min,可为缺氧缺血性脑损伤的相关研究提供合适的胎儿期全身性缺氧缺血性脑损伤胎兔模型。
[1] Deorari AK, Paul VK, Singh M, et al. The national movement of neonatal resuscitation in India [J]. J Trop Pediatr, 2000,46(5):315-317.
[2] 许晓霞, 栾 佐, 古桂雄, 等. 新生大鼠重度缺氧缺血性脑损伤模型的建立[J]. 中国新生儿科杂志, 2009,24(3):165-167.
[3] 段 涛, 陈 超. 新生儿缺氧缺血性脑病(I)[J]. 中华医学杂志, 2005, 85(17):1218.
[4] Glass HC, Ferriero DM. Treatment of hypoxic- ischemic encephalopathy in newborns[J]. Curr Treat Options Neurol, 2007,9(6):414-423.
[5] Derrick M, He J, Brady E, et al. Theinvitrofate of rabbit fetal brain cells after acuteinvivohypoxia [J]. J Neurosci, 2001,21(7):RC138.
[6] Sidhartha T, Alexander D, Tamas J, et al. Model of cerebral palsy in the perinatal rabbit [J]. J Child Neurol, 2005,20(12):972-979.
[7] Matthew D, Ning LL, Joanne CB, et al. Preterm fetal hypoxia-ischemia causes hypertonia and motor deficits in the neonatal rabbit: model for human cerebral palsy?[J]. J Neurosci, 2004,24(1):24-34.
[8] Drobyshevsky A, Song SK, Gamkrelidze G, et al. Developmental changes in diffusion anisotropy coincide with immature oligodendrocyte progression and maturation of compound action potential[J]. J Neurosci, 2005, 25(25):5988-5997.
[9] Back SA, Luo NL, Mallinson RA, et al. Selective vulnerability of preterm white matter to oxidative damage defined by F2-isoprostanes[J]. Ann Neurol,2005, 58(1):108-120.
[10]Drobyshevsky A, Derrick M, Wyrwicz A, et al. White matter injury correlates with hypertonia in an animal model of cerebral palsy[J]. J Cereb Blood Flow Metab, 2007, 27(2):270-281.
[11]Baud O, Greene A, Li J, et al. Glutathione peroxidase-catalase cooperativity is required for resistance to hydrogen peroxide by mature rat oligodendrocytes[J]. J Neurosci, 2004, 24(7):1531-1540.
[12]Rice JE, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol,1981,9(2):131-141.
[13]Matthew D, Alexander D, Ji XH, et al. A model of cerebral palsy from fetal hypoxia-ischemia [J]. Stroke, 2007,38(2):731-735.
[14]Buser JR, Segovial KN, Dean JM, et al. Timing of appearance of late oligodendrocyte progenitors coincides with enhanced susceptibility of preterm rabbit cerebral white matter to hypoxia-ischemia[J]. J Cereb Blood Flow Metab, 2010, 30(5):1053-1065.
[15]Tan S, Zhou F, Nielsen VG, et al. Increased injury following intermittent fetal hypoxia-reoxygenation is associated with increased free radical production in fetal rabbit brain[J]. J Neuropathol Exp Neurol, 1999,58(9):972-981.
[16]Lee CC, Chang IJ, Yen ZS, et al. Effect of different resuscitation fluids on cytokine response in rat model of hemorrhagic shock[J]. Shock, 2005,24(2):177-181.
[17]宋 娟, 邵 芹, 葛亚丽,等. 不同渗透浓度晶体液对失血性休克大鼠血脑屏障和脑水肿的影响[J]. 医学研究生学报,2008, 21(3):255-259.
[18]赵红立, 陈英才. 新生儿缺氧缺血性脑病阴离子间隙测定及其意义[J]. 现代中西医结合杂志,2004,13(16):2107-2108.
[19]Sujatha K, Fadoua SM, Otto MM, et al. Microglial activation in perinatal rabbit brain induced by intrauterine inflammation: detection with11C-(R)-PK11195 and small-animal PET[J]. J Nucl Med, 2007,48(6):946-954.
Establishmentofintrauterinehypoxic-ischemicbraindamagemodelinneartermfetalrabbits
WANG Neng-li, NAN Yan, LIU Yan-li, LIN Su, YE Wei, TANG Zhen-hai, LIN Jin, LIN Zhen-lang
(DepartmentofNeonatology,TheYuyingChildren’sHospitalofWenzhouMedicalCollege,Wenzhou325027,China.E-mail:linzhenlang@hotmail.com)
AIM: To establish intrauterine hypoxic-ischemic brain damage (HIBD) model in near term fetal rabbits at 29 d gestation age for the investigation of the pathogenesis and treatment of newborn HIBD.METHODSTwenty-four pregnant New Zealand white rabbits at 29th gestational day were chosen for this project. Under combined general anesthesia and spinal anesthesia, a 4F Fogarty arterial embolectomy catheter was introduced into the left femoral artery. The blood supply of uterus in experiment group was blocked by inflating the catheter balloon with 0.3 mL saline for 20 min, 25 min, 28 min, 30 min and 40 min (n=4 for each experimental time group). The catheter balloon was not inflated in control group (n=4). All pregnant rabbits were subject to cesarean section 24 h after the experimental procedure to induce hypoxia-ischemia to the fetus. The general conditions of the newborn rabbits were recorded, and the neurobehavioral damage and histology of the brain tissue were assessed.RESULTSDuring the entire procedure, the pregnant rabbits had stable vital signs, no hypoxia happened,and had a good tolerance to the anesthesia program. When the balloon was inflated, the pulses of right femoral artery disappeared and the right leg blood pressure became non-detectable in experimental groups. In contrast, no fluctuation of the right leg blood pressure in control group (P>0.05) was observed. Intrauterine hypoxia-ischemia caused neonatal and fetal rabbit death, neurobehavioral damage and brain cell death. When the balloon was inflated for 20 min, all fetal rabbits were alive and had no obvious neurologic damage. For 25~28 min, the stillbirth rates were 12.9% and 40.6%, respectively, while the live neonatal rabbits manifested neurobehavioral damage, edema neural cells, activated microglia cells and apoptotic brain cells. When blocking time beyond 30 min, above 80% fetal rabbits died.CONCLUSIONContinuous blockage of uterine blood supply in pregnant rabbits causes neonatal rabbit death, neurobehavioral damage and brain cell death. Different blocking time arouses different levels of brain damage. Continuous blockage of uterine blood supply for 25-28 min can establish fetal generalize hypoxic-ischemic brain damage rabbit model, which is a good animal model for the investigation of newborn HIBD.
Hypoxia-ischemia, brain; Models,animal; Rabbits
R363
A
10.3969/j.issn.1000-4718.2012.04.034

