miR-125b在儿童AML中的表达及其反义寡核苷酸对白血病细胞的作用*
刘晓丹, 徐 令, 檀卫平, 颜慕霞
(中山大学孙逸仙纪念医院1医学研究中心,3儿科, 广东 广州 510120;2广州市妇女儿童医疗中心血液科,广东 广州 510623)
1000-4718(2012)04-0738-04
2011-11-01
2011-12-27
广东省自然科学基金资助项目(No.S2011010004731)
△通讯作者 Tel:020-38076603; E-mail: luoxul64@yahoo.com
miR-125b在儿童AML中的表达及其反义寡核苷酸对白血病细胞的作用*
刘晓丹1, 徐 令2△, 檀卫平3, 颜慕霞2
(中山大学孙逸仙纪念医院1医学研究中心,3儿科, 广东 广州 510120;2广州市妇女儿童医疗中心血液科,广东 广州 510623)
目的研究儿童急性髓细胞白血病(AML)患者骨髓细胞中miR-125b的表达及miR-125b为靶标的反义寡核苷酸对人白血病细胞的作用。方法采用基因芯片和实时荧光定量PCR技术(qRT-PCR)检测儿童AML治疗前后骨髓细胞中miR-125b的表达。采用电转法将与miR-125b序列互补的反义寡核苷酸转染HL-60细胞,细胞计数试剂盒(CCK-8)检测转染后24 h、48 h、72 h、96 h细胞增殖情况。结果芯片结果显示miR-125b在儿童AML中表达明显增高,约为正常的12倍,qRT-PCR结果进一步证实了miR-125b在儿童AML中异常高表达,同时还发现miR-125b在儿童AML部分缓解的患者骨髓细胞中表达下降,在完全缓解患者骨髓细胞中降至正常水平。CCK-8结果显示,针对miR-125b的反义寡核苷酸能有效抑制白血病细胞的增殖,与对照组相比有显著差异(P<0.01)。结论miR-125b在儿童AML中可能起“癌基因”作用,以miR-125b为靶标的反义寡核苷酸可能为儿童AML治疗提供新的方法。
miR-125b; 寡核苷酸类,反义; HL-60细胞
白血病是儿童时期最常见的恶性肿瘤,15岁以下儿童白血病的发病率为4/10万左右,约占该时期恶性肿瘤的35%。随着联合化疗和造血干细胞移植技术的应用,儿童白血病的存活率大为改观,但急性髓细胞白血病(acute myeloid leukemia,AML)的预后仍很差,5年存活率仅40%~50%[1]。因此,进一步阐明AML发病的分子机制,寻找新的治疗方法具有重要的意义。
长期以来,对AML分子机制的研究主要着眼于染色体异常以及蛋白编码基因,近年来发现非编码的microRNA(miRNA)与癌症的发生、发展、临床表现和预后都有密切的关系,在其中起着“促癌”或“抑癌”作用[2-6]。miRNA是一类广泛存在于动物和植物等多细胞生物中约22个核苷酸的非编码小分子RNA,它通过与靶基因mRNA的3'-UTR区域部分或完全配对,引起mRNA切断或转录抑制,介导转录后基因沉默,从而在生物许多功能基因调控网络中起着非常重要的作用[7]。如何发现与肿瘤相关的miRNA,阐明其作用及调控机制,将它们整合到基因调控网络中是分子医学研究的热点和前沿。
miRNA与白血病发生发展及预后也密切相关,近年来在各国科学家的努力下,白血病相关miRNA的研究取得了很大的进展,各型白血病miRNA的表达谱被相继报道,部分白血病相关的miRNA功能及其调控机制也被阐明。如Cimmino等[8]证实 miR-15a/16-1可以通过下调靶基因 B 细胞淋巴瘤2(BCL2)的表达来诱发白血病细胞的凋亡,从而发挥其抑癌基因的功能;Venturini等[9]报道慢性髓细胞白血病中很可能存在着BCR-ABL-c-Myc-miR-17-92通路的病理生理学机制。尽管在白血病相关的miRNA功能及其调控机制方面取得了重要进展,但仍有很多功能、机制没有完全阐明,特别是对儿童白血病的研究还少见报道。而儿童白血病的生物特性在临床、病理组织及生物学方面与成人不同[1],因此有必要特别针对儿童白血病,特别是AML相关的 miRNA的作用及其机制进行研究,其作用和机制的阐明可能为儿童白血病治疗提供新的靶点。
本文利用miRNA芯片技术对儿童AML的表达谱进行了研究,结果显示miR-125b在AML中的表达增高,提示它可能与儿童AML相关。在此基础上,本文采用实时荧光定量PCR(qRT-PCR)对患儿治疗前后的miR-125b表达水平进行检测,体内研究miR-125b是否与儿童AML 相关,同时设计针对miR-125b的反义寡核苷酸,作用于白血病细胞,通过检测细胞增殖情况,研究miR-125b反义寡核苷酸对白血病细胞的作用,目的在于研究miR-125b的功能,其功能的阐明有利于揭示白血病中的“RNA调控网络”,并可能为白血病的治疗提供新的靶点。
材 料 和 方 法
1临床资料
93例AML患儿的骨髓标本(包括初治组75例,部分缓解组8例,完全缓解组10例)来源于中山大学附属第一医院和孙逸仙纪念医院2006~2010年的住院病人,其中男54例,女39例,中位年龄8岁。全部病例均经骨髓细胞形态学、免疫分型、染色体、融合基因检查确诊。早幼粒细胞白血病基因与维甲酸受体α重排(promyelocytic leukemia-retinoic acid receptor α,PML-RARα)阳性的急性早幼粒细胞白血病(即M3型)患儿诱导化疗采用全反式维甲酸+米托蒽醌方案,其余的AML患儿诱导化疗采用米托蒽醌+阿糖胞苷+顺铂方案。对照组采用特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)患儿,共12例,包括男7例,女5例,中位年龄6岁,AML患儿的详细临床资料见表1。本研究所有样品的采集得到了中山大学道德伦理委员会的批准。
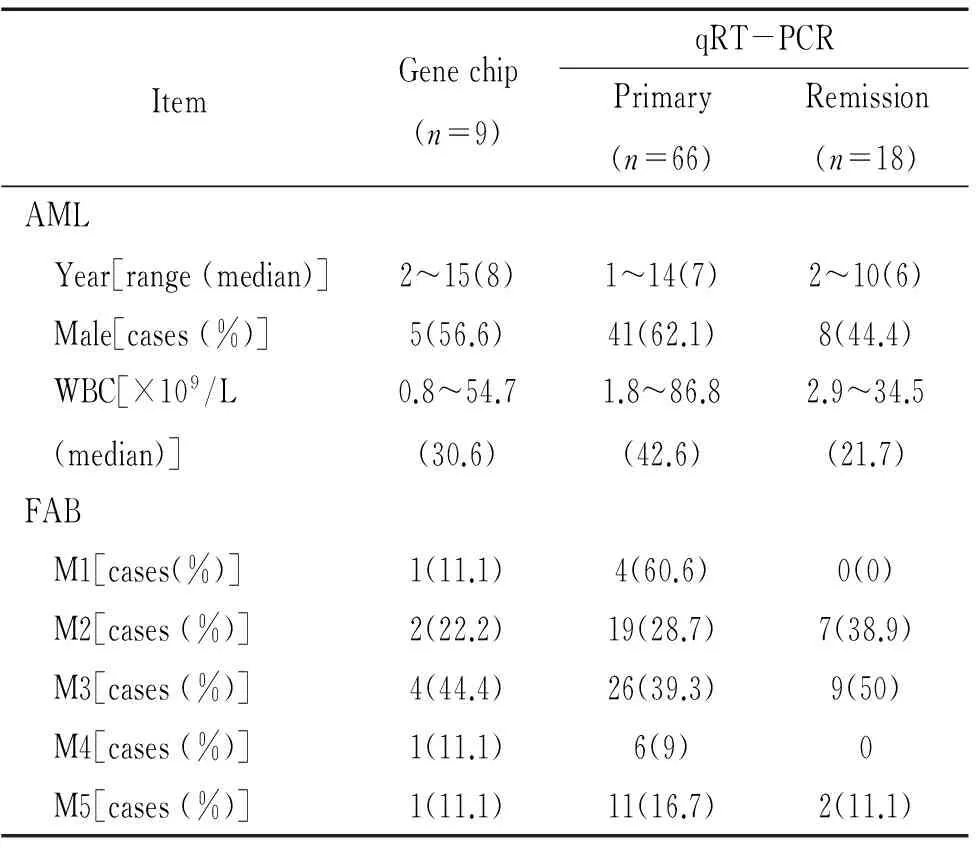
表1 AML患儿临床资料
FAB:French-American-British classfication. M1:acute myelocytic leukemia without differentiation;M2:acute myelocytic leukemia with differentiation;M3:acute promyelocytic leukemia;M4:acute myelomonocytic leukemia; M5:acute monoblastic leukemia.
2miRNA基因芯片表达谱分析
按照说明书方法用RNAiso(TaKaRa)试剂提取儿童AML组及对照组骨髓细胞总RNA,用miRNA基因芯片(博奥,北京)进行miRNA微阵列分析。具体方法参考文献[10]。
3细胞培养及转染
人白血病细胞系HL-60购于中国科学院上海细胞库。将细胞接种于10%胎牛血清(Gibco)、无抗生素的RPMI-1640培养基(Gibco)中, 置于37 ℃、5%CO2培养箱内常规培养。取对数生长期细胞用于实验。细胞转染时按照每孔1×106细胞,1 mL完全培养基,接种于24孔板中。与miR-125b成熟体互补的反义寡核苷酸(anti-miR-125b)及阴性对照(anti-miR-NC)购自广州锐博公司。利用电转系统(Neon® Transfection System,Invitrogen)将100 pmol anti-miR-125b和anti-miR-NC以10 μL体系转染到细胞内。电转染条件如下:1 350 V,30 ms,1 pulse。
4qRT-PCR验证miR-125b的表达
采用RNAiso(TaKaRa)法分离纯化各组临床样品的总RNA,分光光度法测定计算提取的总RNA含量及浓度。采用含有茎环样的反转录引物(GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCACAAG),按照M-MLV reverse transcriptase试剂盒(Promega)进行反转录,体系如下:总RNA 5 μL,miR-125b RT primer 1.8 μL,U6 RT primer 1.8μL,dNTP 5 μL,5×M-MLV reverse transcriptase buffer 6 μL,逆转录酶0.25 μL,RNA酶抑制剂 0.6 μL,补充DEPC水至30 μL。16 ℃孵育30 mim,42 ℃孵育45 min, 85 ℃加热 5 min 失活逆转录酶,-4 ℃贮存。实时定量PCR按照SYBR® Premix Ex TaqTMII试剂盒(TaKaRa)说明书操作。用Bio-Rad荧光PCR仪及其分析软件iQ5进行PCR 扩增及定量分析。20 μL反应体系含cDNA 2 μL,上、下游引物各0.4 μL,2×SYBR Mix 10 μL,ROX Reference Dye 0.4 μL,加水至20 μL。PCR循环:95 ℃预变性5 min,95 ℃ 15 s,58 ℃ 30 s, 72 ℃ 30 s,共40个循环。每次扩增均设内参基因组和目的基因组以及2管空白对照组(由DEPC水代cDNA)。每一样本均设3个重复。最后用2-ΔΔCt方法将与对照组对应的每一个miRNA表达进行分析,U6为内参照。实验重复3次,包括无模板的空白对照。所用引物见表2。
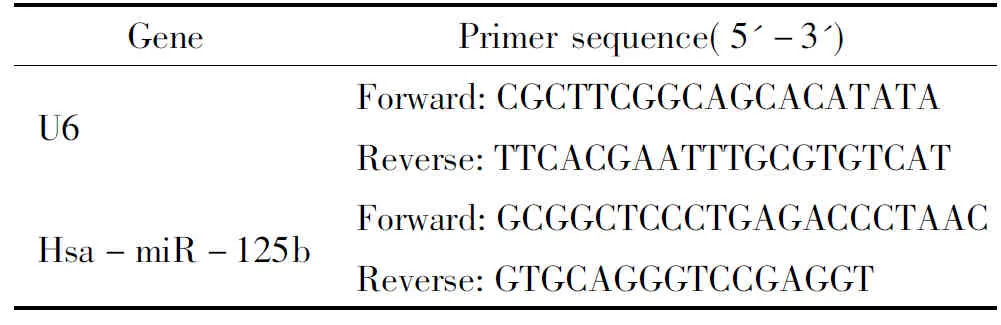
表2 引物序列
5细胞增殖实验
利用Cell Counting Kit-8(CCK-8)(碧云天)检测细胞增殖。实验按照产品说明书进行,具体是:用电转法将等量的反义寡核苷酸anti-miR-125b和阴性对照anti-miR-NC转染入细胞,接种于24孔板中培养。分别在转染后24 h、48 h、72 h、96 h取出相同体积的细胞,接种于96孔板中,加入10 μL CCK-8,使用多功能酶标仪检测450 nm的吸光值(A),630 nm作为参比波长。按以下公式计算抑制率:抑制率(inhibition ratio,IR,%) =1-(实验组平均A450-实验组平均A630)/(对照组平均A450-对照组平均A630)×100%。
6统计学处理
结 果
1基因芯片检测儿童AML中miR-125b表达增高
miRNA芯片对9例初发儿童急性白血病和3例正常骨髓中miRNAs的表达谱结果显示,在儿童AML初发患者中,miR-100、miR-125b、miR-335明显高表达。其中miR-125b在儿童AML中的表达增高,约为正常对照的12倍。
2miR-125b在儿童AML治疗前后的表达情况
结果显示,miR-125b在儿童AML中表达上调约16.6倍,其表达水平显著高于正常组(P<0.01),见图1,与前期芯片的结果相符。miR-125b在8例部分缓解样品中的表达降低,明显低于初发AML样品(P<0.01),见图1,而在10例完全缓解组中的表达更低,基本恢复到了正常组水平,与正常组相比差异无统计学意义(P>0.05),见图1。


图1ITP患者、初发AML患儿、部分缓解及完全缓解患儿miR-125b的差异表达
3anti-miR-125b抑制HL-60体外增殖
结果显示,与miR-NC组相比,anti-miR-125b反义寡核苷酸组的HL-60细胞增殖活性明显受到抑制。转染24 h后,细胞被抑制的情况不是很明显(抑制率为3.8%),48 h后,对照组仍正常增殖生长,转染了anti-miR-125b的实验组则生长停滞,甚至有细胞数量减少的趋势,48 h、72 h和96 h时,实验组细胞增殖的抑制率分别是33.3%、52.9%和56.6%。该结果提示,anti-miR-125b显著抑制HL-60细胞的增殖 (P<0.05),见图2。


图2反义寡核苷酸anti-miR-125b对白血病细胞系HL-60增殖的影响
讨 论
尽管目前对白血病的治疗取得很大进展,仍有相当部分儿童白血病预后恶劣,因此,寻找白血病新的治疗靶点,研发具有自主产权、毒副作用小的治疗白血病的新药具有重要的经济价值和社会意义。随着对miRNA功能以及调控机理研究的阐明,以miRNA为靶点的抗肿瘤寡核苷酸药物的研发成为了国际上的研究热点,它将区别于常规的肿瘤治疗,成为新一代的肿瘤基因治疗药物。因此,阐明肿瘤相关miRNA的功能具有重要意义,它可能为肿瘤治疗提供新的靶点[11-12]。
miR-125b是调控线虫时空发育的miRNA——lin4的同源基因,它有2个不同的前体成员,分别是miR-125b-1和miR-125b-2。最新研究表明,AML中成熟的miR-125b主要来源于miR-125b-1[13],而miR-125b-1前体位于11号染色体的脆性位点区[14]。随着对miRNA研究的深入,miR-125b功能报道逐渐增多。它不仅在人类发育过程起作用,如miR-125b通过靶向调控靶基因DGAT1、SGPL1、TBC1D1等调节神经元细胞分化[15];而且在癌症发生中也发挥重要作用, Zhou等[16]最近报道miR-125b能通过靶向结合bak的3’-UTR区域,抑制其蛋白的转录后翻译,从而促进乳腺癌细胞的增殖,抑制细胞凋亡。本研究通过芯片和实时荧光定量PCR技术对儿童急性髓系白血病患者中miR-125b的表达进行研究,发现miR-125b在儿童AML中显著高表达,治疗后部分缓解患者下降,而完全缓解的患者下降到正常水平,说明miR-125b很可能在儿童AML中发挥了重要作用。进一步对其功能进行研究发现,miR-125b的反义寡核苷酸小分子能够有效抑制HL-60细胞增殖。本研究结果与Zhou等在乳腺癌中的研究结果相似,我们推测miR-125b很可能在儿童AML的发生中也起着癌基因作用,至于miR-125b是否也是通过抑制靶基因bak而发挥作用正在研究之中。
本文研究了miR-125b在儿童AML中的表达及功能,为利用反义核酸技术开展针对 miR-125b的靶向治疗成为可能,从而为白血病的基因治疗开辟新的途径。但是肿瘤的发生、发展是一个多基因参与、逐步演化的复杂过程,因此对于miR-125b引起上述改变的具体机制和作用靶点还需进一步的研究,以期为理解肿瘤的发生、发展机制、寻找有效的肿瘤治疗靶标和方法打下基础。
[1] 胡亚美,江载芳,诸福棠.实用儿科学[M].第7版.北京:人民卫生出版社,2003:2208-2213.
[2] Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers [J]. Nature, 2005, 435 (7043):834-838.
[3] 郭艳合,张义玲,刘 立,等.非编码RNA与人类重大疾病的发生及其在生物医学领域内应用[J].中国病理生理杂志,2009,25(6) :1232-1239.
[4] Xiong Y, Fang JH, Yun JP, et al. Effects of microRNA-29 on apoptosis, tumorigenicity, and prognosis of hepatocellular carcinoma[J]. Hepatology, 2010, 51(3):836-845.
[5] Jiang S, Zhang HW, Lu MH, et al. MicroRNA-155 functions as an OncomiR in breast cancer by targeting thesuppressorofcytokinesignaling1 gene[J]. Cancer Res, 2010, 70(8):3119-3127.
[6] Tsuruta, Tomohiko, Kozaki, et al. miR-152 is a tumor suppressor microRNA that is silenced by DNA hypermethylation in endometrial cancer[J]. Cancer Res, 2011, 71(20): 6450-6462.
[7] Carthew RW, Sontheimer EJ. Origins and mechanisms of miRNAs and siRNAs [J].Cell,2009,136(4):642-655.
[8] Cimmino AG, Calin A, Fabbri M, et al. miR-15 and miR-16 induce apoptosis by targeting BCL2[J]. Proc Natl Acad Sci USA, 2005, 102 (39):13944-13949.
[9] Venturini L, Battmer K, Castoldi M, et al. Expression of the miR-17-92 polycistron in chronic myeloid leukemia (CML) CD34+cells[J]. Blood, 2007, 109(10):4399-4405.
[10]徐 令, 梁燕妮, 罗学群, 等. miRNA表达与儿童急性淋巴细胞白血病预后及复发相关性研究[J].中华血液学杂志,2011, 32(3): 178-181.
[11]Budhu A, Ji J, Wang XW. The clinical potential of microRNAs [J]. J Hematol Oncol, 2010, 3:37.
[12]郭 敏,李育敏,费 嘉,等.以microRNA-21为靶标的反义寡核苷酸对人白血病K562细胞的抑制作用[J].中国病理生理杂志,2009, 25(6):1127-1131.
[13]Bousquet M,Quelen C, Rosati R, et al. Myeloid cell differentiation arrest by miR-125b-1 in myelodysplastic syndrome and acute myeloid leukemia with the t(2;11)(p21;q23) translocation[J]. J Exp Med, 2008, 205(11):2499-2506.
[14]Calin GA, Sevignani C, Dumitru CD, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci USA, 2004, 101(9):2999-3004.
[15]Le MT, Xie H, Zhou B, et al. MicroRNA-125b promotes neuronal differentiation in human cells by repressing multiple targets [J]. Mol Cell Biol, 2009,29(19):5290-5305.
[16]Zhou M, Liu Z, Zhao Y, et al. MicroRNA-125b confers the resistance of breast cancer cells to paclitaxel through suppression of pro-apoptotic Bcl-2 antagonist killer 1 (Bak1) expression[J].J Biol Chem, 2010, 285(28):21496-21507.
ExpressionofmiR-125binpediatricacutemyeloidleukemiaandtheeffectofanti-miR-125boligonucleotideonproliferationofhumanleukemiccells
LIU Xiao-dan1, XU Ling2, TAN Wei-ping3, YAN Mu-xia2
(1TheCenterofMedicalResearch,3DepartmentofPediatrics,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China;2DepartmentofHematology,GuangzhouWomenandChildren’sMedicalCenter,Guangzhou510623,China.E-mail:luoxul64@yahoo.com)
AIM: To investigate the expression of miR-125b in pediatric acute myeloid leukemia (AML), and to explore the inhibitory effect of anti-miR-125b oligonucleotide on human leukemic cells.METHODSThe expression of miRNAs in pediatric AML bone marrow cells was analyzed by gene microarray and real-time quantitative PCR. HL-60 cells were transfected with anti-miR-125b, which was complementary to miR-125b in sequence, and the viability of HL-60 cells was measured by CCK-8 assay 24 h, 48 h, 72 h and 96 h after electroporation.RESULTSThe expression levels of miR-125b in the cells of newly diagnosed pediatric AML patients was almost 12 times as high as that in the cells of idiopathic thrombocytopenic purpura cases.However, the decreased levels of miR-125b in the cells of partial remission patients and returned to normal in the cells of completely remission patients were observed. At the same time, the growth rate of the cells treated with anti-miR-125b oligonucleotide was obviously decreased compared with that of control cells.CONCLUSIONmiR-125b may take effect as an oncogene in pediatric AML. Anti-miR-125b oligonucleotide may be useful as a new drug for treating pediatric AML.
miR-125b; Oligonucleotides,antisense; HL-60 cells
R342.7
A
10.3969/j.issn.1000-4718.2012.04.029

