Aβ1-42作用的小胶质细胞对体外培养的神经干细胞生存的影响*
韦美丹, 林继宗, 朱 宁, 王克万, 王 勇△
(1南方医科大学珠江医院药剂科, 广东 广州 510282; 2中山大学第三附属医院肝胆外科, 广东 广州 510630; 3南方医科大学南方医院神经外科, 广东 广州 510015)
1000-4718(2012)04-0683-06
2011-12-27
2012-03-09
国家自然科学基金资助项目 (No.30973162); 广东省自然科学基金资助项目 (No.07005203)
△通讯作者 Tel:020-61643555; E-mail:yongwh2005@163.com
Aβ1-42作用的小胶质细胞对体外培养的神经干细胞生存的影响*
韦美丹1, 林继宗2, 朱 宁1, 王克万3, 王 勇1△
(1南方医科大学珠江医院药剂科, 广东 广州 510282;2中山大学第三附属医院肝胆外科, 广东 广州 510630;3南方医科大学南方医院神经外科, 广东 广州 510015)
目的探讨β-淀粉样蛋白(Aβ1-42)作用的小胶质细胞对体外培养的神经干细胞(NSCs)生存的影响。方法利用Transwell小室在体外建立NSCs与小胶质细胞共培养体系,检测Aβ1-42蛋白作用小胶质细胞前后NSCs增殖、分化及凋亡情况。结果与单纯共培养组相比,Aβ1-42干预共培养组的增殖率降低,且微管相关蛋白2(MAP-2)和胆碱乙酰转化酶(CHAT)阳性表达率也均降低。结论Aβ1-42介导的炎症反应抑制了神经干细胞的增殖,促进其凋亡,并能显著降低其分化成神经元尤其是胆碱能神经元的能力。
小胶质细胞;神经干细胞;阿尔茨海默病; 淀粉样β蛋白
阿尔茨海默病(Alzheimer disease,AD)是一种神经元进行性丢失和认知障碍的中枢神经系统退行性疾病[1]。β-淀粉样蛋白(beta-amyloid protein, Aβ)沉积激活小胶质细胞引起的炎症反应是导致AD脑内神经元丢失的重要原因[2]。神经干细胞(neural stem cells, NSCs)是一种具有自我更新和多向分化潜能的神经前体细胞,正常条件下可以分化成神经元、星形胶质细胞和少突胶质细胞等。但是,从神经干细胞技术治疗AD构想的提出到现在,无论是促进AD患者内源性神经细胞生成还是外源性神经干细胞移植,均未获得成功。这可能与Aβ致AD患者颅内“微环境”改变有关。因此,如何改善AD脑内“微环境”进行干细胞移植成为治疗AD研究热点。本研究旨在利用Transwell装置建立神经干细胞和小胶质细胞共培养体系,在细胞水平上探讨Aβ作用的小胶质细胞对神经干细胞生存的影响,以证实Aβ介导的神经细胞生成抑制是否通过小胶质细胞间接实现。
材 料 和 方 法
1材料
新生SD大鼠由南方医科大学实验动物中心提供[合格证号为SCXK (粤) 2006-0015]。DMEM/F12、B27、胎牛血清(fetal bovine serum, FBS)、胰酶和L-谷氨酰胺(L-glutamine,L-Gln)均购自Gibco;表皮生长因子(epidermal growth factor, EFG)和碱性成纤维细胞生长因子(basic fibroblast growth, bFGF)均购自R&D system;神经巢蛋白(nestin)、5-溴-2-脱氧尿嘧啶核苷(5-bromo-2'-deoxyuridine, BrdU)、胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、CD11b/c、微管相关蛋白2(microtubule-associated protein 2, MAP-2)、胆碱乙酰转移酶(choline acetyltransferase, CHAT)抗体及相关Ⅱ抗均购自Abcam; 多聚赖氨酸、Aβ1-42、Hoechst 33258及annexin V-FITC/PI检测试剂盒购自Sigma;Transwell板 (孔直径0.4 μm) 购自Costar。
2方法
2.1大鼠神经干细胞分离、培养与鉴定 参照兰艳纤等[3]的方法,新生SD大鼠海马组织中分离出的细胞用含EGF(20 μg/L)、bFGF(20 μg/L)、B27(2%)、L-Gln(2%)和青链双霉素(1%)的DMEM/F12培养液重悬后以1×109/L接种于25 cm2透气培养瓶内。置37 ℃、5% CO2细胞培养箱中培养,每3~4 d半量换液第7 d结束原代培养并进行传代培养,每6~7 d传代1次。取第2代NSCs进行nestin鉴定;第2代神经细胞球制备单细胞悬液,加入10 μmol/L BrdU标记24 h后全量换液培养4 d后将神经细胞球转移到用多聚赖氨酸包处理的24孔板中贴壁培养2 h后,免疫荧光鉴定细胞增殖能力;第2代神经干细胞用含10% FBS的DMEM/F12培养液进行正常分化处理,分化10 d后分别行GFAP和MAP-2免疫细胞荧光染色鉴定细胞多向分化潜能。
2.2大鼠小胶质细胞的纯化、培养与鉴定 参照雷露雯等[4]的方法,新生SD大鼠海马组织经0.125% 胰蛋白酶消化后离心,弃上清,细胞沉淀用含10% FBS的DMEM/F12培养基重悬,单细胞悬液以5×108/L细胞密度接种于经多聚赖氨酸包被处理的75 cm2透气培养瓶中,37 ℃、5% CO2孵育箱中培养2 d后全量换液,待培养至7~9 d,手摇法分离纯化小胶质细胞,并通过小胶质细胞特异性抗体CD11b/c进行免疫细胞化学检测,同时以Hoechst 33258对细胞核进行复染,以明确细胞总数,计算小胶质细胞纯度。
2.3共培养体系的建立与实验分组 用6孔板的Transwell小室构建双层细胞共用培养液而不直接接触的共培养体系。将Transwell小室作为培养体系上室,接种NSCs,培养体系下室为6孔塑料培养板,接种纯化后的小胶质细胞,探讨Aβ1-42激活小胶质细胞前后对NSCs生存的影响。实验分4组:(1) 空白对照组(control):神经干细胞正常培养于上室,下室加培养基;(2) 实验对照组(Aβ1-42+NSCs):神经干细胞培养于上室,下室加入10 μmol/L Aβ1-42的培养基;(3) 单纯共培养组(microglia and NSCs coculture):神经干细胞与小胶质细胞以1∶1的浓度比依次接种于上室和下室; (4) Aβ1-42干预共培养组(Aβ1-42+microglia and NSCs coculture):神经干细胞与小胶质细胞以1∶1的浓度比依次接种于上室和下室,同时小胶质细胞层加入10 μmol/L Aβ1-42。各处理组于37 ℃、5% CO2孵育箱中培养96 h后,进行后续指标检测。
2.4BrdU掺入法检测神经干细胞增殖率 第2代神经干细胞球制备成单细胞悬液,加入10 μmol/L BrdU标记24 h后,收集细胞并重悬。细胞悬液按照实验分组情况分别进行加药处理。共培养96 h后将各组神经细胞球转移到用多聚赖氨酸包被处理过的24孔板中贴壁培养2 h后,按常规方法进行免疫荧光鉴定各组细胞BrdU表达,即:收集各组细胞,4% 多聚甲醛室温固定;0.3% Triton X-100透化处理;10% 山羊血清封闭后,小鼠抗BrdU单抗4 ℃湿盒孵育过夜;FITC羊抗小鼠IgG避光孵育1.5 h。Hoechst 33258核染后,荧光显微镜下观察并照相。
2.5流式细胞仪检测神经干细胞分化 第2代神经干细胞球用含10% FBS的DMEM/F12培养液进行正常分化处理5 d后,按照实验分组情况分别进行加药处理。共培养96 h后行MAP-2和CHAT免疫荧光染色。所用Ⅰ抗分别为鉴定神经元的小鼠抗MAP-2单抗和鉴定胆碱能神经元的兔抗CHAT多克隆抗体。所用Ⅱ抗分别为FITC标记的抗小鼠IgG和抗兔IgG 抗体。采用流式细胞仪(FACS)分析,用Cell Quest 3.0 软件进行分析。
2.6流式细胞仪分析神经干细胞凋亡率 第2代神经干细胞球制备成单个细胞悬液并用含EGF(20 μg/L)、bFGF(20 μg/L)、B27(2%)、L-Gln(2%)和青链双霉素(1%)的DMEM/F12培养液重悬,然后按照实验分组情况分别进行加药处理。各组细胞经处理96 h之后,参照annexin V-FITC/PI检测试剂盒说明书进行前期处理后,上流式细胞仪检测。
3统计学处理
结 果
1NSCs培养及鉴定
倒置显微镜镜下观察:原代接种的细胞为圆型、透亮的单个细胞,培养2~4 d后,可形成由数十至数百个细胞组成的神经干细胞球,细胞球球体透亮,形态规则,边缘整齐,边界清晰,排列紧密,周边有亮的光晕,培养液中悬浮生长,见图1A;经免疫荧光鉴定神经细胞球表达nestin阳性,见图1B;BrdU阳性,见图2。10% FBS分化条件下培养,细胞呈贴壁生长,可见细胞逐渐从球体中“爬”出来,培养5 d后细胞呈多种形态,见图3A;经免疫荧光鉴定部分细胞呈MAP-2阳性,见图3B;GFAP阳性,见图3C。

Figure 1. Morphology and identification of the cultured fetal neural stem cells derived from the hippocampus (scale bar=100 μm). A:inverted microscope photograph showed numerous neurospheres at 3 d of primary culture. B: most of the cells in the second passage of neurospheres were nestin positive.
图1神经干细胞的培养与鉴定

Figure 2. Identification of the neural stem cells (NSCs) by BrdU incorporation. Nearly all cells expressed high level of BrdU (A and C, green). Nuclei were counterstained with Hoechst 33258 (B and C, blue). Scale bar=100 μm.
图2BrdU掺入法检测NSCs增殖
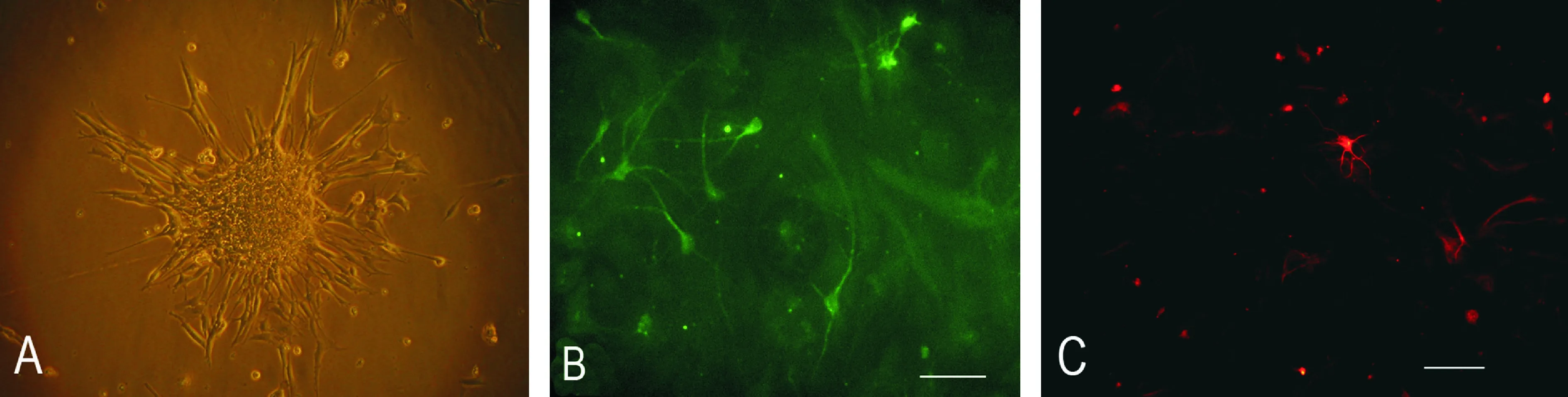
Figure 3. Identification of the neural stem cells (NSCs) by immunofluorescence.A:a number of cells migrated from the neurosphere and were induced by 10% FBS for 5 dinvitro(×400);B:the microtubule-associated protein 2 (MAP-2) positive cells differentiated from passage neurospheres (green);C:the glial fibrillary acidic protein (GFAP) positive cells differentiated from passage neurosphere (red). Scale bar=100 μm in B and C.
图3免疫荧光检测NSCs分化
2小胶质细胞培养与鉴定
原代培养的细胞主要是以星形胶质细胞为主,并含有小胶质细胞、神经元和少量的少突胶质细胞,见图4A。细胞培养9 d出现分层现象后,通过手摇法分离纯化获得小胶质细胞。显微镜下观察:小胶质细胞胞体扁平或卵圆形,突起细长,见图4B。经CD11b/c免疫荧光检测,阳性率在95%以上,见图5。
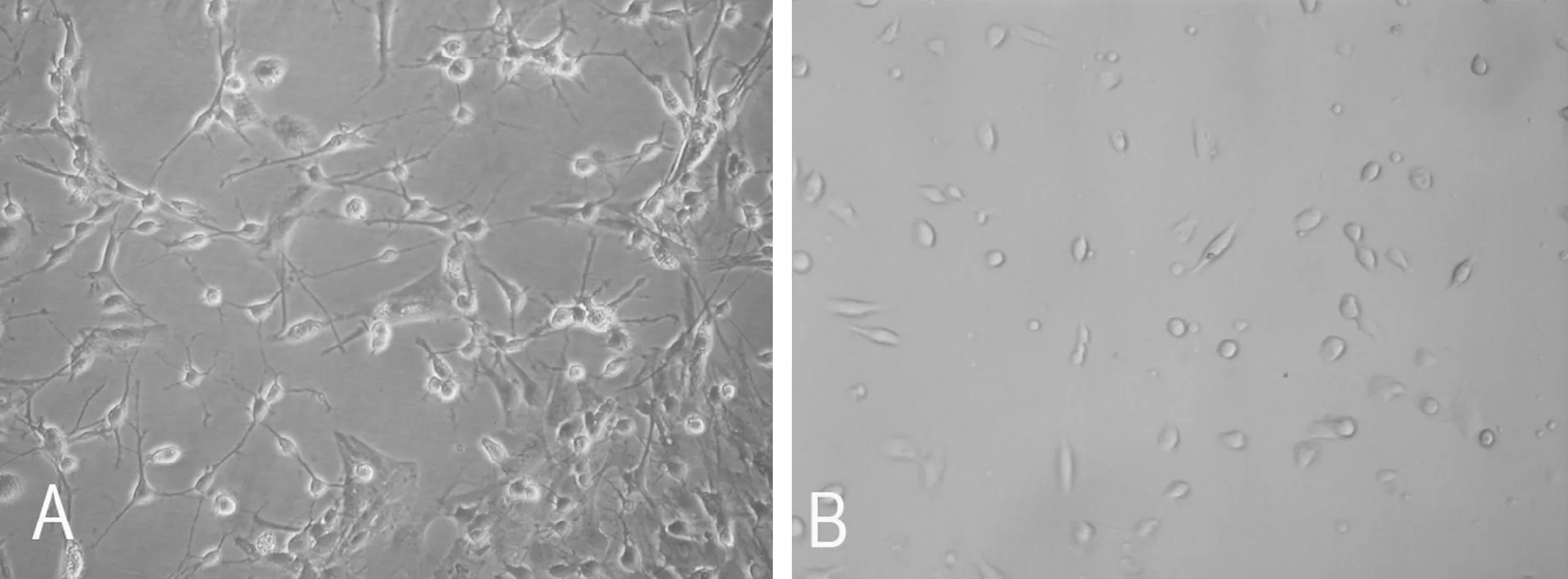
Figure 4. Isolation and purification of microglia (×200).A: morphology of the primary glial cells 9 d after culture;B: the purity of microglia 2 d after culture.
图4小胶质细胞分离纯化

Figure 5. Identification of the purified microglia by CD11b/c immunofluorescent staining(scale bar=100 μm). A:the localization of CD11b/c was shown in red;B:nuclei were counterstained with Hoechst 33258;C:a merged image showed that more than 95% cells were double positive for microglial marker CD11b/c.
图5免疫荧光鉴定小胶质细胞
3BrdU掺入法检测神经干细胞增殖
BrdU掺入法检测各组神经干细胞增殖率依次为:78.78%±5.49%、48.58%±1.83%、77.23%±14.77%和26.95%±3.30%。数据显示,单纯共培养组与空白对照组相比差异无统计学意义(P>0.05),而Aβ1-42干预共培养组与实验对照组及单纯共培养组相比差异均有统计学意义(均P<0.01)。这表明未经Aβ1-42作用的小胶质细胞对NSCs增殖影响不显著;Aβ1-42既能直接影响NSCs的增殖,又能通过作用于小胶质细胞使NSCs增殖抑制加强,见图6。
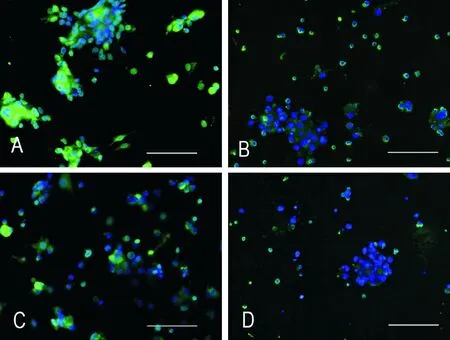
Figure 6. The proliferation of NSCs detected by BrdU incorporation (scale bar=100 μm). A:NSCs control;B: Aβ1-42+NSCs;C:microglia and NSCs coculture;D:Aβ1-42+microglia and NSCs coculture. The proportion of BrdU positive cells (A-D, green) relative to total cell count was estimated under a fluorescent microscope.Nuclei were counterstained with Hoechst 33258 (A-D, blue).
图6BrdU掺入法检测NSCs增殖
4小胶质细胞对共培养NSCs分化的影响
图7显示,单纯共培养组的MAP-2和CHAT阳性细胞数少于空白对照组(P<0.01)。与实验对照组和单纯共培养组相比,共培养体系中10 μmol/L Aβ1-42作用于小胶质细胞后, MAP-2和CHAT阳性细胞数减少,差异均有统计学意义(P<0.01)。
5流式细胞仪检测NSCs凋亡率
表1显示,单纯共培养NSCs与小胶质细胞时,NSCs凋亡率与空白对照组比较差异无统计学意义(P>0.05)。而在共培养体系中,小胶质细胞层中加入10 μmol/L Aβ1-42共同孵育96 h后,NSCs凋亡率均高于实验对照组与单纯共培养组,差异均有统计学意义(P<0.01)。
讨 论
Transwell是一种带有Transwell小室、外形为一个可放置在细胞培养板里的小杯子,杯子底层具有通透性的聚碳酸酯膜的装置,目前主要应用于细胞趋化、细胞迁移、细胞侵袭、共培养等多种方面的研究。近年来,越来越多的学者利用共培养技术研究细胞与细胞或是细胞与组织间的相互作用[5]。而这些研究主要是采取同一培养瓶、细胞相互接触的方法进行共培养,针对的对象主要为神经元,关于NSCs共培养研究较少。我们根据孔径0.4 μm的Transwell半透膜仅可以通过培养液而不能透过细胞的特点,在6孔塑料培养板上架起Transwell小室,构建NSCs与小胶质细胞共培养体系。与以往研究不同的是,我们采用Transwell这种特殊装置,实现非接触性细胞通讯,观察共培养体系中小胶质细胞在Aβ1-42作用下对NSCs生存的影响。为此,获得高纯度的神经干细胞和小胶质细胞是本研究构建共培养体系成功与否的关键。
Nestin(巢蛋白)是一种中间丝类型的蛋白,能够特异性表达在神经上皮干细胞上的一种分子标记物,是目前鉴定神经干细胞的主要特征性标记物[6]。本研究从新生SD乳鼠的海马组织中分离出单细胞重悬于无血清的DMEM/F12培养基中培养第3 d即可见神经细胞球,悬浮于培养液中。神经球经0.125 %胰酶消化成单个细胞悬液进行传代培养,3~4 d后重新形成神经球,数量明显多于第1代,免疫荧光鉴定呈nestin阳性,证实具有神经干细胞特性。神经干细胞除能表达nestin外,在功能上具有增殖分化的能力,因此,我们继续观察了培养的细胞球增殖分化的能力。将原细胞球分散成单细胞后,用10 μmol/L BrdU标记24 h后全量换液培养4 d后,行免疫荧光鉴定。结果显示绝大多数细胞呈BrdU阳性,说明它们是具有分裂、增殖能力的细胞。当神经球重悬于含10% FBS的DMEM/F12并接种于预先经多聚赖氨酸包被的24孔板时,神经球开始贴壁分化,可见细胞从球体周围逐渐迁移,随着时间的推移出现突起细胞并渐有突起增长、相互连接交织成网,形成可表达MAP-2、GFAP的神经元样细胞和胶质细胞样细胞,提示培养的神经干细胞具有分化为神经元及神经胶质细胞的潜能,从而也进一步证实了神经干细胞的多向分化潜能。
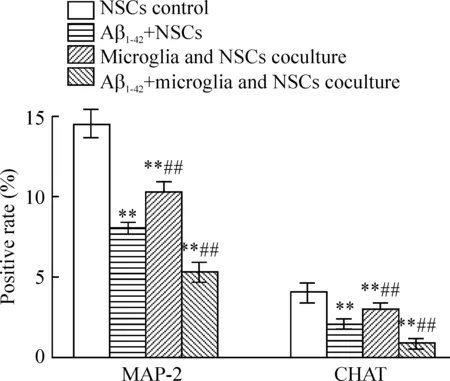
图7各组MAP-2及CHAT阳性细胞荧光表达率的比较
表1各组神经干细胞凋亡率的比较

GroupApoptoticrateNSCscontrol5.76±2.01Aβ1-42+NSCs25.77±0.48**MicrogliaandNSCscoculture8.43±5.35##Aβ1-42+microgliaandNSCscoculture45.19±1.02**##
**P<0.01vsNSCs control;##P<0.01vsAβ1-42+NSCs.
关于小胶质细胞的培养,目前学者们主要是采用摇床振摇和利多卡因分离的方式从混合培养的神经胶质细胞中分离小胶质细胞[4, 7]。本研究考虑到分离的小胶质细胞纯度会直接影响到Transwell体系的建立,我们采用了温和的手摇法从混合培养的神胶质细胞中分离小胶质细胞。该方法收集到的小胶质细胞生长状态较佳,细胞胞体呈圆型并具有较好的折光性,30 min内即可贴壁。同时,收获的小胶质细胞贴壁培养30 min后全量换液,去除未贴壁的细胞可达到纯化的目的。继续培养2 d后,可出现较多较短突起,少数细长突起,部分为圆型或椭圆形。经免疫荧光鉴定,分离的细胞有95% 可表达CD11b/c阳性,即为小胶质细胞。本研究体外获得了高纯度、高活力的神经干细胞和小胶质细胞,为Transwell共培养体系的建立提供了良好的细胞来源。
体内外研究均提示Aβ可激活小胶质细胞[8],激活的小胶质细胞后可释放多种细胞因子、趋化因子、补体及其激活物,导致非特异性炎细胞浸润,产生慢性炎性反应[9]。这种效应能否破坏脑内神经细胞生存和分化环境,造成内源性或移植的外源性神经干细胞不能发挥正常功能,导致AD脑内丢失的神经细胞得不到及时补充,目前尚未得到证实。因此,本实验建立神经干细胞和小胶质细胞共培养体系,先观察了Aβ1-42作用于小胶质细胞前后神经干细胞的增殖、分化情况。结果显示未经Aβ1-42作用的小胶质细胞对共培养的神经干细胞的增殖无明显影响作用,以往的研究也有类似报道[10];但神经干细胞分化成神经元和胆碱能神经元的比例下降,这可能与正常情况下小胶质细胞分泌某些因子有关。研究表明Aβ1-42能够直接抑制神经干细胞的增殖,促进其凋亡,减少其分化成神经元、胆碱能神经元的比例。在神经干细胞与小胶质细胞共培养体系中,Aβ1-42抑制神经干细胞自我更新能力及多向分化潜能的这种作用尤为明显,证实了Aβ1-42对神经细胞生存抑制的作用可能通过小胶质细胞而加强。也许正是这些因素,导致AD脑内微环境改变,影响内源性或外源性NSCs的生存。这既构成目前临床上应用NSCs治疗AD的严峻的挑战,也为AD的进一步治疗提供了新的线索。
因此,通过干预小胶质细胞改善患者脑内“微环境”,促进内源性或外源性NSCs生存,是干细胞移植治疗神经元退行性疾病的有效途径。而Aβ介导的炎症反应与NSCs失能之间的关系及作用机制还须进一步深入研究。
[1] Cacabelos R, Alvarez A, Lombardi V, et al. Pharmacological treatment of Alzheimer disease: from psychotropic drugs and cholinesterase inhibitors to pharmacogenomics[J]. Drugs Today (Barc), 2000, 36(7):415-499.
[2] Farias GG, Godoy JA, Vazquez MC, et al. The anti-inflammatory and cholinesterase inhibitor bifunctional compound IBU-PO protects from beta-amyloid neurotoxicity by acting on Wnt signaling components[J]. Neurobiol Dis, 2005, 18(1):176-183.
[3] 兰艳纤, 李金恒, 王克万, 等.神经干细胞原代培养方法的优化[J]. 中华神经医学杂志, 2011, 10(5):456-460.
[4] 雷露雯, 王 勇. 小胶质细胞α7-nAChR表达及意义[J]. 山东医药, 2008, 48(48):1-2.
[5] 李 升, 曾水林, 王 磊, 等. 嗅鞘细胞对神经干细胞增殖与分化的影响[J]. 神经解剖学杂志,2006,22(4):432-436.
[6] Gage FH, Ray J, Fisher LJ. Isolation, characterization, and use of stem cells from the CNS[J]. Annu Rev Neurosci, 1995, 18:159-192.
[7] 金玉玲, 刘 锲, 刘静静, 等. 小胶质细胞对体外培养神经干细胞向胆碱能神经元分化的影响[J]. 中国组织工程研究与临床康复, 2010,14(23):4222-4226.
[8] Rothwell NJ, Luheshi GN. Interleukin 1 in the brain: biology, pathology and therapeutic target[J]. Trends Neurosci, 2000, 23(12):618-625.
[9] Calafiore M, Battaglia G, Zappala A, et al. Progenitor cells from the adult mouse brain acquire a neuronal phenotype in response to beta-amyloid[J]. Neurobiol Aging, 2006, 27(4):606-613.
[10]Villeda S, Wyss-Coray T. Microglia:a wrench in the running wheel?[J]. Neuron, 2008, 59(4):527-529.
EffectsofAβ1-42-inducedmicroglialcellsonsurvivalofneuralstemcellsinvitro
WEI Mei-dan1, LIN Ji-zong2, ZHU Ning1, WANG Ke-wan3, WANG Yong1
(1DepartmentofPharmacy,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou510282,China;2DepartmentofHepatobiliarySurgery,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China;3DepartmentofNeurosurgery,SouthernHospital,SouthernMedicalUniversity,Guangzhou510515,China.E-mail:yongwh2005@163.com)
AIM: To explore the effects of β-amyloid protein 1-42 (Aβ1-42)-induced microglia on the survival of cultured neural stem cells (NSCs)invitro.METHODSUsing the Transwell chambers to build a coculture system of NSCs and microglia, we detected the proliferation, differentiation and apoptosis of the NSCs with the microglia before and after induction by Aβ1-42.RESULTSCompared with non-intervention group, the proliferation rate of NSCs in Aβ1-42intervention coculture group decreased, as well as the positive expression rates of microtubule-associated protein 2 (MAP-2) and choline acetyltransferase.CONCLUSIONThe inflammation mediated by Aβ1-42inhib their the proliferation of NSCs and induces their apoptosis. Inflammation also significantly reduces the ratio of NSCs differentiating to neurons, especially to cholinergic neurons.
Microglial; Neural stem cells; Alzheimer disease; Amyloid beta-protein
R363
A
10.3969/j.issn.1000-4718.2012.04.018

