湘油15 PGIP 9蛋白基因的克隆和蛋白序列结构分析及原核表达
,,,*
(1湖南农业大学油料作物研究所,长沙 410128; 2 国家油料作物改良中心湖南分中心, 湖南长沙 410128)
2011-09-14
刘睿洋(1986—),男,河南平顶山人,硕士研究生,Email:ruiyang_liu2007@126.com。*通信作者,Email:guancy2011@yahoo.com.cn。
国家“863”基金项目(2006AA10A112);农业部“948”基金项目(2011-G23)。
湘油15 PGIP 9蛋白基因的克隆和蛋白序列结构分析及原核表达
刘睿洋1,皇甫海燕2,靳芙蓉2,官春云2*
(1湖南农业大学油料作物研究所,长沙 410128; 2 国家油料作物改良中心湖南分中心, 湖南长沙 410128)
运用生物信息学软件对湘油15PGIP9基因的核苷酸、蛋白氨基酸序列进行分析,并对其蛋白结构进行预测。结果表明:湘油15PGIP9编码区CDS长1 011 bp,编码336个氨基酸的开放阅读框,分子量为37.5 kDa,等电点为7.9。N端1~22个氨基酸是信号肽,且这一区域疏水性较强,具有5个潜在的N-糖基化位点。N端和C端还各具有4个参与二硫键形成的半胱氨酸残基。二级结构显示有11个α-螺旋,14个β-延伸和25个无规则卷曲。中心LRR结构域由6个串联的LRR基序组成。随后将PGIP9的CDS序列亚克隆到原核表达载体pET-32a(+)中,构建pET-32a-PGIP9重组表达质粒,并转化E.coilBL21(DE3),25℃,终浓度为0.2 mmol/L和0.5 mmol/L的 IPTG诱导2 h,都成功的表达了融合蛋白pET-32a-PGIP9,其分子量约为52 kDa,发现主要以包涵体形式存在,没有可溶形式的蛋白表达。
甘蓝型油菜;多聚半乳糖醛酸酶抑制蛋白;原核表达;序列分析;结构预测
油菜菌核病严重的影响到了油菜的产量和品质[1],而内切多聚半乳糖醛酸酶(edo-polygalacturonases,PGs)是植物致病的主要因素[2,3]。相关研究[4,5]表明,植物体内会产生一种特异性的热稳定糖蛋白——多聚半乳糖醛酸酶抑制蛋白(polygalacturonase-inhibiting proteins,PGIPs)来抵御PGs对自身的侵害。近些年来,国内外学者[6~9]对植物PGIP基因进行了广泛深入的研究,证明PGIPs主要通过亮氨酸重复结构域(Leucine-reach repeat,LRR)来发挥其抑制PGs的作用。笔者克隆了抗菌核病油菜湘油15的PGIP9 CDS序列,并运用生物信息学软件进行分析,随后将其构入原核表达载体,进行体外表达,旨在对PGIP9基因抗菌核病机理进行探索。
1 材料与方法
1.1 材料
甘蓝型油菜湘油15号和油菜菌核均由国家油料改良中心湖南分中心提供。Pfu DNA聚合酶、A-Tailing 试剂盒、T4-DNA连接酶、Taq DNA 聚合酶、质粒提取试剂盒、DNA 片段纯化/回收试剂盒、BL21(DE3)感受态细胞、低分子量标准蛋白(14.4 ~94.0 kDa)、2×蛋白上样缓冲液均购自北京天根生化科技公司。Plant Total RNA 提取试剂盒购自安比奥公司;限制性内切酶和cDNA Synthesis试剂盒购自Fermentas公司;大肠杆菌TOP10、pMD-18T购自TaKaRa公司。BugBuster Master Mix预混蛋白抽提试剂盒;2异丙基-β-D硫代半乳糖苷(IPTG)、其它化学药品均为分析纯。原核表达载体pET-32a(+)由湖南农业大学动物医学院分子与免疫学实验室提供。
1.2 方法
1.2.1 菌核菌菌丝的培养和油菜叶片的接种
根据油菜接种菌核菌后诱导了其体内的PGIP含量增加,接种湘油15油菜叶片。菌核菌菌丝的培养和油菜叶片的接种参照文献[10]的方法。接种好的油菜,放于培养箱温度25℃,湿度90%,培养18 h后剪取接种叶片无病斑的部分,用于提取总RNA。
1.2.2 湘油15 PGIP 9基因的克隆
RNA的提取按照安比奥RNA提取试剂盒步骤,第一链cDNA的合成按照Fermentas RevertAidTMFirst Strand cDNA Synthesis Kit步骤。参考NCBI公布油菜(Brassicanapus)PGIP9基因序列(GenBank登录号EU142030),并根据其CDS序列设计一对特异引物,并在上、下游引物两端分别引入BamHI和SalI酶切位点。
上游引物PF: 5’ GGATCCATGGATCATAAGACAAACAC3’,下游引物PR:5’ GTCGACTTACTTGCAACTACTATCAA3’
以上引物由Invitrogen生物公司合成。以第一链cDNA为模板,PCR扩增目的基因。程序:94℃预变性3 min,94℃变性50 s,57℃退火50 s,72℃延伸2 min,共27个循环;最后72℃保温5 min。1.5%琼脂糖凝胶电泳检测,切目的条带用胶回收试剂盒回收。回收产物与pMD18-T载体连接。连接产物转化E.coliTOP10感受态细胞,PCR鉴定阳性克隆,送去Invitrogen生物公司测序。
1.2.3 湘油15 PGIP9序列分析及蛋白结构预测
以DNAMAN软件分析PGIP9 CDS序列、氨基酸序列,预测其分子量。以DNAStar软件分析了等电点、亲水性与疏水性、各种酸、碱性氨基酸、疏水性氨基酸、亲水性氨基酸的组成以及各氨基酸在PGIP9蛋白的比例。SignalP 3.0Server预测PGIP9蛋白的N端信号肽。NetNGlyc 1.0 Server预测N-糖基化位点。ProtScale预测蛋白质的疏水性和亲水性以及PGIP9蛋白的二级、三级结构。
1.2.4 pET-32a-PGIP9重组质粒的构建及在E.coli BL21(DE3)中的诱导表达
BamHI和SalI,分别双酶切PGIP9和pET-32a(+)质粒,胶回收目的片段,经T4-DNA连接酶连接。连接产物转化宿主菌E.coliBL21(DE3),筛选阳性克隆,提取质粒DNA后,进行酶切鉴定。挑取单菌落于5 mL LB液体培养基(70 g/mLAmp+), 37℃摇床震荡过夜培养活化。次日取活化的培养物按1∶100比例接种到LB液体培养基(70 g/mLAmp+),37℃,300 rpm震荡培养,待OD600值约为0.6时,加IPTG终浓度至0.2 mmol/L和0.5 mmol/L,25 ℃诱导2 h,收集1 mL菌液,12 000 rpm 离心10 min,弃上清液,收集菌体沉淀。将沉淀用BugBuster Master Mix预混蛋白抽提试剂,破碎大肠杆菌细胞壁(按照BugBuster Master Mix Kit步骤),抽提后沉淀和上清各加入等体积的2×蛋白loading buffer,沸水浴5 min,冰浴2 min,5%的浓缩胶和12%的分离胶,SDS-PAGE可溶性分析。
2 结果与分析
2.1 湘油15 PGIP 9 CDS的克隆
由图1、图2可以看出, RT-PCR扩增得到了一条大小约为1 100 bp的片段。经测序分析,其碱基序列与NCBI库上公布的甘蓝型油菜PGIP9 CDS序列同源性为97.23%。
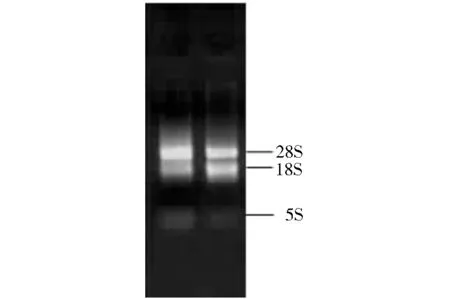
图1 湘油15总RNA的提取

图2 湘油15 PGIP9 CDS序列RT-PCR扩增
2.2 湘油15 PGIP9蛋白结构分析
2.2.1 PGIP9氨基酸序列分析
运用DNAStar软件对湘油15 PGIP9蛋白氨基酸序列进行分析,该序列包含一个编码336个氨基酸的开放阅读框,其理论分子量为37.5 kDa,等电点为7.9。pH为7.0时,电荷为3.30,碱性氨基酸(KR)26个,占总分子量的9.72%,占残基总数的7.74%;酸性氨基酸(DE)24个,占总分子量的7.67%,占氨基酸残基总数的7.14%;疏水氨基酸(AILFWV)115个,占总分子量的35.53%,占氨基酸残基总数34.23%;极性氨基酸(NCQSTY)117个,占总分子量的33.76%,占氨基酸残基总数的34.82%。其中亮氨酸的个数是50,所占的比例最高,占总分子量的15.10%,占氨基酸残基总数14.88%。
由图3可以看出, 1~22个氨基酸是信号肽,信号肽裂解点位于第22和23个氨基酸之间。蛋白质序列中的信号肽有助于蛋白本身向细胞内特定区域移动,表明与蛋白质的定位有关。预测得到湘油15 PGIP9蛋白质氨基酸序列具有5个潜在的N-糖基化位点,分别位于第6,111,135,243,296位氨基酸处,结构为N-X-T/S。N端和C端还各具有4个参与二硫键形成的半胱氨酸残基。

图3 湘油15 PGIP9 CDS序列及氨基酸序列方框内为起始密码子ATG和终止密码子TAA;下划线为信号肽序列;浅色阴影部分为N-糖基化位点;深色心型阴影为半胱氨酸残基。
2.2.2 湘油15 PGIP9二级结构LRR基序和三级结构预测
由图4、图5可以看出,湘油15 PGIP9蛋白有11个α-螺旋,14个β-延伸链,25个无规则卷曲,蛋白质凹面结构主要由β-折叠/β-转角区构成,凸面结构主要是α-螺旋,中心LRR结构域由6个串联的LRR基序组成,是由β折叠和α螺旋通过loop环连接形成的一个马蹄型分子结构。从第125个氨基酸出现且具有“xLxxLxLxxNxLxGxIPxxLxxL”序列的共同序列。其LRR除个别替换、插人或缺失外,序列高度保守。

图4 湘油15 PGIP9二级结构LRR基序

图5 湘油15 PGIP9三维结构预测
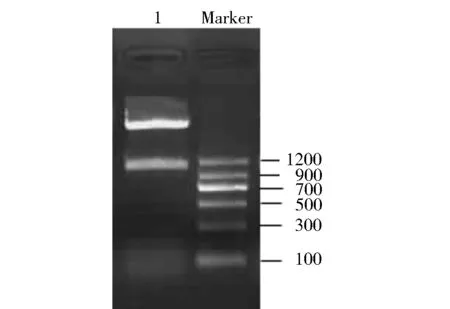
图6 重组表达质粒pET-32a-PGIP9双酶切鉴定
2.3 pET-32a-PGIP9重组质粒的构建
由图6可见,双酶切所得片段与目的基因大小一致,证明PGIP9基因已正确插入到了pET-32a(+)原核表达载体上。
2.4 pET-32a-PGIP9重组蛋白在E.coli BL21(DE3)中的诱导表达及可溶性分析
由图7可以看出,pET-32a-PGIP9重组质粒在25℃、IPTG终浓度分别为0.2,0.5 mmol/L诱导2 h后,破菌裂解的沉淀中在预期位置(箭头所指处约52 kDa)附近出现了诱导条带(泳道4和泳道6)。裂解的上清液中在预期位置没有诱导蛋白条带的出现(泳道3和泳道5)。未诱导的和阴性对照则都没有相应的蛋白条带出现(泳道1和泳道2)。结果表明pET-32a-PGIP9重组质粒在大肠杆菌中能够成功表达,融合蛋白主要以不溶的包涵体形式存在,没有可溶形式的蛋白表达。

图7 pET-32a-PGIP9重组蛋白诱导表达电泳图泳道1:25℃,pET-32a(+)空载体诱导2 h;泳道2:pET-32a-PGIP9未诱导;泳道3:25℃,0.2 mmol/L IPTG,pET-32a-PGIP9诱导2 h破菌上清;泳道4:25℃,0.2 mmol/L IPTG,pET-32a-PGIP9诱导2 h破菌沉淀;泳道5:25℃,0.5 mmol/L IPTG,pET-32a-PGIP9诱导2 h破菌上清;泳道6:25℃,0.5 mmol/L IPTG,pET-32a-PGIP9诱导2 h破菌沉淀
3 结论与讨论
前人研究[11~15]表明,PGIPs属于高等植物LRR蛋白家族,具有典型的重复LRR基序结构[11],LRR结构由β-折叠/β-转角/β-折叠/α-螺旋结构区域构成,被认为是参与蛋白质—蛋白质相互作用的关键区域[12],PGIPs正是通过LRR基序暴露于外表面的氨基酸残基来抑制PGs的活性[13],PGIPs—PGs相互作用已成为在分子水平上研究植物富含亮氨酸的重复单位介导的特异识别的一种模式系统[14,15]。本试验对湘油15 PGIP9蛋白序列进行预测分析:该蛋白具有 6个LRR重复序列,从第125个氨基酸开始具有“xLxxLxLxxNxLxGxIPxxLxxL”这样的保守序列;在N端和C端各有4个Cys残基,相邻的两个Cys残基经氧化反应形成1个-S-S-,对于维持蛋白质的结构稳定和生物活性具有重要作用[16]。同时对湘油15 PGIP9进行了原核大肠杆菌体外表达,诱导所得蛋白条带与预期的融合蛋白大小一致。试验结果显示,在温度25℃,IPTG浓度0.2 mmol/L,时间2 h内,pET-32a-PGIP9重组质粒虽然在E.coilBL21(DE3)中能够稳定高效表达,但还是主要以包涵体形式存在,没有可溶形式的蛋白表达。包涵体虽然没有生物活性,但可有效防止细胞内蛋白酶的水解作用,使目的蛋白大量聚集,并有利于表达量的提高,也便于蛋白的分离纯化[17]。PGIP9蛋白主要以不溶的包涵体表达,可能是蛋白本身的结构所致,其疏水氨基酸所占比例较高。但对于湘油15 PGIP9蛋白抗菌核病机理研究,还需进一步试验探讨。
[1] 官春云, 李方球, 李 栒,等.双低油菜湘油15(B.napus)对菌核病抗性的研究[J].作物学报,2003, 29(5):715-718.
[2] Lorenzo GD,Ovidio RD,Cervone F.The role of polygalacturonase-inhibiting proteins (PGIPs) in defense against pathogenic fungi[J]. Phytopathol, 2001,39:313-335.
[3] Di CX,Zhang MX,Xu SJ, et al. Role of polygalacturonase inhibiting protein in plant defense[J].Critical Reviews in Microbiology, 2006,32(2): 91-100.
[4] D’Ovidio R,Mattei B,Roberti S. Polygalacturonases,polygalacturonase-inhibiting protein and pectic oligomers in plant-pathogen interactions[J].Biochimica Biophysica Acta,2004,(2):237-244.
[5] Turner JG,Hoffman RM. Effect of the PGIP from Pea on the hydrolysis of Pea cell walls by the endo-PG fromAscochytapisi[J].Plant Pathol,1985,34:54-60.
[6] Albersheim P, Anderson AJ. Protein from plant cell wall inhibit polygalacturonases secreted by plant pathogens[J]. Proc Natl Acad Sci USA,1971,68:1815-1819.
[7] 罗 娅,汤浩茹,张 勇,等.草莓多聚半乳糖醛酸酶抑制蛋白基因(PGIP)的克隆及组织特异性表达[J].农业生物技术学报,2010,18(3) :424-430.
[8] 古英洪,汤浩茹,张义正.桃PGIP蛋白基因片段的克隆、序列分析及在大肠杆菌中的表达[J].中国农业科学,2008,41(10):3191-3199.
[9] Di Matteo A,Federici L,Mattei B,et al.The crystal structure ofpolygalacturonase-inhibiting protein (PGIP),a leucine-rich repeat proteininvolved in plant defense[J].Proceedings of the National Academy Sciences of the United States of America,2003,100(17):10124-10128.
[10]皇甫海燕,官春云.甘蓝型油菜抗菌核病近等基因系和感病亲本蛋白差异的初步研究[J].中国农业科学,2010,43(10):2000-2007.
[11]Jones DA,Jones IDG.The role of leucine-rich repeats in plant defences[J].Advances in Botanical Research,1997,24:89-167.
[12]Stotz HU, Bishop JG, Bergmann CW, et al.Identification of target amino acids that effect interactions of fungal polygalacturonases and their plant inhibitors[J].Physiological and Molecular Plant Pathology, 2000,56:117-130.
[13]Bostjan Kobe, Andrey VK.The leucine-rich repeat as a protein recognition motif [J].Curent Opinion in Structural Biology,2001,11:725-732.
[14]Federici L,Di Matteo A,Fernandez-Recio J,et al.Polygalacturonase inhibiting proteins:players in plant innate immunity [J] .Trends in Plant Science,2006,11(2):65-70.
[15]De Lorenzo G,D’Ovidio R,Cervone F.The role of polygalacturonase-inhibiting proteins (PGIPs)in defense against pathogenic fungi[J].Annual Review of Phytopathology,2001,39:313-335.
[16]Catherine L, Saradee WP.Giant catfish Pangasianodon gigas growth hormone-encoding cDNA cloning and sequence by one-sided polymerase chain reaction Gene[J].Scientia Agricultura Sinica,1994,149:271-276.
[17]Cervone F, Hahn MG,De Lorenzo G.Host-pathogen interaction ⅩⅩⅩⅢ. A plant protein convoerts a fungal pathogenesis factor into an elicitor of plant defense responses[J].Plant Physio,1989,90: 542-548.
Cloning,SequenceandStructureAnalysisofPolygalacturonaseInhibitingProteinGene(PGIP9)ofBrassicanapusXiangyou15andProkaryoticExpression
(1 Oilseed Crops Institute,Hunan Agricultural University, Changsha, Hunan 410128, China;2 National Center of Oil Seed Crops Improvement, Hunan Branch, Changsha, Hunan 410128, China)
Ribonucleotide and amino acid sequence of Xiangyou 15PGIPwere analyzed, the protein structure were predicted by biological information software. CDS of Xiangyou 15PGIP9 code area was 1 011 bp, which encoded 336 amino acid of open reading frame with a molecular mass of 37.5 kDa and isoelectric point of 7.9. 1~22 amino acids were predicted to the N-terminal signal peptide with stronger hydrophobic region. The deduced amino acids sequence contained 5 potential N-glycosylation sites and 4 cysteine residues on N-terminal and C-terminal respectively, which involved in constituting the disulfide linkages. Secondary structure displayed it contained 11 α-helices,14 β-extension and 25 random coils. The center LRR structural domain was composed of 6 tandem LRRs motifs. Later, CDS ofPGIP9 was subencoded into the prokaryotic expression vector pET-32a(+)constructing recombinant expression plasmid pET-32a-PGIP9 and was transformed intoEscherichiacoliBL21(DE3).The fusion protein pET-32a-PGIP9 was successfully expressed under final concentration 0.2 mmol/L and 0.5 mmol/L IPTG at 25℃ inducing for 2 h. The molecular weight of fusion protein was 52 kDa, it mainly appeared as inclusion bodies, not appeared as soluble protein.
Brassicanapus; PGIP9; Prokaryotic expression; Sequence analysis; Structure prediction
Q78
A
1001-5280(2012)02-0134-05
10.3969/j.issn.1001-5280.2012.02.07
责任编辑:刘目前

