微量胃黏膜IL-1βmRNA水平Real-time PCR检测方法的建立
李 娟,嘉红云,王忠英,周 强,王方金,何蕴韶,吴晓蔓
(1.广州医学院第二附属医院 检 验科,广东 广 州510260;2.中山大学达安基因诊断中心,广东 广 州510080)
IL-1β是胃肠道疾病发生发展的重要影响因素,可能在慢性胃炎-胃粘膜萎缩-不典型增生-胃癌这一发病模式中起了先导作用[1]。胃粘膜IL-1β的高水平表达可引起炎症程度的增加及胃酸分泌的减少,不加干预则有可能发展成萎缩性胃炎甚至胃癌;IL-1β低表达则与胃酸分泌过多相关,有可能引发十二指肠溃疡[2-3]。明确儿童时期胃粘膜IL-1β的表达量有利于进一步研究IL-1β在疾病发展过程及预后、转归中的作用。本研究将建立微量胃粘膜IL-1βmRNA 表达水平的 Real-time PCR 检测法,为IL-1β在胃肠道疾病发生发展过程中作用的研究提供有力工具。
1 材料与方法
1.1 材料 20例随机选取的有消化道症状患儿(≤14岁)的胃粘膜标本用来做本次研究。胃粘膜标本由达安基因诊断中心提供。
1.2 主要试剂与仪器 RNA核酸提取试剂盒(德国qiagen公司),Taq酶、Buffer,MgCl250 mmol/L(MBI Fermentas公司),p MD-18T 载体试剂盒(大连宝生物工程公司)。7500荧光定量PCR扩增仪(美国ABI公司)。
1.3 引物探针设计 在生物数据库GENEBANK中找到目的基因IL-1β及内参基因GAPDH的mRNA序列,运用生物软件Primer 5,Primer Expreess辅助设计引物探针,为避免基因组DNA序列的干扰,探针所在的位置均跨内含子,引物探针序列见表1。
1.4 cDNA的生成 用提取的总RNA做模板,使用随机引物经逆转录(Reverse transcript,RT)生成cDNA,逆转录反应体系见表2。
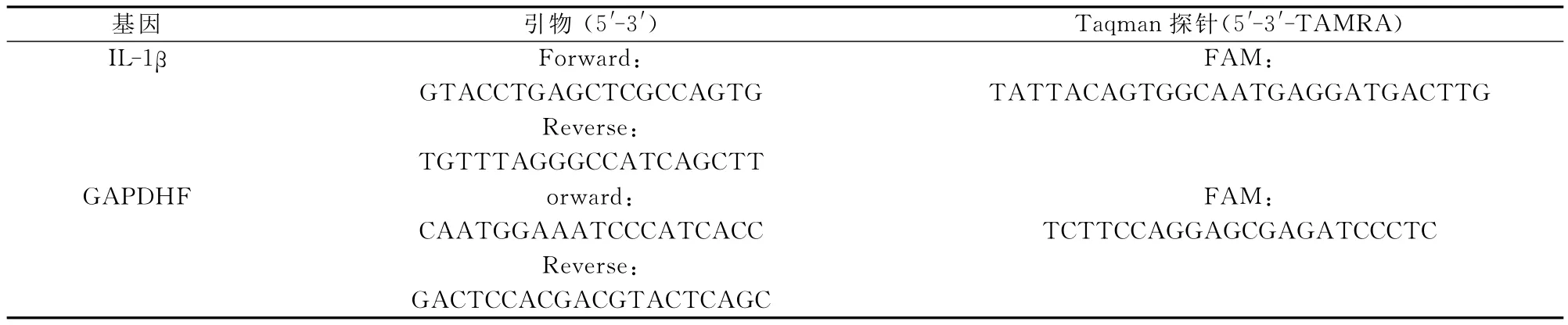
表1 引物探针序列

表2 逆转录反应体系组成
反应条件:37℃60 min,95℃5 min灭活逆转录酶。最后将c DNA置-20℃保存备用。
1.5 IL-1β、GAPDH real-time反应体系及条件 见表3。

表3 Real-time PCR 反应体系
反应条件:95℃3分钟预变性,然后95℃45秒,55℃1分钟,扩增10个循环,再95℃30秒,55℃45秒,扩增30个循环。反应在Applied Biosystems 7500上进行,由PCR仪7500附带的软件ddCT study自动分析IL-1β表达水平。
2 方法验证
2.1 引物特异性确证 IL-1β、GAPDH基因相应的PCR产物用p MD-18T载体试剂盒做克隆,菌液送交上海英骏生物技术公司测序,测序结果经BLAST比对确认了所设计引物的特异性扩增能力。
2.2 IL-1β、GAPDH反应体系扩增效率的检测 将克隆所得菌液按10倍浓度稀释,得到5个浓度梯度的IL-1β及GAPDH菌液(109~105拷贝/ul)。以稀释后的菌液为模板进行real-time PCR反应,取△CT值做回归分析:

回归曲线的斜率为0.0023,表明本实验所用IL-1β、GAPDH PCR反应体系的扩增效率一致,可以用GAPDH做内参来检测IL-1βmRNA的表达水平。可见不同模板浓度的对数值与CT值间有非常好的线性关系,标准曲线的回归系数均大于0.99(图略)。
2.3 胃粘膜标本IL-1β、GAPDH mRNA 的检测每份样本cDNA 的IL-1β、GAPDH real-time PCR扩增均做三个平行复孔,GAPDH及IL-1β的复孔检测均有较好的重现性。所有接受检查的20例儿童胃粘膜标本经分析都得到了IL-1βm RNA的相对表达值,见表4。
3 讨论
IL-1β是抑制胃酸分泌的强有力的前炎症因子[4],IL-1βmRNA 高表达,胃酸分泌减少,利于细菌定植,IL-1βm RNA表达增高可能是胃萎缩、胃癌发生的起始因素。IL-1βm RNA低表达,胃酸分泌增多,则会导致十二指肠溃疡的发生。由此可见IL-1βmRNA表达水平对胃肠道疾病的发生发展有着重要的影响。成人中研究发现无论是H.pylori的感染还是IL-1基因簇的多态性都一定程度的影响着IL-1β的表达[5-6],这些影响因素是否在儿童时期就发挥着显著的作用,尚不明确,需要进一步研究。在对儿童进行消化道内镜检测时,钳取的粘膜量较少,需要高灵敏度的检测方法来确定其胃粘膜IL-1β mRNA的表达量。Real-time PCR检测法的灵敏度高,特异性强[7-8]。因此,本研究着力于建立微量胃粘膜IL-1βm RNA 表达水平 Real-time PCR 检测法。检测原理如下[9]:
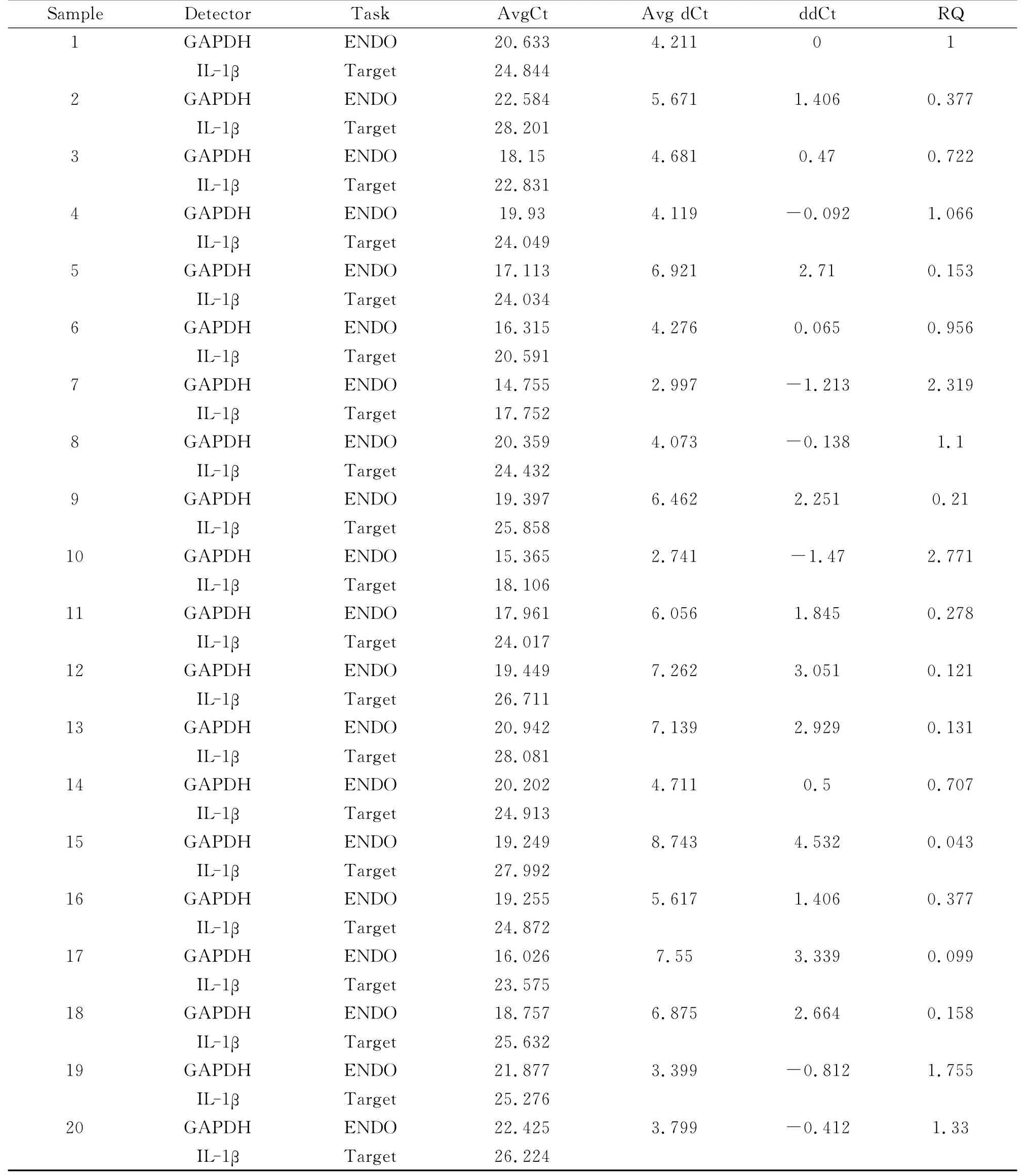
表4 胃粘膜IL-1βmRNA检测相关数值
dd CT即2-△△CT是一种检测目的基因表达水平的相对定量方法,多选取GAPDH 、β-actin等看家基因做内参,检测目的基因相对于看家基因的表达量,之后用标准品做校准就可以得到目的基因的相对定量值,继而可以比较不同样本或组别表达水平的差异。ddCT法的推导过程如下[9]:
用Xn表示第n个循环后的目的基因产物量,X0表示初始目的基因量,Ex表示目的基因的扩增效率,n表示循环数,则:Xn=X0×(1+EX)n。
用XT表示目的基因达到设定的阈值时的产物量,CTX表示目的基因扩增达到阈值时的循环数,则:XT=X0×(1+EX)CT,X=KX,Kx为一常数。XT表示目的基因达到设定的阈值时的产物量,CT,X表示目的基因扩增达到阈值时的循环数对内参基因R(endogenous reference),亦有同样的公式,即 RT=R0×(1+ER)CT,R=KR,KR为一常数。RT表示内参基因达到设定的阈值时的产物量,R0表示初始内参基因量,ER表示内参基因的扩增效率,CT,R表示内参基因扩增达到阈值时的循环数。
目的基因的产物量XT除以内参基因的产物量RT得
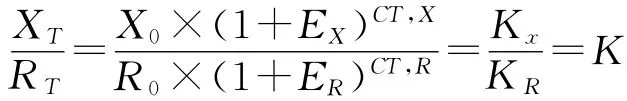
对于使用Taqman探针的实时扩增而言,XT和RT的值由一系列因素决定:包括探针所带的荧光报道基团、探针序列对探针荧光特性的影响、探针的水解效率和纯度以及荧光阈值的设定。因此常数K并不一定等于1。假设目的基因与内参基因的扩增效率相同,即=K或XN×(1+E)△CT=K,这里的 XN是就(X0/R0)标准化处理过的初始目标分子量;△CT表示目的基因和内参基因CT值的差异即CTX-CTR。整理得XN=K×(1+E)-△CT。
最后用标准品calibrator(cb)的XN校准任一样本q的 XN,XN,q除以 XN,cb得:
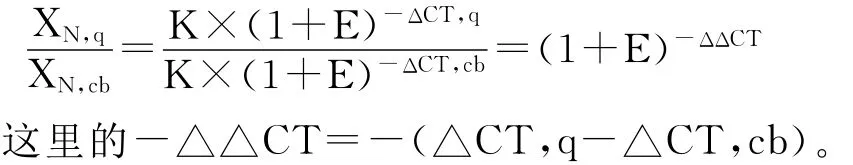
对于少于150 bp的扩增片断,如果Mg2+浓度、引物都进行了适当的优化,扩增效率接近于1。因此目的基因经内参及calibrator校准后的量即为
运用建立好的检测方法成功获得了20例儿童消化道内镜检测时钳取胃粘膜的IL-1βm RNA相对表达量。本次研究建立的微量胃粘膜IL-1βmRNA表达水平Real-time PCR检测法,将有助于进一步研究IL-1β在胃肠道疾病发生、发展过程中的作用,特别是在标本量少,IL-1β表达量低的情况下。
此外,IL-1β在个体对多种抗原的侵入反应中发挥作用,它可以提高个体对各种内源性及外源性刺激的免疫力。IL-1β的广谱生物学作用源自它所介导的许多其它基因的表达如:TNF-α,interferonα,β.γ,c-myc,c-jun,and c-fos[1],精确定量IL-1β表达还有助于研究它对相关基因的调节作用,本文所建立的方法对血液、体液等微量标本IL-1βmRNA表达水平的检测同样适用。
[1]El-Omar EM:The importance of interleukin 1beta in Helicobacter pylori associated disease[J].Gut,2001,48:743.
[2]Chang YW,Jang JY,Kim NH,et al.Interleukin-1B(IL-1B)polymorphisms and gastric mucosal levels of IL-1beta cytokine in Korean patients with gastric cancer[J].Int J Cancer,2005:114:465.
[3]Chakravorty M,Datta De D,Choudhury A,et al.IL1B promoter polymorphism regulates the expression of gastric acid stimulating hormone gastrin[J].Int J Biochem Cell Biol,2009,41:1502.
[4]Kuipers EJ,Lundell L,Klinkenberg-Knol EC,et al.Meuwissen SG:Atrophic gastritis and Helicobacter pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication[J].N Engl J Med,1996,334:1018.
[5]Gatti LL,Burbano RR,de Assumpcao PP,et al.Interleukin-1beta polymorphisms,Helicobacter pylori infection in individuals from Northern Brazil with gastric adenocarcinoma[J].Clin Exp Med,2004,4:93.
[6]Yamaoka Y,Kodama T,Kita M,et al.Relation between clinical presentation,Helicobacter pylori density,interleukin 1beta and 8 production,and cag A status[J].Gut,1999,45:804.
[7]Valasek MA,Repa JJ.The power of real-time PCR[J].Adv Physiol Educ,2005,29:151.
[8]Costa J:[Real-time PCR].Enferm Infecc Microbiol Clin,2004,22:299-304;quiz 305.
[9]Livak KJ,Schmittgen TD:Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25:402.

