P27蛋白及DNA倍体不同表达与结肠癌临床病理学特征的关系
杨志平,杨文颖,盛 望,郭玉琳,李千迅,杨 卓
(1.北京工业大学生命科学与生物工程学院 北 京 北 京100124;2.北华大学附属医院消化科,吉林 吉 林132011;3.吉林省人民医院,吉林 长 春130021)
结肠癌是高发恶性肿瘤,发病率有逐年上升的趋势,且预后较差其主要原因是肿瘤的复发与转移。由于对肿瘤增殖动力学及细胞周期调控认识的深入,希望从细胞分子生物学水平尽早发现癌变,以达早期治疗目的。p27表达蛋白是一种细胞周期的负性调节物,通过影响细胞周期素与cyclin-CDK复合物结合,控制细胞由G1期进入S期的“位点”,从而抑制细胞增殖[1]。目前关于结肠癌DNA倍体类型与临床病理学特征间的关系尚无定论;而不同分期的消化道肿瘤生物学及临床特征亦不相同。我们应用流式细胞术测定结肠癌、直肠癌患者肿瘤细胞的DNA含量,探讨DNA倍体分析对结肠癌临床病理学特征的关系,同时应用免疫组织化学SP法对结肠癌组织中p27表达及与肿瘤临床病理学特征的关系进行了分析。
1 材料与方法
1.1 一般资料
北华大学附属医院及吉林省人民医院(2007年5月-2011年4月)结肠癌手术切除标本130例,患者年龄33-88岁,平均年龄56.5岁;男87例,女43例,男:女≈2:1。TNM分期:Ⅰ、Ⅱ期66例,Ⅲ、Ⅳ期64例;中、高分化70例,低分化60例,均经病理学诊断。手术前未行任何抗肿瘤治疗。
1.2 实验方法
1.2.1 仪器及试剂 抗p27鼠抗人单克隆抗体、SP试剂盒,DAB显色试剂盒(购自福建迈新生化技术开发公司);EPICS-XL型流式细胞仪(美国BECKMAN-COULTER公司);DNA 倍体分析试剂成套产品,PI荧光染料(COULTER公司)。
1.2.2 切片制备 所有标本常规取材,福马林固定,石蜡包埋,4μm厚连续切片,用于免疫组织化学染色。
1.2.3 P27蛋白检测 采用免疫组织化学SP法。以高压枸椽酸盐行抗原修复,DAB显色,胞核、胞浆染为棕色者为阳性细胞。400倍显微镜下每张载玻片计数5个视野,每个视野100个细胞,取阳性细胞数百分比的平均值,<50%为低表达,≥50%为高表达。
1.2.4 DNA倍体分析 将留取肿瘤标本,放入4℃生理盐水中,部分常规病理检查,部分进行DNA倍体分析。DNA倍体分析方法如下:去除脂肪组织及血块,用眼科剪剪成肉糜状,加入生理盐水,吹散团块呈悬液,180目滤网过滤,再用300目滤膜过滤,800~1 000 r/min离心10 min,去上清,加入PBS混匀,在显微镜下计数细胞,使细胞浓度为(3×105)~(3×106)ml-1,再加适量PI染液5~10 min,上机测定。在直方图上,只有单个G0/G1期单峰的为DNA二倍体,而有2个或者2个以上G0/G1期峰的为DNA异倍体。(DI指数在0.9~1.1为二倍体,其余为异倍体),正常S期细胞比率<15%。
1.2.5 统计学处理方法 计数资料作χ2检验,P<0.05,差异有显著性。
2 结果
2.1 P27蛋白在结肠癌及癌旁组织中的表达
结肠癌不同部位组织内P27高表达率不同,癌灶处P27高表达率最低,离癌灶越远,P27表达越高。有显著性差异(P<0.05)。见表1。
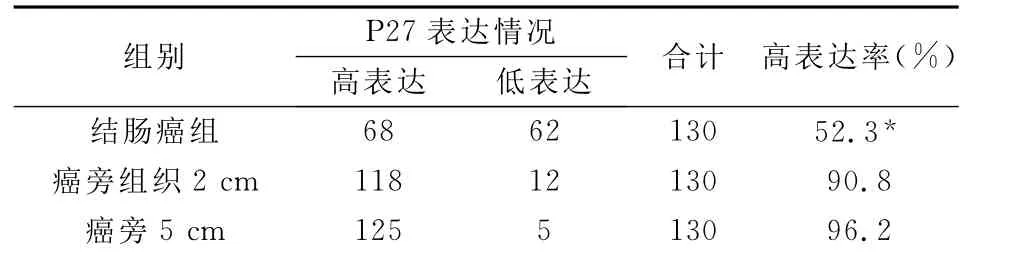
表1 p27在结肠癌及结肠癌旁组织中的表达
2.2 DNA倍体在结肠癌及癌旁组织中的表达
结肠癌组织DNA异倍体与癌旁组织2 cm以内及2 cm-5 cm中的DNA异倍率比较,有显著性差异(P<0.05)。离癌灶越远,异倍体DNA表达越低。见表2。

表2 DNA倍体在结肠癌及结肠癌旁组织中的表达
2.3 P27蛋白及DNA倍体不同表达与结肠癌临床病理学特征之间的关系
由表3可见,结肠癌组织中p27表达水平与结肠癌的恶性程度、TNM分期相关(P<0.05),恶性程度越高、TNM分期越晚,p27的表达水平越低。
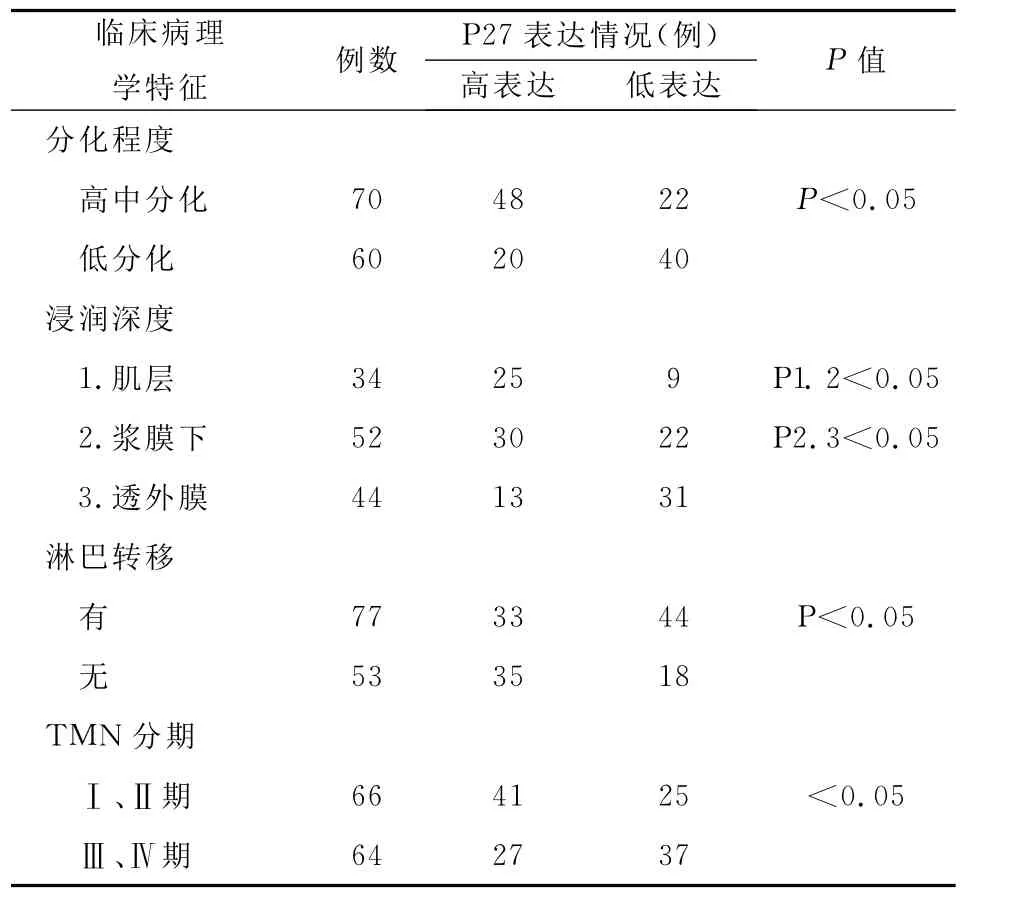
表3 p27表达与结肠癌临床病理学特征的关系
2.4 DNA异倍体率与肿瘤临床病理学特征之间的关系
由表4可见,通过统计学分析,DNA倍体类型与肿瘤的分化程度、浸润深度、淋巴转移、TNM分期无明显的关系(P>0.05)。但是我们发现随着浸润深度增加、淋巴结转移、TNM分期增加及分化越差,异倍体比率呈增高趋势。
2.5 结肠癌P27蛋白的表达与DNA倍体的关系
由表5可见,P27的表达的降低会导致DNA的多倍体化,r=0.468(P<0.05)。

表4 DNA异倍体率与肿瘤临床病理学特征关系

表5 结肠癌P27蛋白的表达与DNA倍体的关系
3 讨论
p27是国外学者研究较多的一种预后因子,是Polyak等[2]于1994年发现并克隆的参与细胞周期调控的抑癌基因,定位于人染色体12p。其异常表达活性的改变会影响细胞周期进程[3]。进而影响细胞增殖,其与肿瘤发生、发展密切相关。p27蛋白是p27基因的产物,p27蛋白在转录后水平以化学剂量方式与cyclin-CDK复合物结合,阻止细胞增殖,从而使细胞周期停止在G1期。p27蛋白水平低下或缺失,可导致细胞过度增殖,引起肿瘤发生。近年国内外研究发现[3-5],在多种消化系肿瘤中,P27Kip蛋白的异常表达与肿瘤的进展和不良预后密切相关.本研究结果显示:结肠癌不同部位组织内P27蛋白高表达率不同,癌灶处P27蛋白高表达率最低,离癌灶越远,P27蛋白表达越高。目前,在大肠癌中p27蛋白与肿瘤分化关系的报道不一致。本组资料显示,p27蛋白与肿瘤恶性程度相关,高分化大肠癌中,p27蛋白高表达比例高,低分化大肠癌中,p27蛋白高表达比例低,两组有显著性差异;p27蛋白与TNM分期相关,TNM分期越晚,p27蛋白的表达水平越低。这说明p27影响大肠癌分化途径,促进大肠癌恶性演进,p27的低表达可作为肿瘤恶性程度高的一个指标。我们的结果与Kim等[6]的观点基本一致。
用流式细胞仪能够测定肿瘤细胞的很多参数,分析大量细胞的细胞周期和DNA倍体已经广泛应用于肿瘤基础和临床研究中。人体正常的体细胞均具有较恒定的DNA二倍体含量,细胞癌变过程中常伴随细胞DNA含量的改变,如果DNA含量发生微小的异常变化,就有可能导致恶性肿瘤。DNA非整倍体细胞是恶性肿瘤的特异性标志之一[7]。从流式细胞仪DNA周期分析可进一步判断细胞的DNA倍体水平,DNA含量分析对结直肠癌患者的预后判断已有相关报道,虽然其预后价值尚不能肯定,但多数研究者认为DNA二倍体肿瘤患者较异倍体患者有较好的生存期[8,9]。也有学者认为DNA倍体与大肠癌Dukes.分期无关[10],与淋巴转移无关[11],与组织学类型无关[12]。本研究结果表明:DNA倍体类型与肿瘤的分化程度、浸润深度、淋巴转移、TNM分期无明显的关系;但是发现随着浸润深度增加、淋巴结转移、TNM分期增加及分化越差,异倍体比率呈增高趋势。因此,测定细胞核DNA含量与倍体分析可以了解细胞增殖状态,从而判断细胞有无恶变倾向或恶性程度,其对恶性肿瘤的早期诊断具有重要价值。同时,P27蛋白表达的降低会导致DNA的多倍体化,两者呈负相关关系。
综上,本研究认为,p27蛋白低表达是促进大肠癌恶性演进的因素;P27蛋白的免疫组化检测结合DNA倍体分析有助于反映结肠癌发生、发展、生物学行为和预后,两者可以作为结肠癌临床分期和预后的监测指标之一。
[1]Fearon E R,Vogelstein B.A genetic model for colorectal tumorigenesis[J].Cell,1990,61:759.
[2]Laken S J,Petersen G M,Gruber S B,et al.Familial colorectal cancer in Ashkenazim due to a hypermutable tract in APC[J].Nat Genet,1997,17:79.
[3]Xuan YH,Choi YL,Shin YK,Kook MC,Chae SW,Park SM,Chae HB,Kim SH.An immunohistochemical study of the expression of cell-cycleregulated proteins p53,cyclin D1,RB,p27,Ki67 and MSH2 in gallbladder carcinoma and its precursor lesions.Histol Histopathol,2005,20:59.
[4]张广建,寇有为,王 强.胃癌组织中P27表达与cyclinD1、cyclin E表达的相关性[J].世界华人消化杂志,2007,15:3809.
[5]Polyak K,Lee MH,Erdjument-Bromage H,Koff A,Roberts JM,Tempst P,MassaguéJ.Cloning of p27Kip1,a cyclin-dependent kinase inhibitor and a potential mediator of extracellμlar antimitogenic signals[J].Cell,1994,78:59.
[6]Kim DH,Lee HI,Nam ES,et al.Reduced expression of the cellcycle inhibitor p27 is assosicat ed with progression and lymph node metastasis carcinoma[J].Histopathology,2000,36(3):245.
[7]Danesi DT,Spano M,Fabiano A,et al.Flow cytometric DNA ploidy,p53,PCNA,and c-erbB-2 protein expressions as predictors of survival in surgically resected gastric cancerpatients[J].Cytometry,2000,42(1):27.
[8]Chapman MAS,Hardcostle JD,Armitage NCM,et al.Five-year prospective study of DNA tumor ploidy and colorectal cancer survival[J].Cancer,1995,76:383.
[9]Witzig TE,Loprinzi CL,Gonchoroff NJ,et al.DNA ploidy and survival in stages B2 and C colorectal adenocaicinoma[J].Cancer,1991,68:879.
[10]Emdin SD,Stenling R,Roos G.Prognostic value of DNA contentin colorectal carcinoma[J].Cancer,1987,60:1282.
[11]左连富.流式细胞学与生物医学[M].沈阳:辽宁科学技术出版社,1996.199-239.
[12]Brunns S.Flow cy tometric DNA ploidy in colo rectal adenomas and family history of color ectal[J].Cancer,1988,61:114.

