大肠癌原发灶及粪便标本中基因mRNA表达及其临床意义
赵金伟,李 韬,马 震,董 强,王钟林*
(1.吉林省人民医院 急 诊外科;2.吉林大学白求恩医学院09级,吉林 长 春130021)
几项有关粪便基因mRNA检测技术在结直肠癌诊断中的研究报告表明,采用RT-PCR技术检测结直肠癌病人粪便基因的异常表达对结直肠癌诊断率较高,但关于CD44、COX-2、CK-20m RNA在病灶及粪便中表达是否具有同源性,能否作为CRC的诊断标记物有待于研究。
本实验的目的是通过对COX-2,CK-20,CD44v6m RNA在结直肠原发灶及病人粪便中的表达,证实粪便中COX-2,CK-20,CD44v6mRNA表达来源于原发灶肿瘤细胞的脱落所致,为临床结直肠癌筛查选择合适的多基因标记物联合检测指标。
1 材料与方法
1.1 材料
1.1.1 临床资料 收集吉林省人民医院及吉林省肿瘤医院2008年1月-2010年2月行结直肠癌根治术的结直肠癌原发灶38例,所有患者术前均未行抗肿瘤治疗,其中,男性20例,女性18例,年龄42-81岁,平均年龄62岁,Duke's A、B期13例,Duke's C、D期25例。分化程度:高中分化15例,未、低分化23例。患者术前2-3天在医生指导下用带盖粪便标本盒收集粪便标本,在2小时内送于实验室,分装后-80℃保存,对术中切除的病变标本切取一部分置于标本盒内,置于-80℃冰箱中保存备用。粪便标本均为服药前或灌肠前留取标本。
1.1.2 粪便标本的预处理 粪便标本解冻后,取成形粪便标本3-5克或水样便100毫升加入100毫升液基细胞保存液100毫升搅拌均匀后,依次经过100目筛网,200目筛网,1200转/分(rpm)离心10min后弃去上清液,加提取液重悬沉淀至50毫升,过300目筛网,1200转/分(rpm)离心10min后弃去上清液,取沉淀加入液基细胞保存液1.5毫升置于1.5ml Eppendorf管中,上述标本处理1小时完成,并置于-80℃冰箱中保存。
1.2 PT-PCR法检测结直肠癌原发灶及粪便标本中基因mRNA表达
1.2.1 总RNA的提取 用DEPC严格处理实验器材以防止RNA酶污染。解冻组织标本或粪便预处理后的标本,研磨后加入PBS洗涤,1000 rpm,5分钟,弃上清 →加1ml Trizol,室温放置5分钟,转到EP管加0.2 ml氯仿重悬沉淀,剧烈振摇,室温静置5 min→4℃12000 rpm,离心15 min→上层水相移至另一EP管(宁少勿多)→加入0.5 ml冰异丙醇→充分混匀,室温放置10 min→4℃12 000 rpm,离心15 min,去上清→加入75%冰乙醇-DEPC1 ml,振摇洗涤沉淀→4℃12000 rpm,离心10 min,弃上清→去乙醇,空气中干燥RNA→加DEPC水(10-50μl),溶解RNA→所得的总RNA置于-80℃冰箱保存。
1.2.2 RNA纯度及完整性检测 取RNA样品用紫外-可见光分光光度计于260 nm、280 nm处测定A值,计算RNA浓度和RNA定量。取RNA样品进行甲醛变性,1%琼脂糖凝胶电泳,拍照,用光密度扫描仪扫描28s和18s条带,计算密度比值。
1.2.3 引物设计[1-3]实验所需引物及内参照βactin引物均系上海生工生物工程公司合成,经Genebank检索为特异性引物。DNA Marker采用宝生物工程有限公司DL2000 Marker。
1.2.4 RT-PCR技术检测COX-2,CK-20,CD44v6 m RNA表达
①逆转录
RNA 4μl+Oligod T 2μl+DEPC 10μl—72℃,5分钟,变性模板RNA—迅速放置冰上,复性模板RNA—5×buffer 5μl+10 m Md NTP 2μl+25u/μl Rnasin 1μl+200 u/μl mmlv 1μl—42℃,1 h—94℃,5 min—冰上,5 min,置-80℃储存。
②聚合酶链式反应
反应体系:灭菌去离子水32μl;10×PCR buffer 5μl;10 mmol/Ld NTP 1μl;10pmol上游引物1 μl;10pmol下游引物1μl;cDNA(0.1 ug/μl)1μl。
③Taq DNA 聚合酶(2u/μl)0.2μl增条件
β-actin:取cDNA 2μl,加入10×Bufer 2μl,25 mmol/L氯化镁溶液 1.2μl,Taq 酶 1 U,22.5 mmol/L d NTPs 0.16μl,β-actin引物0.1μg,加去离子水至20μl进行PCP扩增。每次设一管不加样品cDNA为阴性对照。反应条件为94℃预变性5 min,94℃变性30s,56℃退火30 s,72℃延伸30 s,共30循环,72℃延长7 min。基因扩增产物经2%琼脂糖凝胶(含0.1%溴化乙啶)电泳,拍照。
目的基因:逆转录产物2μl,加入10×PCR Bufer 3μl,目的基因引物20 pmol,β-actin引物4 pmol,Taq DNA酶1 U,DEPC处理过的水至30μl。反应条件为95℃预变性2 min,95℃变性1 min,60℃退火1 min,72℃延伸1 min,共45循环。基因扩增产物经2%琼脂糖凝胶(含0.1%溴化乙啶)电泳,拍照。
1.2.5 结果判定 图片中出现305 bp、370 bp、125 bp的条带分别为COX-2、CK-20及 CD44v6 mRNA表达阳性。
1.3 统计学处理
采用χ2检验,应用统计软件SPSS10.0处理,P<0.05为具有显著性差异。
2 结果
2.1 COX-2mRNA在结直肠癌原发灶及粪便标本中的表达
COX-2mRNA在癌原发灶及粪便标本中均可表达,在癌原发灶组织中COX-2m RNA表达的阳性率为57.9%(22/38);COX-2mRNA 在癌患者粪便中表达的阳性率为47.4%(18/38);COX-2mRNA在癌原发灶及粪便中同时阳性表达率为44.7%(17/38),同时阴性表达率为39.5%(15/38),同源性为84.2%(32/38);同源性与异源性相比,差异具有显著性,p=1.5×10-5。如表1所示。

表1 COX-2mRNA在结肠癌原发灶及粪便标本中的表达
2.2 CK-20mRNA在结直肠癌原发灶及粪便标本中的表达 CK-20mRNA在结直肠癌原发灶及粪便标本中均可阳性表达,在结直肠癌原发灶组织中CK-20mRNA表达的阳性率为52.6%(20/38);CK-20m RNA在粪便标本中的阳性表达率为55.3%(21/38);CK-20mRNA在结直肠癌原发灶及粪便中同时阳性表达率为44.7(17/38);36.8%(14/38)同时无表达,同源性为81.5%(31/38),同源性与异源性相比,差异具有显著性,P=0.0001。如表2所示。
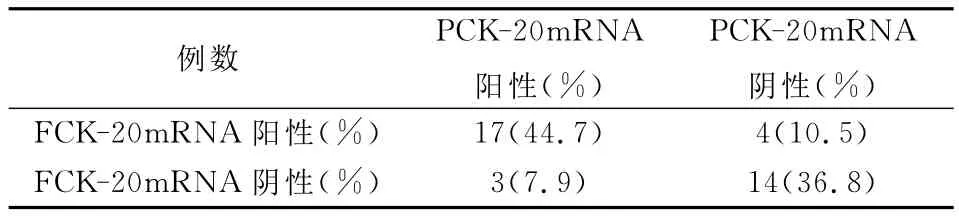
表2 CK-20mRNA在结直肠癌原发灶及粪便标本中的同源性表达
2.3 CD44v6mRNA在结直肠癌原发灶及粪便标本中的表达 CD44v6m RNA在结直肠癌原发灶及粪便标本中均有较高的阳性表达,在结直肠癌原发灶组织中CD44v6m RNA表达的阳性率为55.3%(21/38);CD44v6mRNA在粪便标本中的表达阳性率为50.0%(19/38);CD44v6mRNA 在结直肠癌原发灶及粪便标本中同时阳性表达率为50(19/38);44.7%(17/38)同时无表达,同源性为94.7%(36/38),同源性与异源性相比,差异具有显著性,P=1.8×10-8。如表3。

表3 CD44v6mRNA在结直肠癌原发灶及粪便标本中的同源性表达
3 讨论
结直肠癌(CRC)是消化道常见的恶性肿瘤,对CRC的研究表明,CRC的癌变机制和筛选方法是目前消化道肿瘤中最为明确和完善的,在易感人群中进行筛查是CRC的主要防治策略之一,业已证实,CRC筛查可以明显减少CRC的发生,并且,早期诊断及治疗可明显提高患者的生存率。对于结直肠癌病人的筛查,未来的热点是在非肠道准备下易被患者接受的检查[4]。粪便基因检测法是检测患者粪便基因的改变,无侵袭性、无需特殊准备、且可检查整个大肠病变,是目前无创性筛查大肠肿瘤病变的研究热点。
目前,粪便基因mRNA标记物的研究刚刚起步,日本学者对粪便COX-2mRNA检测分析发现,COX-2m RNA表达对结肠癌诊断的敏感性和特异性分别为90%,100%。但 Wai K等[1]研究显示,COX-2m RNA表达在结直肠癌中的阳性率仅为50%,腺瘤仅为4%,因此,粪便基因mRNA表达大肠癌诊断有待于进一步研究,联合检测粪便多个基因m RNA表达是否能够用于大肠癌的筛查也有待于进一步研究。目前尚未见有关文献报道结直肠癌患者粪便相关基因m RNA表达与结直肠癌原发灶肿瘤的相关性,二部位基因mRNA表达是否具有同源性等有待于进一步证实,本实验采RT-PCR技术对38例结直肠癌患者的原发灶及粪便标本中的COX-2,CK-20及 CD44v6mRNA 表达进行检测,结果发现,COX-2,CK-20及 CD44V6m RNA 均可表达于肿瘤原发灶及患者粪便标本中,COX-2mRNA在结直肠癌原发灶及粪便标本中同时阳性表达率为44.7%(17/38),同时阴性表达率为 39.5%(15/38),同源性表达率为84.2%(32/38),与异源性表达相比,差异具有显著性,P=1.5×10-5,结果提示,结直肠癌粪便患者标本COX-2m RNA表达与结直肠癌原发灶COX-2mRNA表达密切相关,粪便标本COX-2m RNA表达主要来源于结直肠癌原发灶脱落细胞的COX-2mRNA,因此,检测粪便标本COX-2m RNA表达可以替代原发灶COX-2mRNA表达,作为结直肠癌的一种无创性的粪便基因标记物。Yamauchi等[5]的研究发现,COX-2在正常大肠上皮细胞中几乎完全不表达,在腺瘤中表达有所增加,而在大肠癌组织中高表达,提示COX-2的高表达可能参与了大肠癌的发生。因粪便标本COX-2m RNA在结直肠癌中的阳性率仅为47.4%(18/38),为提高粪便标本基因m RNA表达检测诊断结直肠癌的检出率,本实验对粪便标本 CK-20,CD44v6m RNA表达进行了同样的研究,CK-20m RNA在结直肠癌原发灶及粪便标本中均可阳性表达,在原发灶中的阳性率为52.6%(20/38),在粪便 标 本 中 的 表 达 率 为 55.3% (21/38),CK-20m RNA在结直肠癌原发灶及粪便标本中同时阳性表达率为44.7%(17/38),36.8%(14/38)同时无表达,同源性为81.5%(31/38),同源表达率与异源性相比,差异具有显著性,P=0.0001。结果提示,结直肠癌患者粪便标本CK-20m RNA表达与结直肠癌原发灶CK-20mRNA表达密切相关,粪便标本CK-20m RNA表达来源于结直肠癌脱落细胞的CK-20m RNA表达,因此,检测粪便标本CK-20mRNA表达可以替代原发灶CK-20mRNA表达,作为结直肠癌的无创性基因标记物。既往研究表明,CK-20不同于其它的角蛋白,非常局限于胃肠上皮细胞,几乎所有的结直肠癌均明显表达,且在侵袭,转移,扩散到其它组织时始终保持稳定。但Stefan Wildi等[6]的研究认为,对41例结直肠癌采用Northern杂交技术,免疫组化及原位杂交技术检测CK-20表达,发现病灶CK-20表达不及正常对照组强,为此,本实验采用RT-PCR技术检测结直肠癌原发灶及癌旁正常粘膜组织的CK-20mRNA表达,发现癌灶CK-20mRNA表达呈强阳性,而正常粘膜组织呈弱阳性或阴性,与Stefan Wildi的实验结果不符,有待于进一步实验研究。采用 RT-PCR技术对CD44v6m RNA表达进行检测分析,发现CD44v6mRNA在结直肠癌原发灶及粪便标本中均有较高的阳性表达,CD44v6 m RNA在结直肠癌原发灶中的阳性表达率为55.3%(21/38),在粪便标本中的阳性表达率为50%(19/38),在原发灶及粪便标本中同时阳性表达率为50%(19/38),44.7%(17/38)同时无表达,同源性为94.7%(36/38),同源性与异源性相比,差异具有显著性,P=1.8×10-8,结果提示,结直肠癌患者粪便标本CD44v6mRNA表达与结直肠癌原发灶CD44v6m RNA表达密切相关,粪便标本CD44v6mRNA表达来源于原发灶脱落细胞的CD44v6m RNA。Wong等[7]报道,结直肠癌组织及转移组织内都有CD44变异的过度表达,而在正常的结直肠细胞内未见CD44v6表达[8]。Yamao等[9]采用RT-PCR和Southern blot技术检测粪便脱落细胞,在所有正常及结直肠癌病例中均检测到CD44s,而CD44v6和CD44v10在结肠癌术前阳性率分别为68%和60%,术后阳性率明显下降,分别为12%和28%,CD44v6分子的表达在术后转阴率为88.2%,CD44v10的转阴率为 80%,并且CD44v6和CD44v10均可在Dukes A期患者术前粪便中检出。Tatin[10]采用同样的手段检测体液,瘘液,粪便及尿液中CD44基因时,发现它们具有同样的敏感性。
本研究表明,CD44、COX-2、CK-20m RNA 在结直肠癌病人原发灶及粪便中表达具有较高的同源性,通 过 检 测 粪 便 标 本 中 CD44、COX-2、CK-20m RNA表达替代检测原发灶中CD44、COX-2、CK-20m RNA表达用于肿瘤的诊断、预后等,但能否作为CRC的诊断标记物有待于研究。
[1]Wai K,Leung,Ka Fai To,Ellen PS,et al.Detection of hypermethylated DNA or cyclooxygenase-2 messenger RNA in fecal samples of patients with colorectal cancer or polyps[J].Am J Gastroenteral,2007,102:1070.
[2]卢培琳,季 峰,彭克荣,等.胃癌患者CD44mRNA 的表达[J].浙江医学,2004,26(3):184.
[3]Stephen A,Bustin,Shabab S,et al.Quantification of cytokeratin 20,carcinoembryonic antigen and guanylyl cyclase C mRNA levels in lymph nodes may not predict rreatment failure in colorectal cancer patients[J].Int J Cancer,2004,108:412.
[4]Pickhardt PJ,Choi JR,Hwang I,et al.Computed tumorgraphic colongrapy to screen for colorectal neoplasia in asymptomatic adults[J].N Engl J Med,2003,349:2191.
[5]Yamauchi T,Wayanake M,Rubtoa T,et al.Cyclooxygenase-2 expre ssion as a new marker for patients with colorectal cancer[J].Dis Colon Rectum,2002,45:98.
[6]Stefan Wildi,Jorg KL,Haruhisa MA,et al.Charcterization of cytokeratin 20 expression in pancreatic and colorectal cancer[J].Cancer Res,1999,5:2840.
[7]Wong CSC,Cheung MT,Ma BBY,et al.Isolated tumor cells and circulating CK20 mRNA in p No colorectal cancer patients[J].Int J Surg Pathol,2008,16(2):119.
[8]Ishida T.Immunohistochemical expression of the CD44 variant 6 in colorectal adeno-carcinoma[J].Surg Today,2000,30(1):28.
[9]Yamao T,Matsumura Y,Shimada Y,et al.Abnormal expression of CD 44 variants in the exfoliated cells in the feces of patients with colorectal caner[J].Gastroenterology,1998,114(6):1196.
[10]Tarin D,Matsumura Y.Deranged activity of the CD44 gene and other loci as biomarkers for progression to metastatic malignancy[J].J Cell Biochem Suppl,1993,17(1):173.

