肿瘤抗原致敏树突状细胞干预BALB/c雌性小鼠膀胱癌的研究
邱 实,田洪阳,何 龙,刘 龙*
(1.沈阳军区总医院 泌 尿外科,辽宁 沈 阳110840;2.辽宁医学院,辽宁 锦 州121000)
膀胱癌是最常见的泌尿系恶性肿瘤之一,近些年来其发病率呈逐年上升趋势。在临床上约有75% ~85%的膀胱肿瘤属于浅表性的恶性肿瘤,而其中90%的膀胱肿瘤病理结果是膀胱移行细胞癌,手术切除后复发率也较高。树突状细胞(dendritic cell,DCs)为机体内活性功能最强、且唯一能够活化静息状态下的T淋巴细胞的抗原递呈细胞[1]。近年来,随着DC细胞在体外诱导扩增技术的逐渐发展,以及生物学分子技术逐渐应用于DC瘤苗构建方法的发现,DC瘤苗非常有希望成为免疫治疗恶性肿瘤有效方式之一。在本次实验中,我们构建BALB/c雌性小鼠膀胱癌动物模型,在体外利用BALB/c雌性小鼠双后肢胫骨和股骨的骨髓分离培养和鉴定树突状细胞以及制备DC疫苗的方法,并在BALB/c雌性小鼠观察了DC疫苗治疗小鼠膀胱癌的疗效,希望能为膀胱癌的免疫治疗提供有力的理论学依据。
1 材料与方法
1.1 主要材料
小鼠T24膀胱癌细胞株,由本实验室常规传代培养,BALB/c雌性小鼠,育龄6~8周,体重在18~22 g之间,购自重庆医科大学动物实验中心,为二级清洁动物。用含10% 胎牛血清的RPMI-1640培养液,在5%CO2、37℃条件下常规传代培养。人重组粒-巨噬细胞集落刺激因子(rhGM-CSF)、人重组肿瘤坏死因子-a(rh TNF-a)和人重组白细胞介素-4(rhIL-4)购买于Peprotech公司。
1.2 主要实验方法
1.2.1 T24膀胱癌抗原裂解物的制备:取对数生长期T24膀胱癌细胞株离心后42℃温浴1 h,反复冻融,离心后取上清,-80℃冰箱保存备用。
1.2.2 构建BALB/c雌性小鼠膀胱癌动物模型:随机取BALB/c雌性小鼠10只,从含有5×105T24膀胱癌细胞株的l ml RPMI-1640培养基中抽取0.2 ml(即1×105)T24膀胱癌细胞),注射在BALB/c雌性小鼠的左侧后肢腹股沟皮下的部位。1周后在BALB/c雌性小鼠注射部位的皮下便可以触及肿瘤样结节,在2周后,皮下肿瘤的直径可生长至1 cm左右。在本实验中,此方法有致瘤成功率80%。
1.2.3 DC扩增培养以及肿瘤抗原致敏DC鉴定方法 在本实验中,DC提取方法主要参照inaba方法[2],并在此方法的基础上稍做改进,详细过程如下:在无菌条件下,小心游离并提取BALB/c雌性小鼠的双侧后肢股骨和胫骨,冲洗骨髓腔后,将骨髓组织冲碎并溶于0.9%Nacl中,离心,弃上清,加入10 ml无菌水,低渗迫使红细胞裂解,10 s后加入10%高渗生理盐水l ml恢复其渗透压,离心,过滤,记数。0.9%Nacl洗涤2遍,培养基重悬,使细胞密度达到1.5×106/ml,后再加入rm GM-CSF(5 ng/ml)和rmIL-4(3.3 ng/ml),l ml/孔,铺在24孔板上,后置于CO2培养箱,并在第3天及时更换培养基,补充细胞因子,然后按培养细胞与肿瘤细胞比例为1:5向RPMI-1640培养液中加入肿瘤抗原裂解物,继续培养16 h,第4天轻轻吹吸下豁附于板底的聚集体,收集备用。取部分收集细胞送鉴定。采用流式细胞仪检测PE标记的鼠抗人HLA-DR、CD83、CD1a、CD80、CD86抗体;采用自体混合淋巴细胞反应(MLR)检测DCs对T淋巴细胞的促增殖能力。
1.2.4 DC体内抑制肿瘤效果检验实验第1天,在各组BALB/c雌性小鼠右后肢皮下接种处于对数生长期的T24膀胱癌细胞1×105个。致瘤成功后,选50只BALB/c雌性小鼠并随机分成五组,第一组:空白对照组;第二组:肿瘤抗原组;第三组:未成熟DC组,第四组:单点注射成熟DC组,第五组:多点多次注射成熟DC组,实验动物为每组10只。第12天,在第一至第四组BALB/c雌性小鼠皮下分别注射生理盐水,肿瘤抗原裂解物,未经抗原致敏DC和肿瘤抗原致敏成熟DC,DC注射剂量为1×106/只。然后在BALB/c雌性小鼠荷瘤第14天强化注射一次,注射剂量与上述相同。第12天,在第五组BALB/c雌性小鼠双侧腋窝及腹股沟皮下注射肿瘤抗原致敏成熟DC,2.5×105/部位(总量仍是1×106/只),后在BALB/c雌性小鼠荷瘤分别于第14天,第16天和第18天分别强化注射一次,注射剂量及部位与上述相同。当在BALB/c雌性小鼠皮下部位肿瘤可以触及后,用卡尺测量肿瘤的横径和纵径,用公式1/6πab2估算肿瘤的体积(a为长轴纵径,b为短轴横径)。后在BALB/c雌性小鼠荷瘤第24天后,采用脱颈法处死BALB/c雌性小鼠,小心完整剥离肿瘤组织,在微量天平称重。
1.3 统计学分析
使用SPSS 10.0统计软件,不同试验组间两两比较采用单因素方差分析。
2 结果
2.1 DC体外培养与鉴定
DC体外培养第4天,成熟的树突状细胞大小为15~20μm,胞体形态变得不规则,细胞表面有树突样突起。用流式细胞仪分析检测显示,在收获的成熟DC中,CD11+DC约为65%,CD80+为80%,CD86+为85%,与以前文献报道结果相似[3]。
2.2 免疫干预效果
2.2.1 肿瘤体积的测量方法 当BALB/c雌性小鼠荷瘤到第24天的时候,空白对照组(单纯注射生理盐水)肿瘤的体积为:(1.123±0.423)cm2;注射肿瘤抗原裂解物组肿瘤的体积为:(0.968±0.542)cm2;注射未成熟DC组肿瘤组肿瘤的体积为(1.056±0.623 cm2);单点注射肿瘤抗原致敏成熟DC组肿瘤的体积为(0.632±0.423)cm2;多次多点注射成熟DC组肿瘤体积为(0.325±0.231)cm2。肿瘤抗原裂解物组和未成熟DC组与单纯注射生理盐水组之间比较,其结果均没有统计学意义(P=0.82和0.68);而与空白组比较相比,单点注射成熟DC组和多点多次注射成熟DC组的结果具有明显统计学差意义(P=0.03和0.002);单点注射成熟DC组与多点多次注射组间比较统计学也有明显差异(P=0.016)(见表1,图1)。

表1 DC注射部位和频率对肿瘤体积的影响
2.2.2 BALB/c雌性小鼠处死后肿瘤质量的测定
空白对照组(单纯注射生理盐水)肿瘤的重量为(1.279±0.512)g;注射肿瘤抗原裂解物组肿瘤的重量为(1.142±0.618)g;注射未成熟 DC组肿瘤的重量为(1.201±0.674)g;单点注射肿瘤抗原致敏成熟DC组肿瘤的重量为(0.814±0.524)g;多点多次注射成熟 DC组肿瘤的重量为(0.441±0.315)g。肿瘤抗原裂解物组和未成熟DC组与空白对照组比较,其差异无明显统计学意义(P=0.91和0.81);而与空白对照组比较,单点注射成熟DC组和点多次注射成熟DC组具有显著统计学意义(P=0.02和0.001);单点注射成熟DC组和多点多次注射组间两组之间比较,其结果也有明显统计学意义(P=0.013)(见表2,图2)。

表2 DC注射部位和频率对肿瘤重量的影响
3 讨论
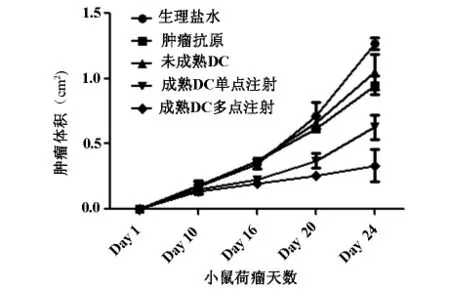
图1 DC注射部位和频率对肿瘤体积的影响

图2 DC注射部位和频率对肿瘤体积的影响
树突状细胞(DC)是一类广泛分布在机体内部的独特细胞,它们吞噬处理抗原并递呈给T淋巴细胞,进而激发机体免疫系统对致病抗原产生有效的免疫应答,从而起到保护机体免受外来微生物的入侵,并能够及时清除自体内异常突变的细胞。但常常由于肿瘤微环境DC数目的有限、局部调节DC有效活性物质的不足,以及肿瘤细胞也时常分泌能抑制DC活性功能的细胞因子等原因往往会导致DC抗原提呈能力显著下降[4,5]。近些年来,国外学者研究发现,采用肿瘤抗原常能在机体外刺激未成熟的DC进入成熟的DC状态,然后再通过各种有效的途径重新输回机体内部,从而起到可以再重新焕起机体内对恶性肿瘤细胞产生各种有效的免疫应答[5-8]。在本次实验中,我们采用BALB/c雌性小鼠膀胱癌模型为研究对象,在体外观察肿瘤抗原致敏树突状细胞对BALB/c雌性小鼠膀胱癌的治疗作用,旨在希望能够为下一步对肿瘤的临床免疫学研究奠定理论基础。
本研究结果显示,单纯注射T24肿瘤抗原不能有效地诱发机体产生抗肿瘤的免疫级联反应,此结果说明T24膀胱癌细胞株的具有弱免疫原性。而未经T24肿瘤抗原致敏的未成熟DC细胞也不能在机体内产生有效的抑制膀胱癌作用。提示在肿瘤患者机体内部,若DC处在未成熟状态的时候,由于其表面缺乏共刺激分子表达,进而也不能有效地递呈抗原,因此,也不能产生有效的免疫应答反应。在本次实验中,在单部位注射抗原致敏成熟的DC组,抑制小鼠膀胱癌的作用有所提高,肿瘤的重量从(1.279±0.512)g下降到(0.814±0.524)g,其结果具有统计学意义(P=0.02)。在多部位多次注射成熟DC组,肿瘤的重量从(1.279±0.512)g下降至(0.441±0.315)g,其结果与空白对照和单部位注射抗原成熟DC组比较,均具有具有显著统计学意义(P=0.001和0.005)。分析其原因,可能因为多次多部位注射成熟DC可以有效地促进其向局部淋巴结迁移,进而起到增加抑制肿瘤生长的效果。
[1]Wada Y,Cardinale I,Khatcherian A,et al.Apilimod Inhibits the Production of IL-12 and IL-23 and Reduces Dendritic Cell Infiltration in Psoriasis.[J].PloS One,2012,7 (4):e35069.
[2]Fong L,Broekstedt D.Dendritic cells injeeted via different routes induce immunity in cancer patients[J].J Immunol,2001(166):4254.
[3]NiK,O'Neill HC.The role of dendritic cells in T cell activation[J].Cell Boil,2002(75):223.
[4]Katsenelson NS,Shurin GV,Bykovskaia SN,et al.Human small cell lung carcinoma and carcinoid tumor regulate dedritic cell maturation and function[J].Mod Pathol,2001,14(1):40.
[5]Nguyen-Pham TN,Lee YK,Lee HJ,et al.Kim HJ,Lee JJ.Cellular immunotherapy using dendritic cells against multiple myeloma[J].Korean J Hematol,2012,47(1):17.
[6]Colaco C.DC-based cancer immunotherapy:the sequel[J].Immunol Today,1999(20):197.
[7]Tan G,Zhang X,Feng H,et al.The therapeutic effect of cytokineinduced killer cells on pancreatic cancer enhanced by dendritic cells pulsed with K-ras mutant peptide[J].Clin Dev Immunol,2011,(64):359.
[8]Chiang CL,Hagemann AR,Leskowitz R,et al.Garrabrant T,Czerniecki BJ,Kandalaft LE,Powell DJ Jr,Coukos G.Day-4 myeloid dendritic cells pulsed with whole tumor lysate are highly immunogenic and elicit potent anti-tumor responses[J].PLoS One.2011,6(12):e28732.

