高肺血流致肺动脉高压幼猪模型中血清内皮素水平的变化
吕 民,符邵鹏,张秀和
(吉林大学中日联谊医院 心 外科,吉林 长 春130033)
肺动脉高压(pulmonary hypertension,PH)的致病机理至今尚未完全阐明,先天性心脏病伴肺动脉高压的产生,预示着预后不良。近年来发现,体液因子在PH的发病中有重要作用。近年研究认为内皮素(endothlin,ET)与PH的发生有关。但以往的报道意见不一。本实验以高肺血流致肺动脉高压幼猪模型,观察其血浆内皮素1(ET-1)相应变化,国内罕有报道。为进一步阐明肺动脉高压的发生机理以及寻求新的治疗方法提供实验依据。
1 材料与方法
1.1 材料 杂种幼猪,年龄2-3月龄,体重10-12 kg,雌雄不拘,采用随机数字表方法分2组:组①为高肺血流组(shunt group,n=12),全部行左侧开胸,降主动脉与左肺动脉搭桥术。组②为正常对照组(control group,n=12):即假手术组,只开胸无手术处理。两组一般情况比较差异无显著性。术后所有动物正常饲养3个月,全部存活,体重增至20-27.5 kg。主要仪器及试剂:多功能麻醉机(Blease英国)、血气分析仪(i-STATI美国)、监护仪(S/5麻醉监护仪 芬兰)、动脉测压(BIOTRANS美国)、光学显微镜(日本)、血清内皮素1(ET-1)试剂盒(美国)。其余实验试剂及设备由吉林大学中日联谊医院中心实验室提供。
1.2 方法
实验猪术前12小时禁食。肌注氯胺酮20 mg/kg,后建立腿部静脉通路,静脉注射戊巴比妥5 mg/kg,插入气管插管,连接麻醉机,行辅助呼吸。芬太尼20μg/kg、潘可罗宁0.1 mg/kg静脉注射维持麻醉,呼吸机控制呼吸。经股动脉穿刺置管连接压力换能器,术中监测有创动脉血压和心率,监测血气分析(p H 值、Pa02、PaC02、血离子),鼻温及肛温监测。组①行左侧开胸,采用人工血管(直径1 cm)降主动脉与左肺动脉搭桥术。组②为对照组,麻醉、气管插管呼吸机控制呼吸,只开胸无手术处理。全组术后90 d分别进行如上麻醉操作,仰卧位,固定四肢及头部,然后正中开胸,检测肺动脉收缩压(PASP)、肺血管阻力,肺组织学观察,Elisa检测血清内皮素水平。血清样本提取。血流动力学测量及血清样本提取完毕,实验猪肝素化(3 mg/kg)后,放血处死。完整取出心、肺,行病理学检测。
血清内皮素检测:全血标本请于室温放置2小时后于1 000xg离心20分钟,取上清标本放于-20℃,待检测。用纯化的抗体包被微孔板,制成固相载体,往包被抗ET-1抗体的微孔中依次加入标本或标准品、生物素化的抗ET-1抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的ET-1呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度。
1.3 统计学处理 采用SPSS11.5软件包进行统计分析,实验数据以均数±标准差表示,统计学处理用组间t检验,百分率用χ2检验。
2 结果
2.1 肺动脉收缩压(PASP)、肺血管阻力(PVR)变化 术后90天与基础值相比,PVR:shunt group组由3.89±0.30Wood's U 升至10.36±1.83 wood's U,出现统计学差异。Control group无统计学差异;PASP:shunt group组由1.50±0.21 kpa升至2.60±0.23 kpa,出现统计学差异。Control group无统计学差异。见表1。
2.2 形态学改变 显微镜下观察:HE染色显示:对照组左肺动脉内皮及平滑肌细胞排列规则(图1);分流组左肺动脉,内膜增厚,平滑肌增生,肌性动脉(MA)数量增多,非肌性动脉NMA数量减少,其中部分血管床毁损(图1)。
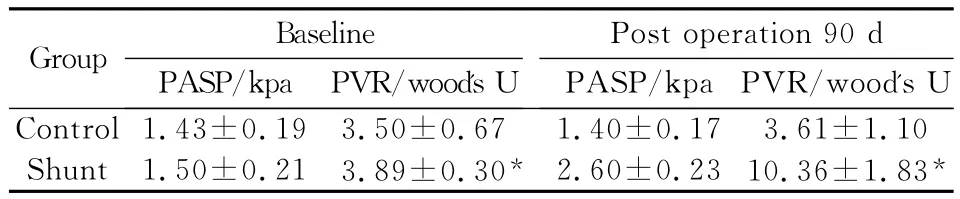
表1 2组动物肺血流动力学变化参数值
2.3 血清内皮素-1检测结果 术后90天与基础值相比,ET-1:shunt group组由69.43±12.55 pg/ml升至107.77±20.21 pg/ml,出现统计学差异。C-group无统计学差异。
3 讨论
肺动脉高压(pulmonary arterial hypertension,PAH)是在病理学上以肺动脉压力异常升高和肺血管床进行性闭塞为主要特征的一类疾病。其发生、发展的机理尚未完全阐明。

图1 2组动物左肺动脉内皮及平滑肌细胞改变
内皮素(Endothelin,ET)是日本学者Yanagisawa等[1]从培养的猪主动脉内皮细胞中分离纯化出一种由21个氨基酸残基组成的话性多肽,内皮素是迄今所知最强的缩血管物质,其作用时间持久。内皮素(endothelin,ET)不仅存在于血管内皮,也广泛存在于各种组织和细胞中,是调节心血管功能的重要因子,对维持基础血管张力与心血管系统稳态起重要作用。
尽管PAH的发病机制还不十分清楚,但是肺血管内皮素(endothelin,ET)系统功能损伤对于PAH进程具有重要的作用。对于心血管起主要作用的是ET-1。内皮细胞受到刺激合成并释放ET-1,刺激ET-1合成的因素包括:组织缺氧,氧化代谢增强及儿茶酚胺水平增高均可刺激前内皮素原的转录肾上腺素、血栓素、血管加压素、血管紧张素、胰岛素、细胞因子以及血管壁剪切力与压力的变化及缺氧等物理化因素。抑制ET-1合成的因素有:NO,PGI2,心房利钠肽及肝素等。研究发现,缺氧可引起EC的超微结构明显变化,管壁增生隆起,内膜增厚,胞饮现象明显增强[2]。缺氧还可以导致EC合成和分泌ET明显增加[3]。ET通过和受体ETBR结合刺激内皮细胞迁移增殖进入周围组织,另一方面通过作用于血管平滑肌上ETAR受体而刺激血管内皮生长因子合成,参与血管生成[4]。肺部是ET-1作用和代谢的最重要的器官。ET-1水平升高可能由于以下原因:(1)在肺组织中合成增加:在生理情况下肺泡上皮细胞、肺血管内皮细胞和肺神经内分泌细胞均可以表达ET-1,过度表达的ET-1主要分布在丛样病变部位(原发性PAH的肺血管常见病理学改变)。(2)肺清除ET-1的能力下降:肺是ET-1代谢的重要器官,正常状态下主动脉血ET-1水平高于肺动脉血,原发性PAH时肺动脉血ET-1水平高于主动脉血,由此推测肺清除ET-1能力下降。
在PAH的机体内,血浆ET-1水平显著升高,PAH越高,血浆ET-1水平亦升高,从而认为肺循环ET-1水平升高在PAH的进程中发挥了重要的作用[5]。血管内皮素受体拮抗剂(ETAs)可以提高PAH 的运动耐力[6]。
本实验表明,体肺动脉分流术后90 d的检测结果显示左肺动脉主干扩张,末梢狭窄,镜下见肺小动脉内膜和中膜平滑肌细胞过度增生,中膜及内膜显著增厚,其中部分血管腔完全闭塞,出现血管丛样改变。右肺动脉压力虽有升高,不及左肺动脉明显,其肺小动脉中膜仅出现轻度增生,内膜改变不明显,血管壁无明显增厚。
本实验表明,高肺血流肺动脉高压幼猪模型中,术后90天与基础值相比,肺动脉收缩压、肺血管阻力明显升高,出现统计学差异。血清内皮素-1明显升高,出现统计学差异;而对照组上述指标无差异。可以证明,先天性心脏病肺动脉高压时,肺血流动力学及组织学变化与血清内皮素-1变化呈正相关性。本实验证明,实验猪的心血管解剖及生理特点与人类极为相似。此动物模型的建立,为今后对人类先天性心脏病肺动脉高压的形成机理及治疗的研究提供了良好的实验基础。
[1]Yanagisawa M,Kurihara H,Kimuras,et al.A novel potent vaso constrictor peptide procuced by vascular endothelinal cells[J].Natrure,1988,332:411.
[2]常小荣.血管内皮细胞与心血管疾病[J].中国康复,2004,19(2):122.
[3]Clete A,Kushida,Michael R,et al.Practice parameter for the indications for polysomnography and related procedure:An update for 2005[J].Sleep,2005,28(4):489.
[4]王忠学,洪小苏.内皮素-1与血管生成的研究[J].医学综述,2004,10(7):398.
[5]卢英民,毛焕元,曹林生.血浆内皮素和内皮衍生舒张因子与先天性心脏病肺动脉高压关系的研究[J].临床心血管病杂志,2003,19(2):93.
[6]Mc Laughlin W,Archer SL,Badesch DB,et al.ACCF/AHA 2009 expert consensus document on pulmonary hypertension:a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association:developed in collaboration with the American College of Chest Physicians,American Thoracic Society,Inc.,and the Pulmonary Hypertension Association[J].Circulation,2009,119(16):2250.

