SMC1A在肿瘤领域的研究
张一帆,张兴义,姜 睿,孙 梅*
(1.吉林大学白求恩第二医院,吉林 长春130041;2.吉林大学中日联谊医院)
一个世纪以前,Boveri曾在研究中观察到染色体异常与肿瘤发生相关,并由此推测染色体不稳定性(chromosome instability,CIN)可介导肿瘤的发生[1]。如今随着肿瘤分子生物学的发展,人们逐渐意识到恶性肿瘤具有不同于正常细胞的一些生物学特性,例如过度激活的增殖信号、抗凋亡途径以及侵袭转移机制等。其中染色体不稳定性是恶性肿瘤的主要标志之一,可以促进恶性肿瘤产生一系列生物学特性,从而在肿瘤发生发展中起到关键作用[2]。然而迄今为止人们对细胞是如何保持基因组稳定性以及染色体不稳定性在肿瘤发生发展中的具体作用机制却知之甚少。近年来科研工作者们开展了多项研究试图深入了解基因组不稳定性产生的机制及其在肿瘤发生过程中的作用,而凝聚蛋白(Cohesin)复合体的发现无疑是该领域新的突破口。Cohesin蛋白复合体是细胞维护染色体稳定性的关键因子,而SMC1A作为Cohesin的重要亚基之一,其功能异常被发现与包括恶性肿瘤在内的多种疾病相关。本文主要对Cohesin的亚基SMC1A在肿瘤领域的研究进展作一综述。
1 Cohesin的结构
Cohesin蛋白复合体是一种人类进化过程中高度保守的蛋白复合体,最早发现于酵母细胞。该蛋白复合体含有4个亚基:即一对染色体结构维修蛋白(Structural Maintenance of Chromosomes,SMC)SMC1A和SMC3,以及两个非SMC蛋白质RAD21/SCC1 和 STAG/SCC3/SA 构 成。 其 中SMC蛋白SMC1A和SMC3由两条卷曲螺旋的结构域以及一个球状铰链域构成。在Cohesin复合体中两个SMC蛋白的铰链域相互交缠,以此建立一个反向的异二聚体,而他们的起始域与RAD21蛋白相互作用,共同构成一个封闭环状结构。最后,RAD21亚基与SA结合,形成一个完整的Cohesin复合体[3]。Cohesin可以通过其特殊的环状结构捕捉DNA,藉此在姊妹染色单体凝聚以及其他细胞活动中执行重要功能(图1)。
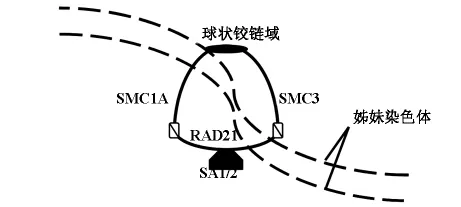
图1 Cohesin结构示意
2 Cohesin的功能
在细胞有丝分裂过程中染色体复制,形成成对的姊妹染色体。当细胞进入分裂中期后,姊妹染色体紧密聚拢在纺锤体赤道,直到末期向两极准确分离。同源姊妹染色体的这种彼此聚集作用被称作姊妹染色体凝聚(Sister Chromatid Cohesion,SCC)。在该过程中Cohesin复合体可以通过其环状结构把姊妹染色体聚拢在中期纺锤体上,并维持姊妹染色体之间一定的张力,直到分裂末期姊妹染色体分离[4]。Cohesin复合体在染色体凝聚过程中的这一功能可以有效防止姊妹染色单体的提前分裂,因此对维护子细胞的染色体稳定性有着重要意义[5]。虽然已有多个针对Cohesin在细胞分裂中的作用模式被相继提出[6-8],但迄今为止Cohesin蛋白在细胞分裂过程中的作用机制并未得到完全阐明。目前普遍认为Cohesin在有丝分裂过程中发挥其功能依赖多个Cohesin相关蛋白的协调作用。例如在酵母细胞的G1期或在哺乳动物细胞中的前一个细胞周期的末期,辅助因子NIPBL便开始介导Cohesin装配在染色体上。当细胞进入S复制期后,Eco1/Ctf7介导的SMC3乙酰化可以维持Cohesin稳定地固着在染色体上[9]。而姊妹染色体的准确配对和维持则有赖于PDS5与Cohesin蛋白复合体之间的相互作用[10]。细胞由分裂中期向后期过渡受到中/后期关卡(checkpoint)严格调控。只有当所有姊妹染色体在纺锤体内准确的向两极分离时,APC/C复合体(Anaphase Promoting Complex/Cyclosome)抑制中/后期关卡,推动细胞周期向后期过渡。在细胞分裂后期,Cohesin的亚基 RAD21和SA1/SA2被Polo-like激酶1(PLK1)磷酸化,环状结构被打开,使固着在染色体臂上的Cohesin逐步脱落下来。但聚集在着丝粒区域内的Cohesin仍受到SGO1的保护[11]。此外Cohesin从染色体上脱离还需要 WAPL因子与RAD21及SA1直接作用[12]。最后由APC/C复合体降解PTTG1,促使ESPL1(裂解酶)切断RAD21,从而使着丝粒上的Cohesin彻底从染色质中脱落下来[13]。Cohesin在细胞分裂周期中的功能很好的为我们揭示了细胞分裂过程中姊妹染色体是如何紧密相连以及准确分离。然而在细胞分裂期结束后仍有部分Cohesin复合体以环状结构残留在细胞内甚或被重新装配在染色体上[14],令人们不禁推测Cohesin除了在细胞周期调控中的作用,还履行着其他的功能(图2)。
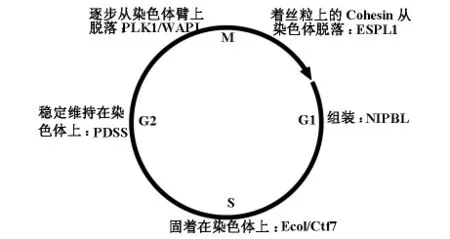
图2 Cohesin在细胞周期中的作用模式
当细胞暴露于电离辐射致其内部的DNA双链断裂时,其断裂的DNA若得不到正确的修复则会引起基因的插入,缺失以及易位,严重影响染色体稳定性,最终可能诱发肿瘤。目前已有研究发现Cohesin复合体在细胞的DNA修复机制中发挥重要功能。如在芽植酵母中,当细胞暴露于γ射线导致其内部发生DNA双链断裂时,Cohesin复合体可以通过染色体凝聚作用使姊妹染色体彼此靠近,协助DNA修复相关因子以未发生断裂的染色体为模板,修复其断裂的位点[15]。而且在人体细胞内Cohesin复合体常聚集在DNA双链断裂后重建连接的区域[16]。Cohesin在该区域内的聚集不仅能在DNA发生损伤后维护DNA的构象以利于修复相关酶的附着,还可以在哺乳动物细胞中通过募集细胞关卡相关蛋白,调控细胞周期,调控受损DNA的修复[17]。由此可见,Cohesin对细胞DNA修复及维护染色体稳定性等方面具有重要作用。
如上文所述,在细胞分裂后期Cohesin的亚基RAD21可以被ESPL1溶蛋白性裂解,使环状结构解开,利于姊妹染色体的分离。有趣的是,研究者们在细胞凋亡过程中也发现了RAD21蛋白的裂解[18],但RAD21蛋白在凋亡中的裂解位点不同于在姊妹染色体凝聚过程中的裂解位点,其裂解过程往往发生在凋亡早期,为非P53依赖性凋亡,而其裂解后的产物以正向反馈机制促进凋亡[19]。这些结果提示Cohesin复合体参与细胞非P53凋亡途径,但其在该凋亡信号通路中的具体机制尚不清楚。
Cohesin可以与锌指蛋白CTCF相互作用,从而在哺乳动物细胞印记调控中执行重要功能。目前研究已证实锌指蛋白CTCF可以调控多个印记位点,其中对 H19/IGF2基因的印记调控最具代表性。H19为父源性基因,而IGF2为母源性基因。Cohesin和CTCF蛋白相互作用后,CTCF一方面可以结合在H19的印记调控区域促进其表达,另一方面通过抑制IGF2的远端增强子阻断IGF2基因的表达。反之亦然。锌指蛋白CTCF在H19/IGF2基因印记中这一功能需Cohesin蛋白的参与[20]。
除此之外,Cohesin复合体与锌指蛋白CTCF相结合以后锚定在染色体上,促使染色体形成发卡结构,从而调控基因的转录[21]。目前已知Cohesin蛋白及CTCF锌指蛋白可以结合在多种基因的转录起始位点[22]。在果蝇细胞的研究中人们还发现Cohesin相关蛋白Nipped-B可以通过远端增强子的调节促进其下游基因cut的表达[23]。
综上所述,Cohesin复合体不仅在细胞有丝分裂过程中维护姊妹染色单体的配对及准确分离,保证子细胞的基因组稳定性,还在DNA损伤修复、细胞周期调控、凋亡、基因印记调控以及基因转录调控等多项细胞生命活动中发挥重要功能。由此我们不难想象Cohesin复合体的功能缺陷在人体中引起包括恶性肿瘤在内的多种疾病。
3 Cohesin蛋白复合体与恶性肿瘤
目前人们已观察到大多数癌细胞都展现出染色体不稳定性,而Cohesin蛋白复合体自从被发现以来一直被认为是维护染色体稳定性的关键因子。近年来越来越多的实验研究致力于阐释Cohesin蛋白及其辅助因子的功能缺陷与人类恶性肿瘤发生发展的相关性。Barber等在表现为染色体不稳定性的结肠癌细胞中发现包括SMC1A,SMC3,SA3和NIPBL在内多个Cohesin相关基因的突变致其编码蛋白表达受阻[24]。除了突变之外,Cohesin相关基因的表达异常也在多种人类癌症中被观察到。例如RAD21基因在前列腺癌中高表达[25],而且该基因在乳腺癌中其表达水平与患者预后呈负相关[26]。此外人们还在宫颈癌细胞中发现WAPL基因的高表达可以促进癌细胞增殖及侵袭[27],裂解酶的编码基因ESPL1的高表达在乳腺癌和前列腺癌中均提示预后不良[28]。而RAD21在口腔鳞癌细胞中表达下调可以增强癌细胞的侵袭及转移能力[29]。在胚胎细胞中PDS5B的表达缺失则可以诱发胚胎性癌[30]。这些实验证据足以表明Cohesin的功能缺陷与肿瘤发生具有一定的相关性。然而这些基因的表达失控与肿瘤发生的关系显得复杂多样。Cohesin复合体在肿瘤发生发展中的分子机制仍是现阶段函待解决的热点问题。
如上文所述,Cohesin蛋白复合体通过其在分裂周期中的经典模式维护细胞的染色体稳定性。而该功能的缺陷可以导致姊妹染色单体的分离及子细胞内的染色体数量异常,最终影响基因的表达,例如染色体缺失可以引起某些抑癌基因的丢失。若这些抑癌基因的等位基因处于失活状态,则有可能引起细胞异常增殖甚至肿瘤的发生。同理,染色体异常增多所致癌基因的激活亦可介导肿瘤的发生。如恶性胶质瘤细胞中10号染色体以单体形式存在可以导致抑癌基因PTEN的失活而在肾癌细胞中7号染色体的三体形式则会引起癌基因MET的过表达。不过人们在正常肾组织细胞中也观察到7号染色体的三体形式,因此关于其是否与肾癌发生发展相关尚存在较多争议。有趣的是,Kudhson提出的两次突变学说认为肿瘤的发生源于两次抑癌基因的突变,而目前已有学者提出其中一次突变可能来源于Cohesin蛋白的功能缺陷[31]。除此之外,Cohesin与CTCF结合后可以调控多种不同基因的细胞印记,其中H19/IGF2基因印记的调控已被广泛地研究。在宫颈癌Hela细胞系里RAD21基因的缺失可以引起H19/IGF2基因的印记调控异常。IGF2印记失控也发生在约90% 肾母细胞瘤以及其他恶性肿瘤中如肺癌,宫颈癌,横纹肌肉瘤和睾丸癌等[32-34]。
综上所述,Cohesin蛋白复合体不仅凭借其环状结构在细胞有丝分裂中发挥重要功能,而且还广泛参与DNA修复,细胞周期,基因的转录调控以及基因组印记等细胞生命活动,藉此维护细胞基因组的稳定性。而突变及其他因素所致Cohesin复合体的功能缺陷往往会伴有染色体结构及数量的异常和细胞周期失控,导致细胞基因组稳定性遭到破坏,从而介导恶性肿瘤的发生发展。而作为其重要的部件之一SMC1A基因的异常表达也在多种人类恶性肿瘤中发现。
4 SMC1A的功能
在人类细胞内SMC1A基因位于性染色体11.22至11.21区域内含有25个外显子,负责编码Cohesin复合体的重要部件之一SMC1A蛋白。人们在研究Cornelia de Lange Syndrome(CdLS)时惊奇的发现这种先天性综合征与Cohesin的功能缺陷密切相关,其中约5%的CdLS患者显示SMC1A的突变。虽然该基因的突变仅存在于一小部分CdLS患者中,但这足以说明SMC1A基因的异常可以导致胚胎细胞的染色体不稳定并造成严重的先天性发育缺陷。此外SMC1A被认为与胚胎干细胞的自我更新能力密切相关,利用RNAi技术下调SMC1A的表达可以削弱胚胎干细胞的自我更新能力[35]。
如上文中所述,作为Cohesin蛋白复合体亚基SMC1A与SMC3及RAD21蛋白共同构成一个封闭环状结构,在姊妹染色体凝聚中发挥重要功能。除此之外,人们很早就观察到SMC1A还是某些ATM/ATR蛋白激酶的底物。当细胞暴露于电离辐射导致其内部DNA损伤后,SMC1A蛋白957和966位点的丝氨酸残端被ATM磷酸化,通过NBS1和BRCA蛋白的募集作用使ATM蛋白激酶聚集在损伤部位,促进 DNA损伤的修复[36,37]。在电离辐射后的鼠类细胞中SMC1A基因若发生突变导致其编码蛋白不能被磷酸化,则会引起细胞的DNA修复能力明显减弱,其生存率下降[38]。而且在人类纤维细胞中运用RNAi技术同时敲除SMC1A和SMC3则会引起细胞染色体非整倍体等异常,尤以基因组脆性位点变化显著[39]。由此可见,SMC1A在细胞DNA修复机制中起到关键作用,其功能异常可以导致细胞DNA修复障碍,进而引起严重后果。
最近人们还在去铁草酰胺介导的凋亡过程中观察到SMC1A被ATR磷酸化,表明SMC1A亦参与该类凋亡[40]。
此外,Cohesin的亚基RAD21和SMC1还可以和锌指蛋白CTCF共同作用于哺乳动物c-myc基因的启动子序列及H19/Igf2印记调控区域,从而调控基因转录以及染色质结构[41]。
5 SMC1A与肿瘤
虽然SMC1A在肿瘤发生中的机制目前尚未得到充分阐明,但已有实验研究证实SMC1A的表达与肿瘤发生发展相关。
在急性髓细胞样白血病的研究中人们发现SMC1A基因的表达与患者年龄呈负性相关,而且其编码蛋白的表达水平与患者的预后成正相关[42]。如上文所述,SMC1A在维护染色体稳定等方面有着重要功能作用,但在该项研究中人们并未观察到SMC1A的表达异常引起染色体不稳定及其他明显的染色体异常等情况的出现。SMC1A在急性髓细胞样白血病发生发展中的分子机制仍需进一步深入的探究。
结直肠癌细胞往往表现出基因组不稳定,但其具体机制一直以来未得到阐明。最近Barber等人在研究结肠癌时发现132例结肠癌细胞内有11种基因突变,而SMC1A的突变就占了其中4种,并且均为错义突变。该基因的错义突变可形成提前终止密码子或者读码框的移动,使其编码蛋白合成受阻,表达下调。为了验证这些基因与肿瘤发生的作用,研究者们应用siRNA技术下调SMC1A,SMC3和SCC的表达,发现这些基因的敲除可导致正常细胞姊妹染色单体凝聚功能障碍以及染色体不稳定,提示这些Cohesin相关基因可能是引起结肠癌细胞中染色体不稳定的靶基因,其表达受阻可影响细胞的染色体稳定性并促使肿瘤的发生[24]。
此外,冯婉婷等人发现慢病毒介导RNAi沉默结直肠癌细胞的SMC1A基因可以引起癌细胞对奥沙利铂的敏感性显著增加[43],提示SMC1A的表达与癌细胞对化疗药物的敏感性相关。
但到目前为止SMC1A的调控异常在肿瘤发生过程中的作用尚存较多争议。例如SMC1A的突变所造成的Cohesin功能缺陷与CdLS的发病呈一定的相关性,但大多数CdLS的患者并不伴有癌症发生。有关SMC1A的表达下调导致染色体不稳定是否发生在其他恶性肿瘤细胞中,SMC1A在不同肿瘤发生发展中的具体作用机制及其是否与姊妹染色单体凝聚功能缺陷以及染色体不稳定相关,SMC1A在不同肿瘤中的表达水平是否决定抗癌疗效并与预后相关等等这些问题都需要进一步的研究探索和验证。
综上所述Cohesin的功能缺陷在肿瘤领域是一个新兴的分子机制,其在DNA修复,细胞周期和基因表达调控和基因组印记调控等过程中的重要作用目前受到了学界的广泛关注。而SMC1A作为Cohesin复合体的重要亚基,参与到多种细胞活动中,其突变及调控异常往往会引起基因组的不稳定,并有可能促成癌症的发生发展。因此Cohesin复合体及其亚基SMC1A的深入研究有望为我们研究肿瘤发生发展的分子机制开辟出新的途径,从而为肿瘤的早期诊断以及个体化靶向治疗的临床应用提供可靠的理论依据。
[1]Holland AJ,Cleveland DW.Boveri revisited:chromosomal instability,aneuploidy and tumorigenesis[J].Nat Rev Mol Cell Biol,2009,10:478.
[2]Negrini S,Gorgoulis VG,Halazonetis TD.Genomic instability-an evolving hallmark of cancer[J].Nat Rev Mol Cell Biol,2010,11:220.
[3]Haering CH,Lowe J,Hochwagen A,et al.Molecular architecture of SMC proteins and the yeast cohesin complex[J].Mol Cell,2002,9:773.
[4]Aragon L.A double lock on sister chromatids by cohesin[J].Mol Cell,2011,44:5.
[5]Michaelis C,Ciosk R,Nasmyth K.Cohesins:chromosomal proteins that prevent premature separation of sister chromatids[J].Cell,1997,91:35.
[6]Guacci V.Sister chromatid cohesion:the cohesin cleavage model does not ring true[J].Genes Cells,2007,12:693.
[7]Huang CE,Milutinovich M,Koshland D.Rings,bracelet or snaps:fashionable alternatives for Smc complexes[J].Philos Trans R Soc Lond B Biol Sci,2005,360:537.
[8]Ocampo-Hafalla MT,Uhlmann F.Cohesin loading and sliding[J].J Cell Sci,2011,124:685.
[9]Rolef Ben-Shahar T,Heeger S,Lehane C,et al.Eco1-dependent cohesin acetylation during establishment of sister chromatid cohesion[J].Science,2008,321:563.
[10]Panizza S,Tanaka T,Hochwagen A,et al.Pds5cooperates with cohesin in maintaining sister chromatid cohesion[J].Curr Biol,2000,10:1557.
[11]McGuinness BE,Hirota T,Kudo NR,et al.Shugoshin prevents dissociation of cohesin from centromeres during mitosis in vertebrate cells[J].PLoS Biol,2005,3:e86.
[12]Kueng S,Hegemann B,Peters BH,et al.Wapl controls the dynamic association of cohesin with chromatin[J].Cell,2006,127:955.
[13]Hauf S,Waizenegger IC,Peters JM.Cohesin cleavage by separase required for anaphase and cytokinesis in human cells[J].Science,2001,293:1320.
[14]Peters JM,Tedeschi A,Schmitz J.The cohesin complex and its roles in chromosome biology[J].Genes Dev,2008,22:3089.
[15]Sjogren C,Nasmyth K.Sister chromatid cohesion is required for postreplicative double-strand break repair in Saccharomyces cer-evisiae[J].Curr Biol,2001,11:991.
[16]Potts PR,Porteus MH,Yu H.Human SMC5/6complex promotes sister chromatid homologous recombination by recruiting the SMC1/3cohesin complex to double-strand breaks[J].EMBO J,2006,25:3377.
[17]Watrin E,Peters JM.The cohesin complex is required for the DNA damage-induced G2/M checkpoint in mammalian cells[J].EMBO J,2009,28:2625.
[18]Chen F,Kamradt M,Mulcahy M,et al.Caspase proteolysis of the cohesin component RAD21promotes apoptosis[J].J Biol Chem,2002,277:16775.
[19]Pati D,Zhang N,Plon SE.Linking sister chromatid cohesion and apoptosis:role of Rad21[J].Mol Cell Biol,2002,22:8267.
[20]Wendt KS,Yoshida K,Itoh T,et al.Cohesin mediates transcriptional insulation by CCCTC-binding factor[J].Nature,2008,451:796.
[21]Dorsett D.Cohesin:genomic insights into controlling gene transcription and development[J].Curr Opin Genet Dev,2011,21:199.
[22]Rhodes JM,Bentley FK,Print CG,et al.Positive regulation of c-Myc by cohesin is direct,and evolutionarily conserved[J].Dev Biol,2010,344:637.
[23]Rollins RA,Korom M,Aulner N,et al.Drosophila nipped-B protein supports sister chromatid cohesion and opposes the stromalin/Scc3cohesion factor to facilitate long-range activation of the cut gene[J].Mol Cell Biol,2004,24:3100.
[24]Barber TD,McManus K,Yuen KW,et al.Chromatid cohesion defects may underlie chromosome instability in human colorectal cancers[J].Proc Natl Acad Sci U S A,2008,105:3443.
[25]Porkka KP,Tammela TL,Vessella RL,et al.RAD21and KIAA0196at 8q24are amplified and overexpressed in prostate cancer[J].Genes Chromosomes Cancer,2004,39:1.
[26]Oishi Y,Nagasaki K,Miyata S,et al.Functional pathway characterized by gene expression analysis of supraclavicular lymph node metastasis-positive breast cancer[J].J Hum Genet,2007,52:271.
[27]Oikawa K,Ohbayashi T,Kiyono T,et al.Expression of a novel human gene,human wings apart-like (hWAPL),is associated with cervical carcinogenesis and tumor progression[J].Cancer Res,2004,64:3545.
[28]Meyer R,Fofanov V,Panigrahi A,et al.Overexpression and mislocalization of the chromosomal segregation protein separase in multiple human cancers[J].Clin Cancer Res,2009,15:2703.
[29]Yamamoto G,Irie T,Aida T,et al.Correlation of invasion and metastasis of cancer cells,and expression of the RAD21gene in oral squamous cell carcinoma[J].Virchows Arch,2006,448:435.
[30]Denes V,Pilichowska M,Makarovskiy A,et al.Loss of a cohesin-linked suppressor APRIN (Pds5b)disrupts stem cell programs in embryonal carcinoma:an emerging cohesin role in tumor suppression[J].Oncogene,2010,29:3446.
[31]Mannini L,Musio A.The dark side of cohesin:the carcinogenic point of view[J].Mutat Res,2011,728:81.
[32]Ravenel JD,Broman KW,Perlman EJ,et al.Loss of imprinting of insulin-like growth factor-II (IGF2)gene in distinguishing specific biologic subtypes of Wilms tumor[J].J Natl Cancer Inst,2001,93:1698.
[33]McCann AH,Miller N,O'Meara A,et al.Biallelic expression of the IGF2gene in human breast disease[J].Hum Mol Genet,1996,5:1123.
[34]Chao W,D'Amore PA.IGF2:epigenetic regulation and role in development and disease[J].Cytokine Growth Factor Rev,2008,19:111.
[35]Hu G,Kim J,Xu Q,et al.A genome-wide RNAi screen identifies a new transcriptional module required for self-renewal[J].Genes Dev,2009,23:837.
[36]Kim ST,Xu B,Kastan MB.Involvement of the cohesin protein,Smc1,in Atm-dependent and independent responses to DNA damage[J].Genes Dev,2002,16:560.
[37]Yazdi PT,Wang Y,Zhao S,et al.SMC1is a downstream effector in the ATM/NBS1branch of the human S-phase checkpoint[J].Genes Dev,2002,16:571.
[38]Kitagawa R,Bakkenist CJ,McKinnon PJ,et al.Phosphorylation of SMC1is a critical downstream event in the ATM-NBS1-BRCA1pathway[J].Genes Dev,2004,18:1423.
[39]Musio A,Montagna C,Mariani T,et al.SMC1involvement in fragile site expression[J].Hum Mol Genet,2005,14:525.
[40]So EY,Ausman M,Saeki T,et al.Phosphorylation of SMC1by ATR is required for desferrioxamine (DFO)-induced apoptosis[J].Cell Death Dis,2011,2:e128.
[41]Stedman W,Kang H,Lin S,et al.Cohesins localize with CTCF at the KSHV latency control region and at cellular c-myc and H19/Igf2insulators[J].EMBO J,2008,27:654.
[42]Homme C,Krug U,Tidow N,et al.Low SMC1Aprotein expression predicts poor survival in acute myeloid leukemia[J].Oncol Rep,2010,24:47.
[43]冯婉婷,喻晓娟,李 进,等.靶向SMC1A基因慢病毒介导的RNA干扰对奥沙利铂治疗敏感性的影响[J].临床肿瘤学杂志,2012,17(05):235.

