前列腺癌骨转移患者血清PSA、ALP及ICTP的表达及临床意义
李 建,巫骏川,陈 爽,万子杨
(泸州市中医医院 泌尿外科,四川 泸州646000)
近年来,随着经济的发展和社会的进步,再加上饮食结构和工作环境的变化,癌症的发病率也在逐年升高,前列腺癌(prostate cancer,PCa)就是泌尿系统常见的恶性肿瘤,并且其发病年龄趋向年轻化。临床研究发现,骨骼是前列腺癌发生远处转移较常见的器官,前列腺癌骨转移率比较高,因此对于前列腺癌骨转移早期诊断显得尤为重要[1]。全身骨扫描是目前用于诊断和监测前列腺癌患者骨转移的主要方法,其灵敏度高,能一次全身显像,比传统的X线检查更容易发现病变所在,但骨扫描价格昂贵且特异性不高,对病人和医护人员有一定的放射损伤[2]。为了更好的研究前列腺癌骨转移的诊断方法,本研究通过测定骨骼病变的生化指标(PSA、ALP及ICTP)来进一步探讨用于诊断前列腺癌患者的骨转移方法。
1 资料与方法
1.1 一般资料
选择2008年9月至2010年9月在我院治疗的患者共98例,其中53例经ECT全身骨扫描,并经骨穿刺病理活检确诊为前列腺癌骨转移患者作为观察组,年龄45-79岁,平均年龄47.38±5.97岁;其余45例为非骨转移患者作为对照组,年龄47-81岁,平均年龄46.72±4.61岁。两组患者均无心、肝、肺和肾等疾病并且患者肝肾功能正常,无前列腺疾病史。
1.2 方法
1.2.1 标本采集 两组患者在测量当日清晨空腹抽取静脉血约6ml,在室温条件下放置30min后,3 000r/min离心5min将血清分离,并于-40℃冰箱保存备用。
1.2.2 PSA、ALP及ICTP的测定 PSA 的测定采用全自动化学发光免疫分析仪(美国贝克曼公司生产)及其配套试剂,严格按照说明书进行操作,参考值为0-4μg/L;ICTP的测定采用ELISA试剂盒(南京建成生物科技有限公司生产)进行测试,其参考值范围为1.8-5.0μg/L;ALP的测定采用速率法检测,仪器为全自动生化分析仪AU640,试剂为AMP做缓冲液,参考范围为45-130U/L,37℃。
1.3 统计学处理
所有数据采用SPSS17.0统计软件处理,计量资料用均数±标准差()表示,采用t检验,计数资料采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 观察组和对照组PSA、ALP及ICTP的比较表1可见,观察组PSA、ALP及ICTP的水平均明显高于对照组,差异性显著具有统计学意义,P<0.05。
表1 两组间PSA、ALP及ICTP的比较()

表1 两组间PSA、ALP及ICTP的比较()
注:与对照组比较,*P<0.05。
组别 n PSA(μg/L) ALP(U/L) ICTP(μg/L)对照组45 71.58±27.19 66.32±13.64 3.98±1.05观察组 53 172.31±35.78* 798.84±124.51* 15.68±5.11*
2.2 血清PSA、ALP及ICTP对前列腺癌骨转移诊断的灵敏度、特异性和准确度
PSA值以>20μg/L为临界值其灵敏度、特异性和准确性分别为96.2%(51/53)、60.0%(27/45)、80.6%(79/98);ALP值以>90U/L为临界值其灵敏度、特异性和准确性分别为94.3%(50/53)、46.7%(21/45)、72.4%(71/98);ICTP值>6μg/L为临界值其灵敏度、特异性和准确性分别为98.1%(52/53)、86.7% (39/45)、92.9% (91/98),PSA、ALP及ICTP水平的分布见表2。
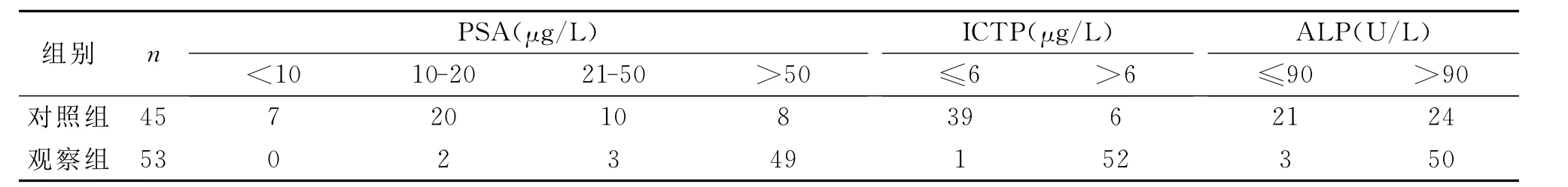
表2 两组患者的不同PSA、ALP及ICTP水平的分布
3 讨论
前列腺癌是男性生殖系统中比较严重的恶性肿瘤,该病的发病率正在逐年上升,严重威胁着患者的身心健康。前列腺癌转移的常见部位为骨骼,但在早期骨转移中无明显的临床症状,当前列腺癌患者感觉到骨骼疼痛,说明癌细胞已经转移到骨骼形成前列腺癌骨转移,常常会失去了最佳治疗时机[3]。目前诊断前列腺癌骨转移的主要诊断手段是放射性核素全身骨显像技术,但该显像需要仪器特殊,检查的费用较高,并且对病人和医护人员有一定的放射性损伤。骨细胞在代谢过程中常会产生骨代谢标志物,当肿瘤骨转移到骨细胞时,对骨代谢造成破坏,骨代谢标志物生成异常,因此本研究对骨代谢标志物PSA、ALP及ICTP进行测定,从而进一步诊断前列腺癌骨转移。
PSA是一种糖蛋白,主要由前列腺上皮分泌,组织特异性高,具有中性丝氨酸蛋白酶活性,当前列腺癌患者癌细胞过度生长时会破坏前列腺正常组织,造成组织中PSA释放入血,使血清中PSA显著升高[4]。同理当前列腺癌细胞转移到骨骼时,骨骼里的PCa细胞大量繁殖,分泌大量PSA入血,导致血清PSA进一步升高。ALP是一种分布广泛的单脂磷酸水解酶,具有多种同工酶的活性,患者在除外肝脏病变和其他骨良性病变后仍也可以作为一个诊断PCa骨转移有意义的指标[5]。ICTP是人体富含的一种胶原蛋白,也是构成骨骼和肌腱唯一的胶原蛋白。在许多疾病的病理过程中I型胶原的合成和降解会发生改变,因此ICTP的转化可作为诊断骨骼代谢性疾病一个的重要的生化指标,当前列腺癌骨转移患者骨质破坏时,会造成血清ICTP浓度升高[6]。本研究结果观察组ALP、PSA及ICTP明显高于对照组(P<0.05)。说明前列腺癌骨转移与患者血清中ALP、PSA及ICTP密切相关,并且对于该病的诊断灵敏性和特异性都比较高。
综上所述,临床上,怀疑前列腺癌骨转移患者,可以同时检测血清中的ALP、PSA及ICTP浓度并与骨显像相结合,从而进一步提高该病诊断的准确性。
[1]杨 欢,王 波,周惠琴,等.前列腺癌骨转移患者血清ICTP、PINP的表达及临床价值[J].临床输血与检验,2010,12(2):128.
[2]柴克强,凡杰,夏术阶,等.PSA及其相关参数在前列腺癌骨转移中的预测作用[J].中国男科学杂志,2006,20(2):20.
[3]侯龙敏,谢有兰.前列腺骨转移患者PSA测定的临床价值[J].河南大学学报(医学版),2007,26(2):70.
[4]曹海燕,刘露,何国城.血清ICTP在前列腺癌骨转移诊断和疗效观察中的应用[J].中国医药导报,2007,4(11):101.
[5]刘 露,曹海燕,何国城.血清PSA和ICTP诊断前列腺癌骨转移的临床价值评价[J].海南医学,2006,17(5):162.
[6]邝永龙,王德林,吴小候.ALP、PSA及其相关指标与前列腺癌骨转移的关系[J].现代泌尿生殖肿瘤杂志,2010,2(5):208.

