慢病毒介导的RNA干扰增殖诱导配体基因抑制胃癌细胞增殖
蒿姗姗,李 薇,王 畅,崔久嵬
(吉林大学第一医院 肿瘤中心,吉林 长春130021)
胃癌(GC)是世界第二大致癌症相关死亡的最常见的原因之一,也是我国最常见的恶行肿瘤之一。近年来,胃癌的发病呈上升趋势,探讨其发病机制对其诊治具有重要意义。
增 殖 诱 导 配 体 (APRIL)(又 称 TALL-2,TRDL1,或TNFSF13)是肿瘤坏死因子(TNF)家族的一个成员。它最初确定是1998年由Hahne等[1]首先发现,因刺激肿瘤细胞的增殖而得名。APRIL在正常组织的表达很弱,但在多种肿瘤细胞和组织,如肺癌、黑色素瘤[2],特别是胃肠道肿瘤有高水平表达[1,3]。在本项研究中,我们通过构建 APRIL siRNA慢病毒载体并转染人胃癌MGC803细胞,观察其对MGC803细胞增殖及细胞周期的影响,以探讨其在胃癌发病中的作用。
1 材料与方法
1.1 材料
人胃癌细胞系 MGC803(购自ATCC);大肠杆菌菌株DH5α、293T细胞(本实验室保存);RPMI 1640培养液、胎牛血清(Gibco公司);M-MLV逆转录酶(Promega公司);Lipofectamine 2000、Trizol试剂盒(Invitrogen公司);限制性内切酶、PCR试剂盒 (TaKaRa公 司);MTT、核 糖 核 酸 酶 (Sigma-Aldrich公司);慢病毒载体pLVTHM、psPAX2、pMD2.G(均购自Biovector Science Lab)。
1.2 方法
1.2.1 APRIL siRNA慢病毒载体质粒的设计与构建 根据人APRIL基因mRNA序列(NCBI Reference Sequence:NM_172088.1),通过siRNA“Target Finder Tool”设计软件(GenScrip公司网站提供)设计针对目的基因ARPIL的干扰序列:5’-aaTCCAGGATGCTGGAGTTTA-3’,同时设计阴性 对 照 序 列 (nonsilencing,NS):5’-TTCTCCGAACGTGTCACGT-3’。通 过 BLAST 同 源 性分析,排除了干扰序列非特异性抑制其他基因序列的可能。用化学合成法合成DNA寡核苷酸,退火,并插入到包含绿色荧光蛋白(GFP)的慢病毒载体pLVTHM中,最后将连接产物转化到大肠杆菌DH5α感受态细胞,涂布平板,37℃过夜培养。对长出的单克隆菌落进行PCR鉴定,并通过限制性内切酶分析及DNA测序鉴定。
1.2.2 细胞培养与慢病毒的制备与转染 人胃癌细胞MGC803和293T细胞,于含有10%胎牛血清、100U/ml青霉素和100mg/ml链霉素的RPMI 1640培养基,37℃,5%CO2饱和湿度培养箱内孵育。按Lipofectamine 2000使用说明,将重组的慢病毒质粒与辅助载体共转染293T细胞。转染48h后,收集含有APRIL siRNA和非特异性序列的siRNA慢病毒颗粒的细胞上清液,然后确定此病毒的滴度。测得MGC803细胞在重组慢病毒转染3天后的感染复数(MOI)为20。
1.2.3 RT-PCR 检测 APRIL mRNA 的表达 应用Trizol试剂盒,按照试剂盒说明书对MGC803细胞提取总RNA。根据说明书,加入M-MLV逆转录酶42℃,反应60min。APRIL mRNA的表达通过SYBR green PCR master mix分析,反应如下:95℃15s,95℃5s,45个循环,60℃30s。引物设计如下:APRIL正义链:5'-GGTATCCCTGGCAGAGTC-3';反义链:5'-CTGTCACATCGGAGTCATC-3’和humanβ-actin:正 义 链:5'-GGCGGCACCACCATGTACCCT-3';反 义 链:5'-AGGGGCCGGACTCGTCATACT-3'。以管家基因β-actin APRIL的循环阈值为标准对照,测定APRIL的表达。所有实验均重复3次。
1.2.4 MTT比色法检测细胞增殖 取Lenti-siAPRIL和Lenti-NS转染的胃癌细胞,分别接种于96孔培养板,每孔100μl(含细胞数为2 000),每组均设3个复孔。于CO2培养箱中培养至第1,2,3,4和第5天后,各孔分别加入20μl(5mg/ml)的MTT,继续孵育4h。吸弃培养上清,加入150μl二甲基亚砜(DMSO),充分混合10min,用酶标仪于570nm处测定OD值。计算各组3个复孔的平均值,绘制计算细胞生长曲线。
1.2.5 流式细胞仪分析细胞周期变化 收集转染效率在80%以上的细胞,用D-Hanks液清洗,70%的预冷乙醇固定,4℃,1h。PBS洗涤2次,加入50 μg/ml的PI和100μg/ml的 RNase,室温,避光5 min后,用流式细胞仪测定,实验重复3次。
1.2.6 统计分析 采用SPSS13.0软件,组间比较用方差分析,P≤0.05为差异有统计学意义。
2 结果
2.1 荧光显微镜观察重组慢病毒转染的效率
重组慢病毒转染MGC803细胞72h后,通过荧光显微镜可观察转染成功的细胞,在470-490 nm光激发下发出绿色荧光(图1)。转染效率超过90%,说明慢病毒包装成功,且转染效率较高。

图1 荧光显微镜观察重组慢病毒转染的效率
2.2 Lenti-siAPRIL对APRIL基因表达的影响
本研究对非特异序列载体转染组和Lenti-siAPRIL的APRIL mRNA表达水平进行了检测。如图2所示:Lenti-siAPRIL转染MGC803细胞的APRIL mRNA水平均显著减少68.1%(P<0.01)。
2.3 Lenti-siAPRIL对细胞增殖的影响
Lenti-siAPRIL转染的 MGC803细胞与Lenti-NS转染的细胞分别在第2,3,4和5天后检测细胞增殖情况。细胞生长曲线显示(图3):与Lenti-NS组相比,Lenti-siAPRIL转染细胞组的增殖能力明显下降(P<0.05)

图2 RT-PCR对APRIL基因干扰效果的检测
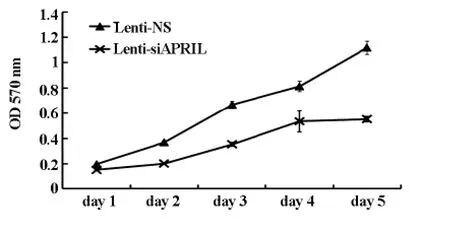
图3 MTT实验检测细胞增殖
2.4 Lenti-siAPRIL对细胞周期的影响
我们对 Lenti-NS转染组和 Lenti-siAPRIL 转染组转染3d后进行了流式细胞仪细胞周期检测,结果如图4所示。在图4中,与对照组相比,Lenti-siAPRIL组的细胞在S期和G2/M期细胞周期阶段的百分比增加;而在G0/G1期细胞比例显著降低。提示Lenti-siAPRIL组胃癌细胞增殖被阻滞在G2/M期。

图4 流式细胞仪检测细胞周期
3 讨论
目前,胃癌仍然是威胁人类健康的重要杀手,在缺乏对胃癌的早期诊断和检测策略的情况下,胃癌的预后仍然较差[4]。在癌症发展过程中,基因异常经常可以监测到,例如:基因突变或者参与肿瘤的生存、发展和转移的基因扩增。对于胃癌,一系列特定基因(癌基因和抑癌基因)突变已被发现,其中包括APRIL 基因[5]。
APRIL作为肿瘤坏死因子(TNF)家族的新成员,它在动物模型中显示出促进肿瘤增殖的作用,例如:APRIL过度表达诱导B细胞淋巴瘤[6]。然而,APRIL促进肿瘤增殖并不局限于B细胞淋巴瘤。事实上,APRIL对实体瘤也提供生存/增殖信号。虽然并未在体外检测到,但这种APRIL在肿瘤细胞过表达的现象,已在体内观察到[7-9]。
RNA干涉(RNAi)是双链 RNA(double-stranded RNA,dsRNA)引发的转录后基因沉默。以某个基因为靶标的dsRNA被导入宿主细胞,可以使其mRNA发生特异性降解,导致相应的基因沉默[10]。慢病毒是一种逆转录病毒,其最大的特点是转染分裂期细胞的同时,还可以转染非分裂期细胞,并可在宿主体内长期表达[11]。
在这项研究中,实验结果表明,我们构建的Lenti-siAPRIL慢病毒质粒能有效地转染人胃癌MGC803细胞。与非特异序列转染组相比,LentisiAPRIL组显著抑制了APRILmRNA表达;同时,Lenti-siAPRIL能抑制细胞增殖,提示:APRIL可调节GC细胞的增殖。此外,APRIL基因的沉默导致在S期和G2/M期细胞比例显着增加,这表明,APRIL siRNA抑制细胞增殖,通过将细胞阻滞在G2/M期。APRIL通过调节细胞周期发挥其作用,这种调节作用的进一步研究,将有助于我们更好地理解胃癌的分子机制。
综上所述,我们成功构建了人APRIL慢病毒siRNA干扰载体,且验证了慢病毒介导的RNA干扰能够有效抑制APRIL的表达。慢病毒介导的siRNA有效地抑制细胞增殖,且细胞周期被阻滞在G2/M期。该研究对后继的APRIL基因为靶点的胃癌的治疗研究奠定了基础。
[1]Hahne M,Kataoka T,Schroter M,et al.APRIL,a new ligand of the tumor necrosis factor family,stimulates tumor cell growth[J].J Exp Med,1998,188(6):1185.
[2]Yaccoby S,Pennisi A,Li X,et al.Atacicept(TACI-Ig)inhibits growth of TACI(high)primary myeloma cells in SCID-hu mice and in coculture with osteoclasts[J].Leukemia,2008,22(2):409.
[3]Kelly K,Manos E,Jensen G,et al.APRIL/TRDL-1,a tumor necrosis factor-like ligand,stimulates cell death[J].Cancer Res,2000,60(4):1026.
[4]Resende C,Ristimaki A,Machado JC.Genetic and epigenetic alteration in gastric carcinogenesis[J].Helicobacter,2010,15(1):35.
[5]Chiu A,Xu W,He B,et al.Hodgkin lymphoma cells express TACI and BCMA receptors and generate survival and proliferation signals in response to BAFF and APRIL[J].Blood,2007,109(2):737.
[6]Chu VT,Enghard P,Riemekasten G,et al.In vitro and in vivo activation induces BAFF and APRIL expression in B cells[J].J Immunol,2007,179(9):5956.
[7]Mhawech-Fauceglia P,AllaAl,Odunsi K,et al.Role of the tumour necrosis family ligand APRIL in solid tumour development:Retrospective studies in bladder,ovarian and head and neck carcinomas[J].European journal of cancer,2008,44(15):2099.
[8]Wang F,Ding W,Wang J,et al.Identification of microRNA-target interaction in APRIL-knockdown colorectal cancer cells[J]Cancer Gene Therapy,2011,18(7):507.
[9]Roosnek E,Burjanadze M,Dietrich PY,et al.Tumors that look for their springtime in APRIL[J].Crit Rev Oncol Hematol,2009,72(2):95.
[10]Romano G.Current development of lentivial-mediated gene transfer[J].Drug News Perspect,2005,18(2):132.
[11]Fish RJ,Kruithof EK.Short-term cytotoxic effects and longterm instability of RNAi delivered using lentiviral vectors[J].BMC Mol Biol,2004,5:9.

