根管预备后的牙本质壁对兔骨髓间充质干细胞生长的影响
黄 杨,李康婧,陈文霞
(广西医科大学附属口腔医院,广西南宁 530021)
有效的控制根管内感染是牙髓血管化再生术(pulp revascularization)成功的关键因素,根管感染控制的方法包括根管预备(机械、化学)和药物消毒。Banchs等(2004)[1]最早报告的临床病例中采用了米诺环素、环丙沙星、甲硝唑三联抗生素进行根管消毒,以后的学者多沿用该方法[2-4]。而在 Cehreli等[5]报告的一系列临床病例中,所有病例均以氢氧化钙进行根管消毒,部分病例采用了机械预备。然而,学者们对于根管消毒药物的甄选以及根管是否需进行机械预备,仍存在不同的观点。本研究通过采用不同的方法对根管进行感染控制,观察处理后根管内壁微环境的改变对骨髓间充质干细胞生物学行为的影响,为临床应用提供理论依据。
1 材料和方法
1.1 主要材料和仪器
新西兰大白兔(广西医科大学动物实验中心);低糖 DMEM培养基(含 100 mL/L FBS,100 U/mL青霉素,100 μg/mL 链霉素)(Hyclone);ProTaper(Dentsply);细胞碱性磷酸酶活性染色试剂盒(GENMED);扫描电镜(TESCAN);能谱仪(EDAX)。
1.2 兔骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)原代培养
选取3周龄新西兰大白兔1只,处死后750 mL/L乙醇浸泡消毒。无菌环境中取出股骨,PBS冲洗3次,剪断干骺端,用DMEM冲出骨髓,1000 r/min离心5 min,弃上清,DMEM重悬细胞,接种于培养瓶中,置37℃,50 mL/L CO2,饱和湿度的细胞培养箱内孵育,24 h细胞贴壁生长后,更换DMEM,以后隔日换液。待细胞生长融合达到80% ~90%时,2.5 g/L胰蛋白酶消化,1∶2比例常规传代。
1.3 根管预备及消毒
收集5个新鲜拔除的患根尖周炎的下颌第三磨牙,共7个牙根,浸泡于生理盐水中,-20℃保存。纳入标准:牙冠龋损穿髓;X线片示根尖周稀疏区。排除标准:牙根纵裂;牙根未发育完成;患牙有治疗史。冰冻牙齿缓慢复温至室温,超声清除牙石,手术刀片刮除牙周膜,沿釉牙骨质界去除牙冠,随机分成3组进行处理。
A组:采用冠下法预备根管,用10号和15号K型锉疏通根管,ProTaper锉根据产品指导进行根管预备至主尖锉 F3,每次更换器械以 5 mL 52.5 mL/L次氯酸钠液冲洗根管。预备完成后,将片剂米诺环素、环丙沙星、甲硝唑研磨成粉末,将等质量的3种抗生素粉末与生理盐水调和成糊剂,置根管内进行消毒。
B组:采用冠下法预备根管,方法同A组。预备完成后,将氢氧化钙糊剂置根管内进行消毒。
C组:不进行机械预备,仅用5 mL 52.5 mL/L次氯酸钠液冲洗根管后,以氢氧化钙糊剂进行根管内封药消毒。
3组样本根管口均以氧化锌水门汀进行封闭,浸泡于生理盐水中,4℃保存7 d后,取各组样本以裂钻去除根管口氧化锌,5 mL 52.5 g/L次氯酸钠液冲洗根管,150 g/L EDTA液超声冲洗根管1 min。然后将各组样本沿根管长轴纵向劈开牙根,暴露根管壁,共得到14个牙根片,分别浸泡于PBS中,超声水浴处理5 min,4℃保存于含100 U/mL青霉素和100 μg/mL链霉素的灭菌PBS液中。每组随机抽取一个牙根片扫描电镜观察根管壁情况。
1.4 根管牙本质壁对BMSCs生物学行为的影响
1.4.1 细胞接种和共同培养
各组牙根片用灭菌PBS液清洗3次,置24孔培养板中。将贴壁生长的第3代兔骨髓间充质干细胞用2.5 g/L胰蛋白酶消化后,制成单细胞悬液,以104/mL密度接种于牙根片的根管内壁。置37℃,50 mL/L CO2,饱和湿度的细胞培养箱内孵育。24 h更换DMEM,以后隔日换液。
1.4.2 扫描电子显微镜观察
于接种细胞第7天,各组随机抽取1个牙根片分别以PBS洗3次,25 mL/L戊二醛4℃固定2 h,脱水,干燥,真空离子溅射镀金,电镜下观察并对表面进行能谱分析。
1.4.3 细胞碱性磷酸酶染色
接种细胞第14天,取各组所余牙根片以灭菌PBS洗3次,用25 g/L胰蛋白酶37℃消化1 min,DMEM终止消化,1000 r/min离心5 min,重悬,接种于6孔细胞培养板,另取一6孔板接种第3代兔骨髓间充质干细胞,用于空白对照。然后将所有6孔板置37℃,50 mL/L CO2,饱和湿度的细胞培养箱内孵育。
2 d后弃原培养基,加入清理液清洗细胞表面;弃清理液,加入固定液,室温下孵育60 s;弃固定液,清理液清洗细胞表面3次。加入染色液,37℃暗室孵育30 min,清理液清洗。显微镜观察,对阳性细胞和阴性细胞进行计数,计算阳性率。
2 结果
2.1 兔BMMSCs原代培养
原代培养24 h,可见大部分细胞贴壁生长,多数贴壁细胞外形呈长梭形的成纤维细胞样或呈多边形。48 h形成细胞克隆。细胞生长达到80%~90%融合时传代,平均3 d传代1次。传代细胞生长旺盛,第3代以后形态稳定,部分区域细胞呈漩涡状生长(图1)。
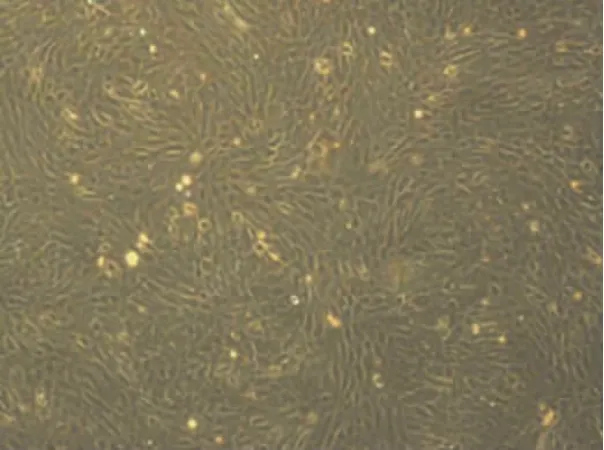
图1 第3代兔骨髓干细胞,形态稳定,部分区域细胞呈漩涡状生长(倒置显微镜,×40)
2.2 扫描电镜观察
经机械预备的A、B组根管内壁牙本质无明显差别,根管内壁均存在少量散在块状碎屑,部分牙本质小管被碎屑封闭,多数牙本质小管口呈开放状,可见松散的胶原(图2a、b)。未经机械预备的C组根管内壁分布有呈云雾状的胶原纤维,基本无碎屑存在,多数牙本质小管口开放(图2c、d)。
A,B,C 3组牙本质支架与兔骨髓干细胞复合培养7 d,扫描电镜均可以观察到细胞伸展充分,交叠生长呈网状覆盖根管内壁(图3),形态呈多边形,突触多而不规则,附着于管间牙本质,并互相连接,使胞体紧贴根管内壁,但未发现有细胞突触伸入开放的牙本质小管内的现象。个别细胞表面可见分泌的基质小泡,大小、形态不一(图4)。能谱分析其主要元素为钙、磷、碳、氧。
2.3 碱性磷酸酶染色结果
以细胞质内出现灰褐色至黑色沉淀作为碱性磷酸酶染色阳性结果。A,B,C 3个诱导组均有细胞表达碱性磷酸酶,呈不同程度的阳性反应(图5)。3组的阳性率分别为:A组2.39%,B组32.59%、C组31.10%(表1)。统计学分析各组内样本间无统计学差异(P>0.05),A组阳性率低于B组与C组(P <0.05),B组和C 组无差异(P >0.05)。

表1 细胞碱性磷酸酶表达 (n=3)
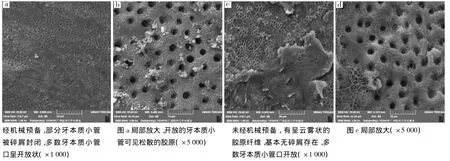
图2 根管内壁表面情况

图3 各组根管内壁细胞粘附、生长情况

图4 各组根管内壁细胞生长情况和形态

图5 各组细胞碱性磷酸酶活性染色(×40)
3 讨论
牙髓再生是牙髓病和根尖周疾病临床治疗的理想目标,干细胞以及诱导干细胞迁移、分化的微环境,是牙髓血管化再生术和组织工程技术重建牙髓成功的必要条件。牙本质是成牙本质细胞分泌的细胞外基质的矿化产物,由于具有组织结构的多孔性,以及脱矿后可以释放生物活性分子的特性,使其成为一种较理想的生物支架。近年来,许多研究陆续报道了各种牙源性干细胞与牙本质支架复合体在体外或体内培养的结果[6-9],虽然处理方式不尽相同,但是都表明健康的牙本质可以为种子细胞提供粘附、增殖和分化的微环境。其中牙本质非胶原蛋白的作用已得到普遍认同,可以诱导成骨、成牙本质分化,参与基质形成和矿化的调控[10]。对于慢性根尖周炎患牙,细菌可侵入根管牙本质小管深部达140 ~ 1000 μm[11],因此,寻求有效控制感染同时使牙本质内生物活性成分释放的手段,可以为临床应用参考。
本研究采用不同的根管预备方法和不同的根管消毒药物进行根管感染控制,采用处理后的根管内壁牙本质作为支架,在体外与BMMSCs进行复合培养。扫描电子显微镜下观察可见经过3种不同组合方式处理后的牙本质壁表面均有细胞粘附生长,细胞突触多而不规则,与成骨细胞较为相似。部分细胞表面可观察到大小不一的基质小泡,主要含钙、磷、碳、氧元素。推测小泡内含羟基磷灰石晶体。这表明3种组合处理后的根管内壁均能为BMMSCs的生长提供适宜的微环境。采用机械处理的B、C两组细胞形态和碱性磷酸酶染色无明显差别,说明机械预备后,胶原纤维的减少和碎屑的残留,对细胞附着与伸展的影响不明显。
本研究在不同的处理组合中采用了米诺环素、环丙沙星、甲硝唑三联抗生素与氢氧化钙进行根管内消毒。三联抗生素糊剂作为牙髓血管化再生术临床上用于根管消毒药物的经典组合,可以发挥广谱抗菌作用,但其导致牙齿颜色的改变成为临床应用的主要缺陷,另外有报道米诺环素能显著抑制成骨细胞ALP的活性[12]。本研究试图探讨采用氢氧化钙进行根管消毒对干细胞生长的影响。结果显示:采用三联抗生素的A组与采用氢氧化钙的B组细胞碱性磷酸酶活性染色阳性率有显著不同,这可能与三联抗生素中的米诺环素抑制ALP活性有关;而氢氧化钙是一种疗效肯定的根管消毒药物,在临床上常作为盖髓剂或诱导根尖形成的药物,可以促进根尖硬组织沉积,也有研究证实氢氧化钙具有提高成骨细胞碱性磷酸酶的活性的作用[13-14]。
本结果提示:①对感染根管不论是机械预备或单纯采用有效的化学预备,结合超声和根管内药物消毒,根管内壁牙本质均可以为干细胞的生长提供适宜的微环境;②氢氧化钙可促进干细胞碱性磷酸酶的表达。但仍需要进一步的深入研究以增强临床应用的可靠性。
[1]Banchs F,Trope M.Revascularization of immature permanent teeth with apical periodontitis:new treatment protocol?[J]J Endod,2004,30(4):196-200.
[2]Ding RY,Cheung GS,Chen J,et al.Pulp revascularization of immature teeth with apical periodontitis:a clinical study[J].J Endod,2009,35(5):745-749.
[3]Wang X,Thibodeau B,Trope M,et al.Histologic characterization of regenerated tissues in canal space after the revitalization/revascularization procedure of immature dog teeth with apical periodontitis[J].J Endod,2010,36(1):56 -63.
[4]钟小奕,杨亦萍,陈文霞,等.年轻恒前牙感染根管内血管再生的动物实验研究[J].华西口腔医学杂志,2010,28(6):672-674.
[5]Cehreli ZC,Isbitiren B,Sara S,et al.Regenerative endodontic treatment(revascularization)of immature necrotic molars medicated with calcium hydroxide:a case series[J].J Endod,2011,37(9):1327-1330.
[6]Guo W,He Y,Zhang X,et al.The use of dentin matrix scaffold and dental follicle cells for dentin regeneration[J].Biomat,2009,30(35):6708 -6723.
[7]Huang GT,Sonoyama W,Chen J,et al.In vitro characterization of human dental pulp cells:various isolation methods and culturing environments[J].Cell Tissue Res,2006,324(2):225 -236.
[8]Batouli S,Miura M,Brahim J,et al.Comparison of stem -cell- mediated osteogenesis and dentinogenesis[J].J Dent Res,2003,82(12):976-981.
[9]Gotlieb EL,Murray PE,Namerow KN,et al.An ultrastructural investigation of tissue-engineered pulp constructs implanted within endodontically treated teeth[J].J Am Dent Assoc,2008,139(4):457-465.
[10]Goldberg M,Smith AJ.Cells and extracellular matrices of dentin and pulp:a biological basis for repair and tissue engineering[J].Crit Rev Oral Biol Med,2004,15(1):13-27.
[11]Guo H,Yue L,Gao Y.Status of bacterial colonization in infected root canal[J].Beijing Da Xue Xue Bao,2011,43(1):26-28.
[12]张文怡,刘洪臣,吴霞.米诺环素对体外培养的成年大鼠牙槽骨成骨细胞生物活性的影响[J].中华老年口腔医学杂志,2007,5(3)173-176.
[13]陈筠,史俊南,肖明振.氢氧化钙对人牙髓细胞碱性磷酸酶基因表达的作用[J].牙体牙髓牙周病学杂志,1991,1(1):45-48.
[14]梁宇红,王嘉德,于世凤.氢氧化钙调节骨代谢的体外研究[J].中华口腔医学杂志,2000,35(2)112-114.

