纳米羟基磷灰石材料复合碱性成纤维细胞因子促进牙周组织再生的实验研究
鲁 红,田 宇,吴织芬,王小勇
(1.第四军医大学口腔医学院,陕西西安 710032;2.军事科学院门诊部,北京 100091)
应用组织工程技术有望实现真正意义上的牙周再生[1],而选择理想的生长因子载体和组织工程支架材料则是组织工程研究需要解决的首要问题[2]。纳米羟晶/胶原仿生骨材料(nano-Hap/Collagen,nHAC)是一种新型纳米羟基磷灰石材料,它仿照天然骨结构将胶原与羟基磷灰石复合,并用聚乳酸(Poly Lactic acid,PLA)修饰,从而在纳米结构上与天然骨极为接近,具有良好的孔隙率和生物相容性[3],如将其应用于牙周组织再生修复应能为牙周膜细胞(periodontal ligament cells,PDLCs)在缺损区的生长和分化提供支架和传导作用,而若与碱性成纤维细胞生长因子(bFGF)等生长因子联合应用,则亦应能增加对PDLCs的诱导分化作用。基于以上研究思路,本研究拟先通过体外研究观察nHAC的支架结构和细胞相容性;再将bFGF与nHAC三维支架材料复合植入动物人工牙周缺损区,观察分析其对牙周组织再生修复的影响和作用,以期为牙周组织工程生长因子载体和支架材料的选择和应用提供实验室依据,并为组织工程技术在牙周病治疗方面的应用奠定实验基础。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养液、胎牛血清(FBS)(Gibco,美国);胰蛋白酶(Sigma,美国);nHAC(清华大学材料系研制,清华大学崔福斋教授、廖素三博士惠赠);S-520扫描电镜(日本);rh-bFGF(宝泰克生物技术有限公司);e-PTFE膜(上海塑料研究所);组织切片机(Leitz,德国);显微镜用测微尺(上海第三光学仪器厂);倒置显微镜和照相系统(Olympus,日本)。
1.2 HPDLCs在nHAC支架材料上附着、生长情况
1.2.1 nHAC 的预处理
取横截面直径为5 mm的nHAC圆柱体,根据实验需要垂直于长轴切割成直径为5 mm、厚1 mm的圆片,钴60灭菌备用。
1.2.2 HPDLCs的体外培养
取因正畸需要拔除的新鲜第一前磨牙,刮取根中1/3牙周膜组织,剪成1 mm×1 mm×1 mm碎块,铺于培养瓶底,加入含 100 mL/L FBS的α-MEM培养液,在饱和湿度、50 mL/L CO2、950 mL/L空气、37℃标准环境下孵育。待细胞汇合达瓶底80%时,2.5 g/L胰蛋白酶消化并传代,取4~8代细胞用于实验。
1.2.3 HPDLCs接种至 nHAC 支架
取生长良好的第4代HPDLCs用2.5 g/L胰蛋白酶消化,1000 r/min离心7 min,收集细胞,用α-MEM培养液漂洗2遍后重悬,并调整细胞密度为5×106/mL。然后取0.2 mL细胞悬液分别接种于3个nHAC圆片上,并经负压抽吸使细胞悬液充分进入nHAC的多孔间隙后,小心将负载细胞的nHAC圆片移至24孔板中,标准环境下孵育。2 h后再小心加入2 mL含100 mL/L FBS的α-MEM培养液,继续培养,每24 h换液1次。
1.2.4 扫描电镜观察
培养72 h后,取PDLCs/nHAC三维立体培养标本用30 mL/L戊二醛固定,乙腈系列脱水,真空干燥,喷金镀膜后扫描电镜观察HPDLCs在nHAC支架上附着、生长情况。
1.3 nHAC复合bFGF对牙周组织再生修复的影响
1.3.1 bFGF 与 nHAC 的复合
取一定量的bFGF直接溶于适量无菌蒸馏水中,然后加入一定数量的nHAC颗粒并进行真空抽吸,以使溶液尽可能吸入材料孔隙中,经冻干即得到复合的bFGF/nHAC,环氧乙烷消毒备用。
1.3.2 牙周组织缺损模型的制备和处理
取1~2岁、体质量15~20 kg的健康雄性杂种犬6只(第四军医大学西京医院实验动物中心提供),常规麻醉后,以每只犬下颌两侧第2、3、4前磨牙共36个牙为实验牙,翻开龈瓣,分别在每个牙的根分叉区制备颊舌向深度约为3.5 mm,垂直向高度约为4 mm的人工牙周组织缺损区,彻底刮除暴露于根面的牙周膜和牙骨质,并用细裂钻在缺损区根面上作平齐于牙槽骨嵴的切迹,作为组织学观察的标志点。然后将36个牙随机分为空白对照组、单置 e-PTFE膜(单纯引导组织再生)组和nHAC/bFGF加e-PTFE膜组。nHAC/bFGF/e-PTFE膜组植入nHAC-bFGF(经计算,每个牙位放置的 bFGF 量约为27 μg,nHAC 量约为 2.4 g),缝合固定e-PTFE膜,最后缝合龈瓣,上塞治剂。单置e-PTFE膜组只覆盖e-PTFE膜,空白对照组不作任何处理直接缝合。所有动物术后连续3 d肌注庆大霉素预防术后感染,且均进流食。
术后6周在麻醉下行二次手术,取出两实验组的e-PTFE膜,并观察e-PTFE膜下根分叉区新生肉芽组织生长情况。
1.3.3 取材和组织学观察
术后8周处死所有动物并取材,标本分切,脱钙,组织切片,常规HE染色和改良Mallory三色法染色,光镜下观察新生牙周组织生长情况,并对其进行组织学测量。测量指标包括:①骨缺损高度(defect height,DH):根分叉顶至根方切迹底间距离;②新生牙槽骨高度(new bone formation,NB):根方切迹底至新生牙槽骨冠方顶间距离;③新生牙骨质高度(new cementum formation,NC):根方切迹底至新生牙骨质冠方顶间距离;④新生结缔组织附着(new connective tissue,CT):根方切迹底至根分叉顶新生结缔组织附着高度。
1.4 统计学分析
Excel 2003和SPSS 18.0软件进行ANOVA方差分析,两两比较用SNK-t检验,检验水准α=0.05。
2 结果
2.1 HPDLCs在nHAC上生长的形态学观察
扫描电镜低倍视野下可见HPDLCs在nHAC上生长茂密,细胞密度高(图1);高倍视野下可见nHAC具有良好的多孔网状结构,而HPDLCs在nHAC上生长旺盛,伸展充分,贴附牢固,细胞多呈长梭形,多围绕孔隙或跨孔隙生长(图2)。
2.2 术后6周膜下根分叉区新生肉芽情况
术后6周取膜时,可见根分叉牙周缺损处已被新生肉芽组织充满,肉芽质地柔软,与根面贴附紧密,无炎性渗出。
2.3 术后8周实验部位肉眼观察结果
各组动物实验牙术区组织愈合良好,龈沟深度不超过1 mm,无明显牙周炎症,个别牙有1 mm左右的龈退缩。
2.4 组织学观察和测量
光镜下对动物组织切片进行组织学观察可见:nHAC/bFGF/膜组较空白对照组和单置e-PTFE膜组有更多的新生牙槽骨、新生牙周膜和新生牙骨质样组织生长,且未见上皮长入。新生牙槽骨几乎充满根分叉区;其新沉积的牙骨质从切迹底向冠方延伸,覆盖根分叉的大部分区域;在牙周膜间隙内有平行及斜行的类Sharpey纤维插入新生牙槽骨和新生牙骨质(图3)。而单置e-PTFE膜组新生组织量较nHAC/bFGF/膜组少,新生牙槽骨部分再生,未能充满根分叉区,根分叉顶端胶原纤维大部分与牙面平行,新生牙骨质不完全(图4)。空白对照组新生牙周组织量更少,主要位于切迹内,并有大量上皮长入(图5)。
各组新生牙周组织的量化比较(表1)可见:各组 DH 无显著性差异(P >0.05),而 NB、NC、CT 等指标均以 nHAC/bFGF/膜组最高,其次为单置e-PTFE膜组,空白对照组最低。各指标3组间相比差异均有统计学意义(P﹤0.05)。
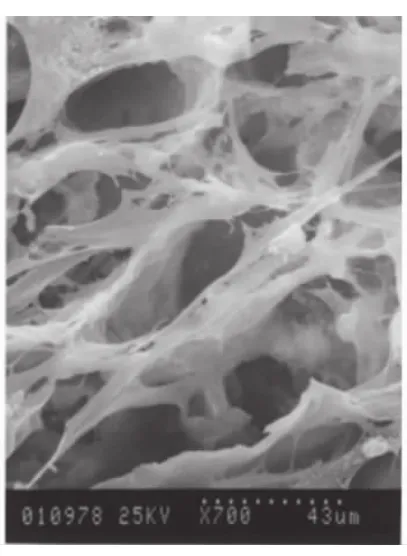
图2 HPDLCs伸展充分,围绕孔隙或跨孔隙生长,可见nHAC的多孔网状结构(SEM,×700)

图3 术后8周nHAC/rh-bFGF/膜组根分叉牙周缺损处新生牙周组织几乎充满根分叉区,未见上皮长入(三色法,15 ×1.3)
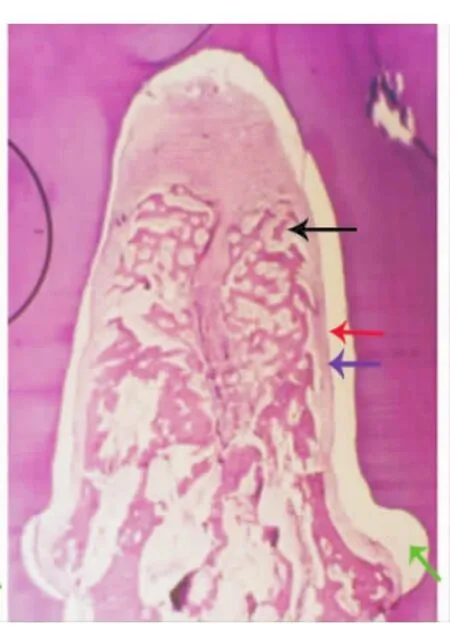
图4 术后8周单置e-PTFE膜组根分叉区新生牙周组织不完全,未见上皮长入(HE,15×1.3)
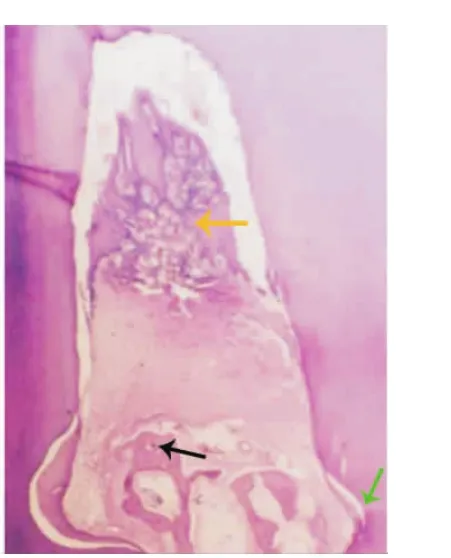
图5 术后8周空白对照组根分叉区新生牙周组织量少,主要位于切迹内,并有大量上皮长入(HE,15 ×1.3)
表1 各组DH、NB、NC、CT等指标比较(mm,)

表1 各组DH、NB、NC、CT等指标比较(mm,)
不同字母组间P﹤0.05
DH NB NC CT空白对照组 12 4.26 ±0.21a 1.18 ±0.13a 1.26 ±0.10a 1.14 ±0.12组别 n a单置 e-PTFE 膜组 12 4.39 ±0.19a 2.82 ±0.18b 2.55 ±0.16b 2.65 ±0.13b nHAC/bFGF/膜组 12 4.22 ±0.17a 3.87 ±0.17c 3.82 ±0.20c 3.90 ±0.22c
3 讨论
理想的组织工程载体应满足以下要求[4]:①良好的生物相容性;②良好的生物降解性,且其降解速率必须与植入的细胞组织形成的速率相匹配;③良好的材料-细胞作用界面,利于细胞的粘附和增殖;④具有多孔性结构和一定的坚韧性,能支撑一定的三维立体结构,可提供种子细胞渗透和新生组织生长繁殖的足够空间;⑤具有良好的可塑性,可以根据需要加工成各种形状和大小。本研究应用的nHAC是一种纳米尺寸的仿生骨材料,它在纳米结构上与天然骨极为接近,因而具有更好的孔隙率和生物相容性[5],其孔隙率高达80% ~90%,孔径为100~600 μm,降解速率为6个月可降解80%以上,并已有研究证实此新型仿生骨材料促进和加快骨创愈合的作用明显[3]。据此,本研究拟通过将体外培养的人PDLCs接种到nHAC三维支架上复合立体培养,使nHAC与牙周组织的主要功能细胞(PDLCs)直接接触,观察HPDLCs在nHAC三维支架上的生长情况,以初步评价nHAC的细胞相容性和应用于牙周组织工程的可行性。本研究中扫描电镜观察可见nHAC具有良好的多孔网状结构,人HPDLCs在nHAC上贴附紧密,伸展充分,生长旺盛,提示nHAC具有良好的细胞相容性。
bFGF是一种能与肝素特异性结合的活性多肽,是中胚层和神经外胚层来源细胞的主要有丝分裂原和形态发生因子,具有广泛的生物学作用[6]。体外实验证实它能促进软骨前体细胞的分化和软骨细胞的增殖和成熟,增加异体骨基质诱导成骨量[7]。bFGF还是毛细血管增殖刺激剂,能够促进毛细血管向骨断端和骨移植物中生长,对成骨细胞的基因进行调节,促进骨形成[8]。有研究报道:bFGF与移植物的结合可增强移植物骨化,这与其促进血管形成,激活成骨细胞的活性有关[9],Argün等[10]观察到bFGF与脱矿骨基质结合后植入骨质缺损区,能够增加骨质形成量,在牙周领域,Shirakata[11-12]等经动物实验,证实将 bFGF 应用于牙周组织缺损修复,可促进牙周组织的再生重建。本研究拟在前期研究基础上将bFGF与纳米羟基磷灰石材料-nHAC相复合,bFGF赋予nHAC组织诱导活性,而nHAC则充当bFGF的载体支架,将此复合物应用于牙周缺损修复,为防止上皮向缺损部位长入,同时结合GTR技术,结果可见nHAC/bFGF复合体可明显促进新生牙槽骨、新生牙骨质和新生牙周膜的生成,与空白对照组和单置e-PTFE膜组相比,具有显著性差异,且实验部位未见炎症反应,从而证实bFGF与nHAC体内复合植入可更有效地促进牙周组织再生和重建,并进一步证实了nHAC良好的生物相容性和作为生长因子载体和牙周组织工程支架材料的应用潜能。
[1]Chen FM,Jin Y.Periodontal tissue engineering and regeneration:current approaches and expanding opportunities[J].Tissue Eng Part B Rev,2010,16(2):219-255.
[2]Gloria A,De Santis R,Ambrosio L.Polymer-based composite scaffolds for tissue engineering[J].J Appl Biomater Biomech,2010,8(2):57-67.
[3]Li J,Hong J,Zheng Q,et al.Repair of rat cranial bone defects with nHAC/PLLA and BMP-2-related peptide or rhBMP-2[J].J Orthop Res,2011,29(11):1745-1752.
[4]Gloria A,De Santis R,Ambrosio L.Polymer-based composite scaffolds for tissue engineering[J].J Appl Biomater Biomech,2010,8(2):57-67.
[5]Han X,Liu H,Wang D,et al.Alveolar bone regeneration around immediate implants using an injectable nHAC/CSH loaded with autogenic blood-acquired mesenchymal progenitor cells:an experimental study in the dog mandible[J].Clin Implant Dent Relat Res.2011 Jul 11.doi:10.1111/j.1708-8208.2011.00373.
[6]王秀颖,韦永珍,潘乙怀,等.碱性成纤维细胞生长因子对体外培养人牙髓细胞迁移的影响[J].牙体牙髓牙周病学杂志,2010,20(10):558-560.
[7]Zheng YH,Su K,Jian YT,et al.Basic fibroblast growth factor enhances osteogenic and chondrogenic differentiation of human bone marrow mesenchymal stem cells in coral scaffold constructs[J].J Tissue Eng Regen Med,2011,5(7):540-550.
[8]Przybylski M.A review of the current research on the role of bFGF and VEGF in angiogenesis[J].J Wound Care.2009,18(12):516-519.
[9]Qu D,Li J,Li Y,et al.Angiogenesis and osteogenesis enhanced by bFGF ex vivo gene therapy for bone tissue engineering in reconstruction of calvarial defects[J].J Biomed Mater Res A,2011,96(3):543-551.
[10]Argün M,Öner M,Güney A,et al.The healing of full-thickness articular cartilage defects in rabbits:successful results withfibroblast growth factor[J].Eklem Hastalik Cerrahisi,2010,21(3):147-152.
[11]Shirakata Y,Taniyama K,Yoshimoto T,et al.Regenerative effect of basic fibroblast growth factor on periodontal healing in two-wall intrabony defects in dogs[J].J Clin Periodontol,2010,37(4):374-381.
[12]Tan Z,Zhao Q,Gong P,et al.Research on promoting periodontal regeneration with human basic fibroblast growth factormodified bone marrow mesenchymal stromal cell gene therapy[J].Cytotherapy,2009,11(3):317-325.

