年龄因素对人牙周膜干细胞培养和性能的影响
张 璟,杨 昊,高丽娜,安 莹,陈发明,金 岩
(第四军医大学口腔医学院,陕西西安 710032)
牙周病是一种以破坏牙周支持结构,并最终导致牙齿脱落的慢性进展性疾病。据不完全统计:美国有大约30%~40%的成年人患有不同程度的牙周疾病,在我国中老年人群中慢性牙周炎的发病率甚至高达70%,牙周炎的防治面临严峻的形势和挑战[1]。传统牙周治疗方法例如超声洁治、龈下刮治、翻瓣术,以及近年来广泛开展的Vector治疗、各种骨移植术等,都没有达到预期的治疗效果,特别是不能实现牙周组织的生理和功能性再生[2-4]。组织工程研究为牙周病的治疗和牙周缺损的修复开辟了新的研究空间,特别是利用自体(智齿、正畸拔除的牙齿)来源的牙周膜干细胞(periodontal ligament stem cells,PDLSCs)治疗牙周组织丧失在动物体内取得了令人振奋的结果[5],甚至有学者已经开始临床病例的尝试[6]。然而目前开展的基础和临床研究中,多数没有考虑到年龄因素对PDLSCs培养及其生物学特性的影响。本研究通过不同年龄智齿中牙周膜干细胞的分离、培养和对比分析,观察>50岁PDLSCs的生物学性能是否与<30有明显差异,为PDLSCs的应用研究是否要考虑年龄因素提供参考。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清FBS(四季青公司);α-MEM培养基、L-谷氨酰胺、青链霉素(Gibco,美国);2.5 g/L胰蛋白酶(Amresco,美国);Dispase(Roche,美国);I型胶原酶、地塞米松、β-甘油磷酸钠、抗坏血酸、茜素红、油红 O(Sigma,美国);抗 CD29、抗CD31、抗 CD34、抗 CD44、抗 CD90、抗 CD105、抗CD146、抗 STRO-1 抗体(R&D Systems,美国);50 g/L、90 g/L、170 g/L EDTA(Pulpdent,美国);二氧化碳恒温培养箱(ThermoForma,美国);离心机(Kubota2l00,日本);YJ-875 型超净工作台(苏州净化设备厂);倒置相差显微镜和照相系统(IX70)、体视显微镜(Olympus,日本);6孔培养板、平底 96孔板(Falcon,美国);流式细胞仪(Beckman Coulter,Fullerton,CA,美国);超声震荡仪(上海生源器械厂)。
1.2 人牙周膜细胞的原代培养
人牙周膜细胞的原代培养参照文献[7]方法。分别选取无全身性疾病的<30岁和>50岁志愿者因阻生拔除的第三磨牙各4例,拔除后立即用PBS液冲洗3遍后,刮取根中1/3区域的牙周膜组织,切割成约1 mm×1 mm×1 mm大小的组织块,0.01 mol/L PBS液冲洗后,移入离心管内,以1∶1比例加入3 mg/mL的I型胶原酶和4 mg/mL的Dispase的混合液2 mL,37℃培养箱消化15 min。然后再将组织块以5 mm的间隔平整放于6孔板中,上置盖玻片,滴加含100 mL/L胎牛血清的α-MEM培养基,在37℃、50 mL/L CO2培养箱中培养10~14 d,每2~3 d半量换液。待细胞从组织块边缘爬出并生长汇合达80%时,用2.5 g/L胰酶或1 g/L EDTA,pH=6.4消化传代7~10 d。
1.3 有限稀释法克隆化培养人牙周膜干细胞
收集上述培养上清1500 r/min离心10 min,经0.22 μm直径的小滤器过滤后,与培养基以1∶1比例混合作为适应性培养基。取对数生长期的第1代细胞悬液,调整细胞密度至10~15/mL,吹打混匀接种于96孔培养板,每孔100 μL,培养12 h后标记单个细胞孔,并补液至每孔200 μL,5 d换液,待克隆长至孔底1/3~1/2后2.5 g/L胰蛋白酶消化,扩大培养。
1.4 细胞克隆形成能力
取生长良好的第3代细胞,以1×103的密度接种于9 cm的培养皿中常规培养,镜下观察培养皿内克隆情况,14 d终止培养,弃去培养液,用PBS浸洗2次加40 g/L多聚甲醛液固定15 min,弃去固定液,加适量甲苯胺蓝染色15 min,PBS浸洗2次,以不少于50个细胞的集落计为一克隆,并按照下列公式计算克隆形成率。

1.5 MTT法检测生长曲线
取不同年龄段人PDLSCs胰酶消化后制成细胞悬液,以1.5×103个接种于96孔板,每孔加入含100 mL/L FBS 的 α-MEM 培养液180 μL,37 ℃,50 mL/L CO2培养箱中培养,每2 d换液1次。分别于培养后1、2、3、4、5、6、7 d 各取一组细胞,于每孔加入20 μL 5 mg/mL的MTT溶液,继续孵育4 h。然后,吸去培养液,加入150 μL二甲基亚砜液,在振荡器中震荡10 min后,用酶联免疫检测仪测每孔490 nm波长吸光(OD)值。实验重复3次。
1.6 流式细胞仪检测细胞表面分子
取不同年龄段第5代 PDLSCs调整至细胞密度1×106/mL,40 g/L多聚甲醛固定15 min;PBS洗涤2次,分别加入兔抗鼠 STRO-1、CD146和CD105单抗,室温孵育60 min;洗涤后分别加入羊抗兔Ig-FITC,室温避光45 min;流式细胞仪检测细胞表面 CD29、CD44、CD90、CD105、CD34、CD31、STRO-1,CD146的表达水平。
1.7 PDLSCs成脂能力鉴定
取不同年龄段第5代PDLSCs,以5×104/mL的密度接种于6孔板,细胞扩增至90%左右时,加脂肪细胞诱导液(含 1 μmol/L DEC、0.5 mmoL/L IBMX、10 rng/L BPE、100 mmoL/L Indomethacin、100 mL/L FBS的DMEM培养液)诱导培养,每3 d换液1次。培养14 d后,弃原液,PBS冲洗,40 g/L多聚甲醛,油红O染色镜下观察。成脂分化染色后用异丙醇洗脱油红O,在510 nm波长下测定OD值,以之作为成脂分化的定量值。
1.8 PDLSCs成骨能力鉴定
取不同年龄段第5代PDLSCs,以5×104/mL的密度接种于6孔板,待细胞扩增至60%左右时,更换矿化诱导液 (含10 mmoL/L β-甘油磷酸钠、50 μg/mL 维生素 C、1×10-8moL/L 地塞米松、50 mL/L FBS的DMEM培养液)继续培养21 d。镜下观测到细胞聚集并出现圆形结节时,弃诱导液,去离子水漂洗3次,40 g/L多聚甲醛固定30 min,茜素红染色镜下观察。成骨分化染色后,洗脱茜素红,在562 nm波长下测定OD值,并对每个培养孔细胞做蛋白定量,以茜素红OD值与蛋白定量值的比值作为成骨分化的定量值。
1.9 统计学分析
使用SPSS 17.0软件进行统计分析,两独立样本均数比较用t检验,检验水准α=0.05。
2 结果
2.1 牙周膜干细胞的分离和培养
本研究采用消化法培养原代细胞,细胞以组织块为中心向周边扩展,<30岁组3~7 d均有大量细胞长出,而>50岁组最晚,10 d才有细胞爬出组织块;细胞相互接触汇合成片达80%时间<30岁组平均12 d,>50岁组18 d。传代后细胞大多数呈长梭形或短梭形,生长快慢不等,汇合后呈漩涡状生长,胞体丰满,缺乏细长突起,相当数目为三角形或是多角形,但都表现为胞核聚集在中心,胞质形成的突起向外呈放射状,具有成体干细胞的特征(图1)。单克隆挑选培养14 d后,细胞克隆形成能力<30岁组为(31.1±0.926)%,>50岁组为(10.3±0.912)%,两组间差异有统计学意义(P <0.05)(图2)。
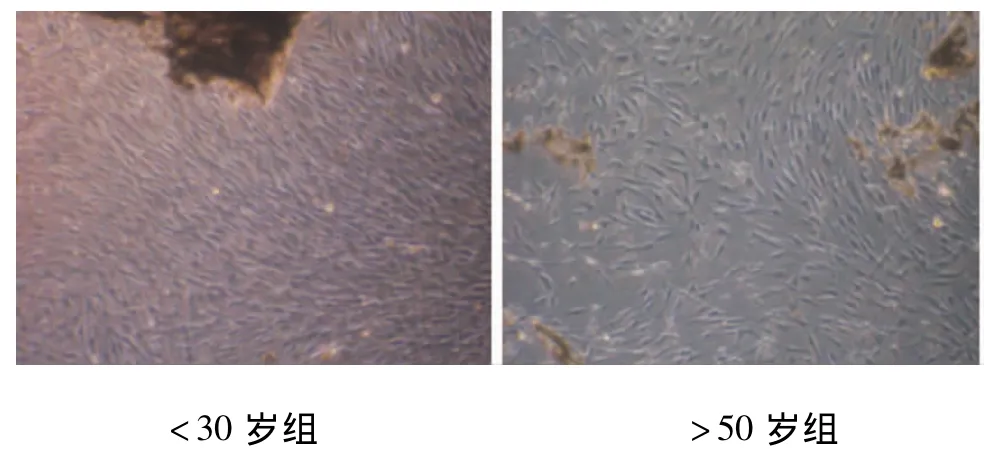
图1 牙周膜干细胞原代培养光镜照片(14 d,×40)

图2 单细胞克隆培养光镜照片(14 d,×20)

图3 MTT法检测细胞生长曲线
2.2 PDLSCs生长情况
MTT法检测见>50岁组细胞生长相对缓慢,与<30岁组相比除第1天外,其他各时间点差异均有统计学意义(P<0.05)(图3)。
2.3 流式细胞分析结果
<30岁与>50岁组牙周膜干细胞表面分子的表达相似,均阳性表达间充质干细胞特异性表面标记 CD29、CD44、CD90、CD105、CD146、STRO -1,阴性表达造血系细胞特异性分子CD34和内皮细胞特异性分子CD31(图4)。
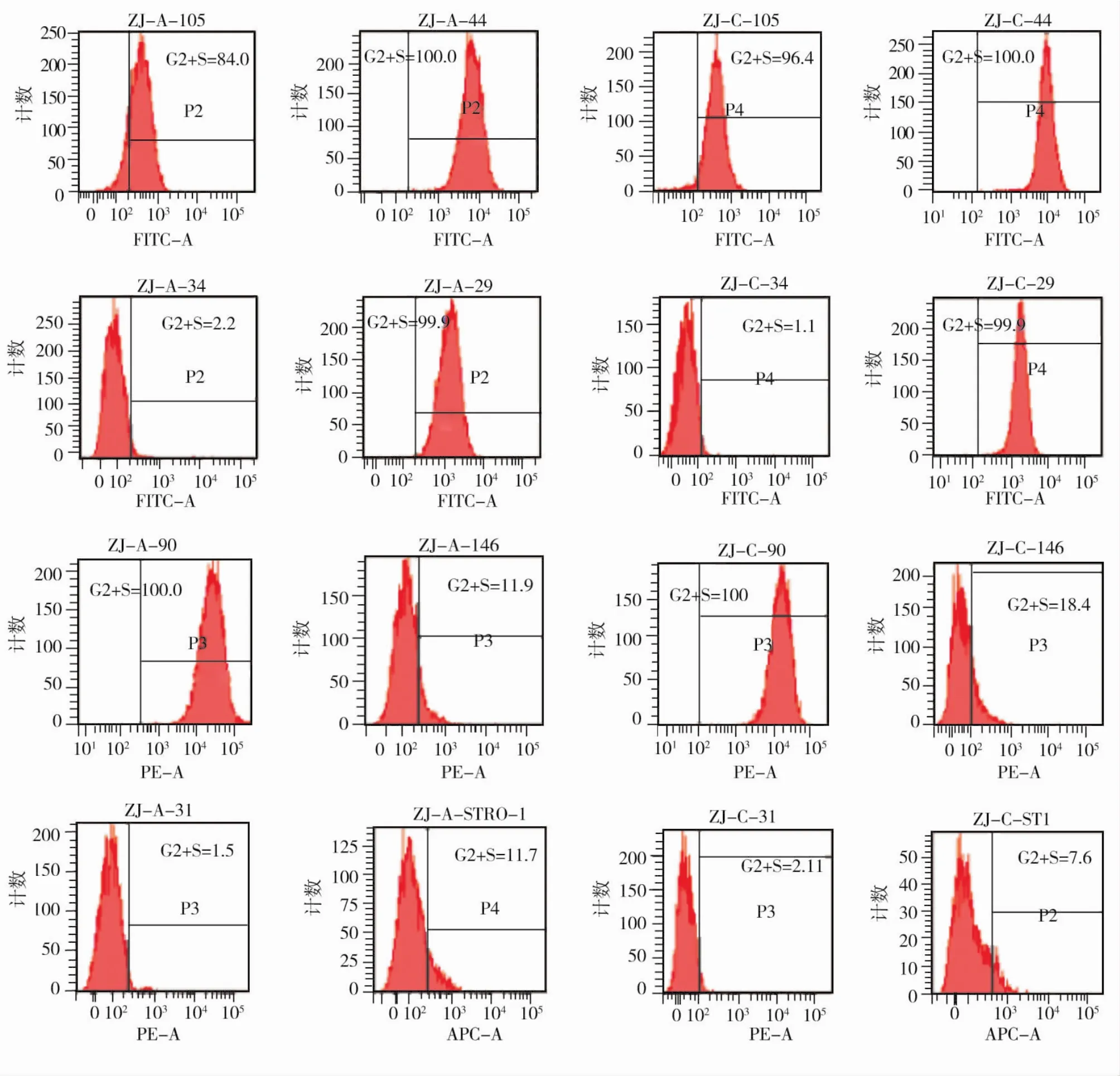
图4 流式细胞仪检查结果
2.4 PDLSCs成脂、成骨能力比较
经成脂诱导液培养至第10天左右,可见细胞形态发生改变,较培养初期更为饱满,至14 d时油红O染色阳性,细胞胞浆内有脂滴形成(图5),成脂量化分析显示,<30岁组为0.898%,>50岁组为0.398%,两组差异有统计学意义(P<0.05);成骨诱导液培养8 d后,细胞呈复层生长,局部增厚,12 d左右中央出现许多颗粒样改变,并逐渐连接成片,密度增高。21 d左右孔板底部出现肉眼可见针尖大小灰白色小结节,并逐渐增大,茜素红染色可见红色矿化结节(图6)。成骨量化分析显示 <30岁组为1.11%,>50岁组为0.64%,两组差异亦有统计学意义(P <0.05)。
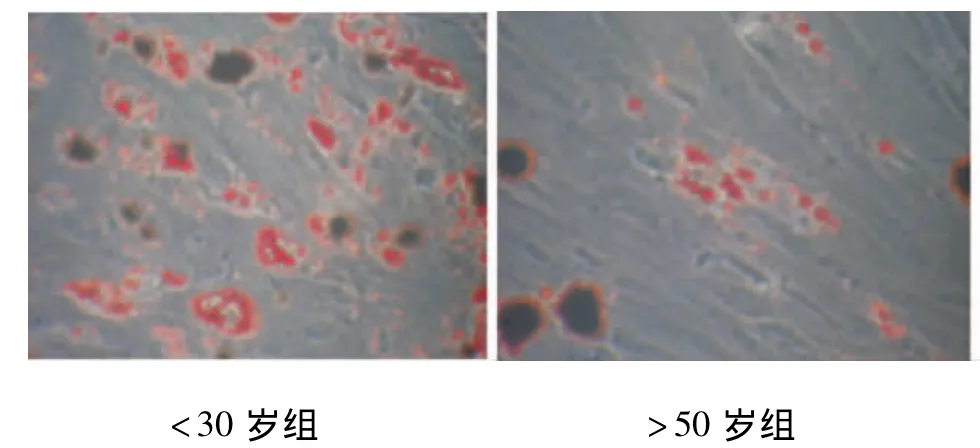
图5 体外成脂诱导光镜照片(14 d,×100)

图6 体外成骨诱导光镜照片(21 d,×100)
3 讨论
目前牙周膜干细胞的分离培养技术已经基本成熟,利用自体来源干细胞治疗牙周病的研究一直是热门课题[5-8]。以往研究中,年龄因素对牙周膜干细胞性能的影响报道不多,特别是50岁以上的患牙牙周膜中是否仍然存在足够数目的干细胞、其增殖分化能力是否与年轻牙周膜干细胞有显著差异,尚未见报道。
本结果显示:>50岁病人来源的第三磨牙牙周膜中仍然存在PDLSCs,并具有基本的牙周膜干细胞特性,但与<30岁组相比,其增殖与分化能力相对较弱。Nagatomo 等[9](2006)发现:PDLSCs表达 细 胞 表 面 抗 原 CD105、CD166、STRO-1。Ivanovski等[10](2001)发现:PDLSCs或骨髓基质干细胞均无CD14、CD45、CD34表达。本研究发现:<30岁组和>50岁组来源的PDLSCs间充质干细胞表面标记均阳性表达,而在造血系表面标记阴性表达,但<30岁组阳性率略低于50岁以上组(未进行统计学分析)。成骨、成脂能力体外诱导实验结果表明:随着年龄增加,人PDLSCs多向分化能力减弱,与文献报道结果一致[11]。因此,在未来人PDLSCs的应用和转化研究中,应充分考虑到年龄因素对干细胞性能产生的影响[12-13]。本研究的进一步深入探索,应扩大样本资料,对不同年龄组来源的人PDLSCs的相关特性进行研究,并对不同组细胞的基因表达差异进行对比分析,以期获得更有价值的数据资料。
[1]Pihlstrom BL,Michalowicz BS,Johnson NW.Periodontal disea-ses[J].Lancet,2005,366(9499):1809 -1820.
[2]Chen FM,Jin Y.Periodontal tissue engineering and regeneration:current approaches and expanding opportunities[J].Tissue Eng Part B Rev,2010,16(2):219 -255.
[3]Villar CC,Cochran DL.Regeneration of periodontal tissues:guided tissue regeneration[J].Dent Clin North Am,2010,54(1):73-92.
[4]Reynolds MA,Aichelmann-Reidy ME,Branch-Mays GL.Regeneration of periodontal tissue:bone replacement grafts[J].Dent Clin North Am,2010,54(1):55-71.
[5]Liu Y,Zheng Y,Ding G,et al.Periodontal ligament stem cellmediated treatment for periodontitis in miniature swine[J].Stem Cells,2008,26(4):1065 -1073.
[6]Feng F,Akiyama K,Liu Y,et al.Utility of PDL progenitors for in vivo tissue regeneration:a report of 3 cases[J].Oral Dis,2010,16(1):20 -28.
[7]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149 -155.
[8]Ivanovski S,Gronthos S,Shi S,et al.Stem cells in the periodontal ligament[J].Oral Dis,2006,12(4):358 -363.
[9]Nagatomo K,Komaki M,Sekiya I,et al.Stem cell properties of human periodontal ligament cells[J].J Periodont Res,2006,41(4):303-310.
[10]Ivanovski S,Haase HR,Bartold PM.Expression of bone matrix protein mRNAs by primary and cloned cultures of the regenerative phenotype of human periodontal fibroblasts[J].J Dent Res,2001,80(7):1665 -1671.
[11]Zheng W,Wang S,Ma D,et al.Loss of proliferation and differentiation capacity of aged human periodontal ligament stem cells and rejuvenation by exposure to the young extrinsic environment[J].Tissue Eng Part A,2009,15(9):2363 -2371.
[12]陈发明,金岩,施松涛,等.转化医学:十年回顾与展望[J].实用口腔医学杂志,2011,27(1):5-11.
[13]唐亮,金岩,王松灵,等.以转化为导向的口腔医学与干细胞研究[J].北京大学学报:医学版,2011,43(1):1-5.

