软枣猕猴桃多糖的分离与纯化及其分子质量的测定
潘 松,刘长江*,梁 爽
(沈阳农业大学食品学院,辽宁 沈阳 110866)
软枣猕猴桃多糖的分离与纯化及其分子质量的测定
潘 松,刘长江*,梁 爽
(沈阳农业大学食品学院,辽宁 沈阳 110866)
对通过水提醇沉法提取、Sevag法脱蛋白得到的软枣猕猴桃多糖进行分离纯化,利用DEAE-纤维素 52离子交换层析对软枣猕猴桃多糖进行初步分离,得到4种软枣猕猴桃多糖组分;利用葡聚糖凝胶对软枣猕猴桃多糖组分进一步分离的最佳条件为葡聚糖凝胶型号为Sephadex G-200、层析柱规格为D1.1cm×100cm、多糖质量浓度为10g/L。以此条件分离,得到含量较高的软枣猕猴桃多糖-Ⅱ纯品。通过Sephadex G-200凝胶柱层析鉴定软枣猕猴桃多糖-Ⅱ是均一的纯多糖,通过紫外光谱鉴定软枣猕猴桃多糖-Ⅱ不含核酸及蛋白。同时测得软枣猕猴桃多糖-Ⅱ的分子质量为83733D。
软枣猕猴桃;多糖;分离纯化;柱层析;紫外光谱;分子质量测定
软枣猕猴桃(Actinidia argutaSieb.et Zucc.),又名软枣子,属于猕猴桃科(Actinidiaceae)、猕猴桃属(Actinidia)多年生落叶藤本植物[1]。软枣猕猴桃从东北到长江流域均有分布,长白山脉资源丰富[2]。软枣猕猴桃果实中VC含量更是高于普通水果数倍之多,同时从软枣猕猴桃果实中测得17种氨基酸[3-5]。软枣猕猴桃具有抗衰老和滋补强壮作用,同时还有提高机体免疫力、抗氧化、防治心脑血管疾病等生理功能[6-7]。多糖又称多聚糖,是构成生命活动的四大基本物质之一,与生命的多种生理功能密切相关[8]。多糖有免疫调节、抗癌、降血糖、降胆固醇、降血脂等生理功能[9-11]。软枣猕猴桃中富含多糖类物质,对软枣猕猴桃多糖的研究对软枣猕猴桃的开发利用有重要意义。本实验对通过水提醇沉法提取,Sevag法脱蛋白得到的软枣猕猴桃多糖的分离纯化条件进行优化,并选择最优条件对软枣猕猴桃粗多糖进行分离纯化,得到均一纯品软枣猕猴桃多糖。同时对软枣猕猴桃多糖分子质量进行测定。
1 材料与方法
1.1 材料与试剂
软枣猕猴桃果实采自辽宁省海城市九龙川自然保护区。
无水乙醇、丙酮、无水乙醚、石油醚、三氯甲烷、正丁醇、氯化钠、苯酚、硫酸、DEAE-纤维素 52、蓝葡聚糖2000 国药集团化学试剂有限公司;Sephadex G-75 SBH-Bio公司;Sephadex G-100、Sephadex G-200 北京索莱宝科技有限公司。
1.2 仪器与设备
5805高速冷冻离心机 德国Investment公司;LL3000冻干机 丹麦Heto公司;JY99-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;RE-52旋转蒸发仪 上海亚荣生化仪器厂;HH-4数显恒温水浴锅 常州国华电器有限公司;BS-100A自动部份收集器 上海沪西分析仪器厂;U2910紫外分光光度计 日本Hitachi公司。
1.3 方法
1.3.1 软枣猕猴桃多糖的提取
采用水提醇沉法提取软枣猕猴桃多糖:将软枣猕猴桃果实洗净匀浆,加入体积分数80%乙醇于80℃水浴除杂[12],离心;沉淀加蒸馏水于100℃水浴提取2h,离心;上清液浓缩至50mL,浓缩物用90%乙醇沉淀4h,过滤;滤渣用无水乙醇、丙酮、无水乙醚淋洗,过滤,沉淀冷冻干燥,得到软枣猕猴桃粗多糖。在50℃条件下,用石油醚索氏提取5h对粗多糖进行脱脂[13];采用Sevag法[14]脱蛋白得到脱蛋白多糖水溶液。
1.3.2 软枣猕猴桃多糖的分离纯化
1.3.2.1 软枣猕猴桃多糖的初步分离
采用DEAE-纤维素 52离子交换柱层析法对软枣猕猴桃粗多糖进行初步分离[15-16]:配制10g/L脱蛋白多糖溶液5mL,加到已平衡好的DEAE-纤维素 52柱内,分别用蒸馏水和0.1、0.2、0.3mol/L NaCl梯度洗脱。洗脱剂流速为2mL/min,4min/管,分部收集,洗脱液用苯酚-硫酸法[17]检测绘制洗脱曲线。根据洗脱曲线收集各均一组分。透析,浓缩,冻干,得半纯品软枣猕猴桃多糖。
1.3.2.2 软枣猕猴桃多糖组分的进一步分离
采用葡聚糖凝胶柱层析对软枣猕猴桃多糖组分进行进一步分离[18-19],分别选择不同型号的葡聚糖凝胶、层析柱以及不同的样品质量浓度进行分离,以确定最佳分离条件。绘制洗脱曲线,根据洗脱曲线收集各均一组分。透析、浓缩、冻干,得纯品软枣猕猴桃多糖。
1.3.3 软枣猕猴桃多糖的纯度鉴定
1.3.3.1 Sephadex G-200纯度鉴定[20]
将软枣猕猴桃多糖亚组分复溶,用相应洗脱剂洗脱,进行Sephadex G-200柱层析,洗脱剂流速为2mL/min,4min/管,分部收集,洗脱液用苯酚-硫酸法检测绘制洗脱曲线。
1.3.3.2 紫外光谱纯度鉴定[14]
将软枣猕猴桃多糖亚组分复溶,配制成质量浓度为0.05g/L的溶液,在紫外分光光度计上从200~400nm进行波长扫描,蒸馏水作空白对照,检测有无核酸(波长260nm处)和蛋白质(波长280nm处)的特征吸收峰。
1.3.4 软枣猕猴桃多糖分子质量的测定
用0.1mol/L NaCl平衡葡聚糖凝胶G-200层析柱(1.1cm×100cm),洗脱剂流速为2mL/min,4min/管。将2mL 2mg/mL蓝葡聚糖2000加入柱内定外水体积(Vo),洗脱液在波长615nm处直接测吸光度。用分子质量分别为T500、T70、T40、T10的标准品相继上柱,洗脱液用苯酚-硫酸法检测,分别得到它们的洗脱体积Ve。以分子质量(Mw)的对数lgMw为纵坐标,Ve/Vo为横坐标作图,绘制标准曲线。样品按上述条件上柱,求得其Ve,根据Ve/Vo值从标准曲线上求得样品对应的分子质量。
2 结果与分析
2.1 软枣猕猴桃多糖的初步分离结果
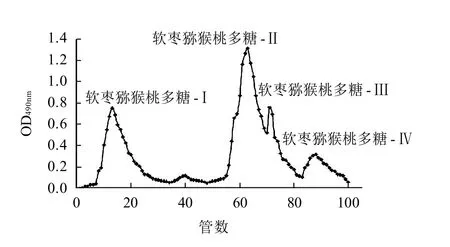
图1 软枣猕猴桃多糖DEAE-纤维素52离子交换柱层析结果Fig.1 Elution profile of crude polysaccharides extracted from Actinidia arguta Sieb. et Zucc. fruits on DEAE-cellulose-52 ion exchange column
由图1可知,DEAE-纤维素 52离子交换柱层析对软枣猕猴桃多糖有良好的分离效果。洗脱得到4个明显洗脱峰,其中,软枣猕猴桃多糖-Ⅰ为蒸馏水洗脱产物;软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ为0.2mol/L NaCl洗脱产物,该洗脱剂洗脱出的两种多糖组分没有完全分离,需进一步分离纯化;软枣猕猴桃多糖-Ⅳ为0.3mol/L NaCl洗脱产物。其中,软枣猕猴桃多糖-Ⅱ为主要组分,后续实验对其进行进一步分离,并以该组分为研究对象。
2.2 软枣猕猴桃多糖组分的进一步分离结果
2.2.1 葡聚糖凝胶型号对软枣猕猴桃多糖组分分离的影响
将0.2mol/L NaCl洗脱产物复溶,配制成10g/L多糖水溶液,分别选用Sephadex G-75、Sephadex G-100、Sephadex G-200对软枣猕猴桃多糖进行葡聚糖凝胶柱层析,柱型选择为D1.1cm×100cm,用0.2mol/L NaCl溶液洗脱。洗脱剂流速为2mL/min,4min/管,分部收集,洗脱液用苯酚-硫酸法检测绘制洗脱曲线,以选择分离效果最好的葡聚糖凝胶。葡聚糖凝胶型号对多糖组分分离的影响如图2所示。
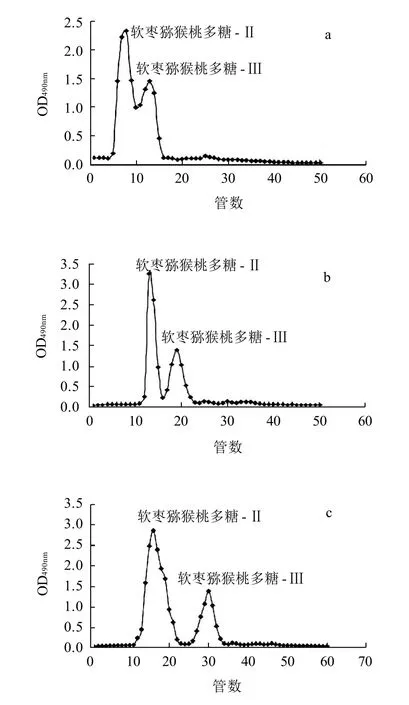
图2 软枣猕猴桃多糖Sephadex G-75(a)、Sephadex G-100(b)、Sephadex G-200(c)柱层析结果Fig.2 Separation profiles of mixed fractions Ⅱ and Ⅲ on Sephadex G-75 (a), Sephadex G-100(b) and Sephadex G-200 (c) cellulose columns
由图2可知,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分经Sephadex G-75柱层析并没有完全分离,无法收集两组分;经Sephadex G-100柱层析后,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分基本分离,但两组分交界处没有完全分离,无法准确收集两组分;经Sephadex G-200柱层析后,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分完全分离,可分别收集两组分。综上所述,Sephadex G-200对软枣猕猴桃多糖组分的分离效果最好,因此,选用Sephadex G-200对软枣猕猴桃多糖进行分离纯化。
2.2.2 凝胶柱型号对软枣猕猴桃多糖组分分离的影响
将0.2mol/L NaCl洗脱产物复溶,配制成10g/L多糖水溶液,分别选用柱型为D1.6cm×50cm、D1.1cm×100cm的层析柱对软枣猕猴桃多糖进行Sephadex G-200凝胶柱层析,用0.2mol/L NaCl为洗脱剂。洗脱剂流速为2mL/min,4min/管,分部收集,洗脱液用苯酚-硫酸法检测绘制洗脱曲线,以选择分离效果最好的层析柱。柱型为D1.6cm×50cm的层析柱对多糖组分分离的影响如图3所示,柱型为D1.1cm×100cm的层析柱对多糖组分分离的影响如图2c所示。
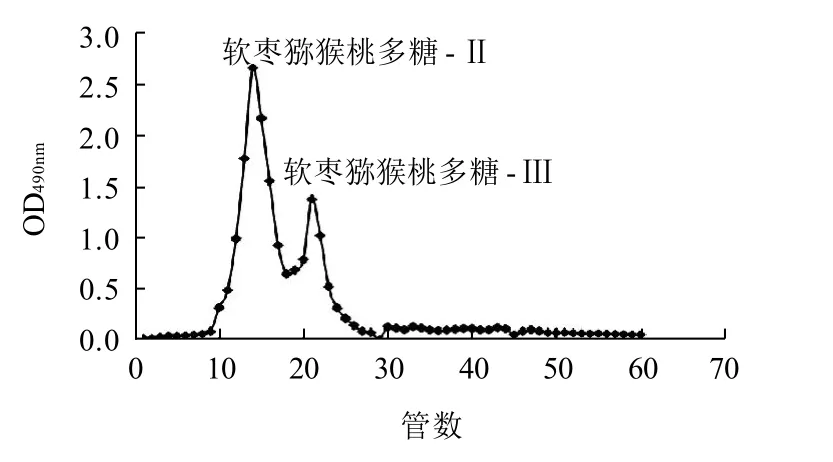
图3 软枣猕猴桃多糖Sephadex G-200(1.6cm×50cm)层析柱层析结果Fig.3 Separation profile of mixed fractions Ⅱ and Ⅲ on Sephadex G-200 cellulose column (D1.6 cm× 50 cm)
由图3可知,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分经柱型为D1.6cm×50cm的层析柱层析并没有完全分离,无法分别收集两个组分;由图2c可知,由于D1.1cm×100cm的层析柱较为细长,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分有足够的空间进行分离,可分别收集两组分。因此,选用分离效果较好的D1.1cm×100cm层析柱对软枣猕猴桃多糖进行分离纯化。
2.2.3 多糖质量浓度对软枣猕猴桃多糖组分分离的影响将0.2mol/L NaCl洗脱产物复溶,分别配制成质量浓度为5、10、20g/L的多糖水溶液,采用Sephadex G-200对该产物进行葡聚糖凝胶柱层析,柱型选择为D1.1cm×100cm,用0.2mol/L NaCl进行洗脱。洗脱剂流速为2mL/min,4min/管,分部收集,洗脱液用苯酚-硫酸法检测绘制洗脱曲线,以选择分离效果最好的多糖浓度。多糖质量浓度为5g/L及20g/L对多糖组分分离的影响如图4所示,多糖质量浓度为10g/L对多糖组分分离的影响如图2c所示。
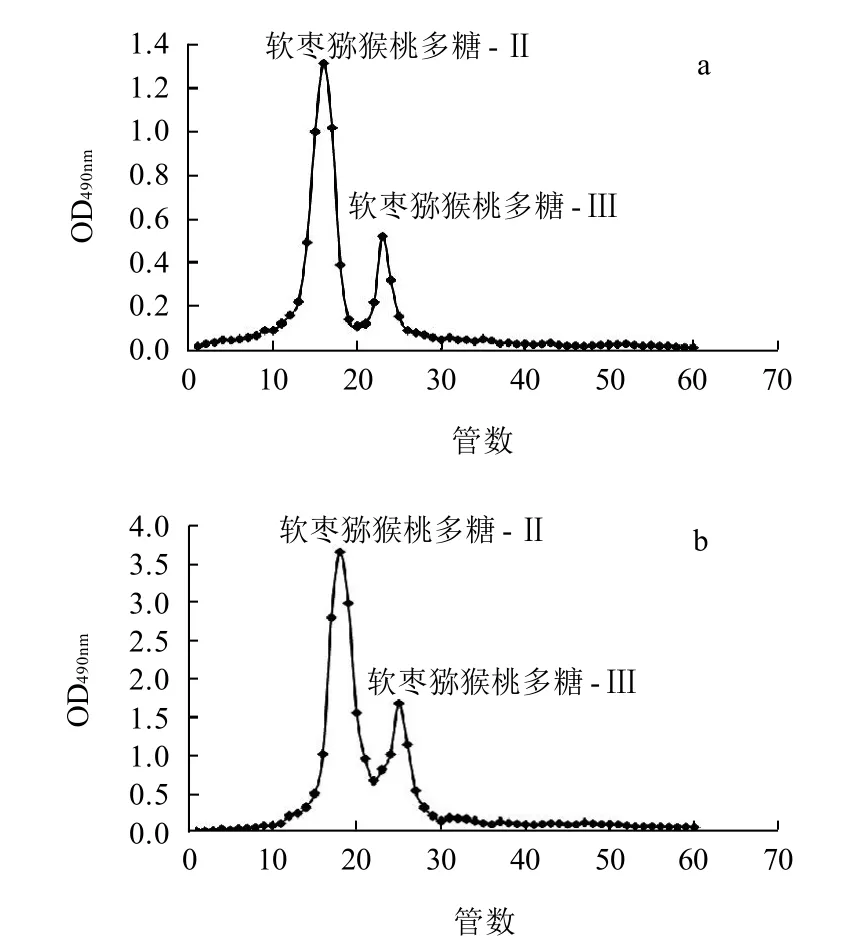
图4 多糖质量浓度为5g/L(a)和20g/L(b)柱层析结果Fig.4 Separation profiles of mixed fractions Ⅱ and Ⅲ at different initial polysaccharide concentrations on Sephadex G-200 cellulose column (D1.1 cm × 100 cm)
由图4a可知,当多糖质量浓度为5g/L时,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分基本分离,但由于上样质量浓度较小,每种组分的含量较少,若以此质量浓度为分离的最终质量浓度,则分离效率较低。由图4b可知,当多糖质量浓度为20g/L时,由于上样质量浓度较大,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分分离效果不明显,无法获得单一组分。由图2c可知,当多糖质量浓度为10g/L时,上样质量浓度适中,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分完全分离,可以收集单一组分。因此,选择质量浓度为10g/L的多糖浓度进行分离。
综上所述,软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分的最佳分离条件为葡聚糖凝胶型号为Sephadex G-200,层析柱型号为D1.1cm×100cm,多糖质量浓度为10g/L。以此条件对软枣猕猴桃多糖-Ⅱ和软枣猕猴桃多糖-Ⅲ组分进行分离结果如图2c所示,软枣猕猴桃多糖-Ⅱ组分为主要组分,根据洗脱曲线收集软枣猕猴桃多糖-Ⅱ组分。透析,浓缩,冻干,得纯品软枣猕猴桃多糖-Ⅱ。
2.3 软枣猕猴桃多糖的纯度鉴定
2.3.1 Sephadex G-200纯度鉴定
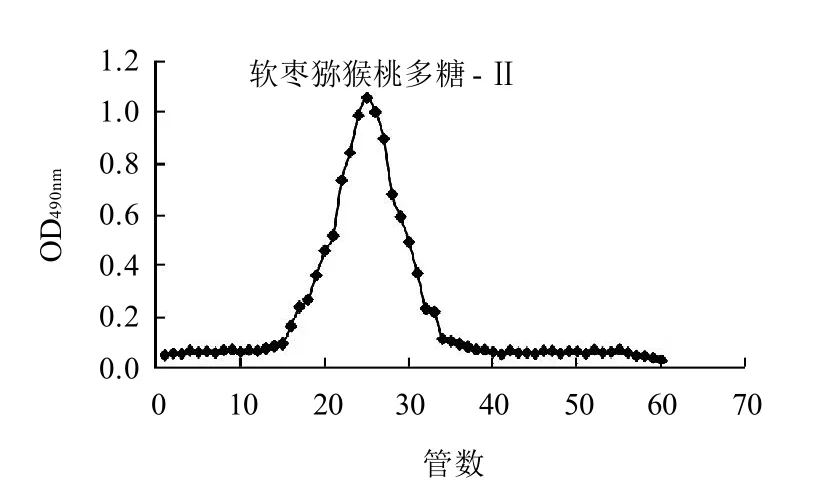
图5 Sephadex G-200纯度鉴定结果Fig.5 Elution profile of purified fraction Ⅱ on Sephadex G-200 cellulose column
由图5可知,软枣猕猴桃多糖-Ⅱ组分经Sephadex G-200凝胶柱层析后,得到了一个单一对称窄峰。说明通过分离纯化得到的软枣猕猴桃多糖-Ⅱ是均一的纯多糖,可以进行后续实验研究。
2.3.2 紫外光谱纯度鉴定
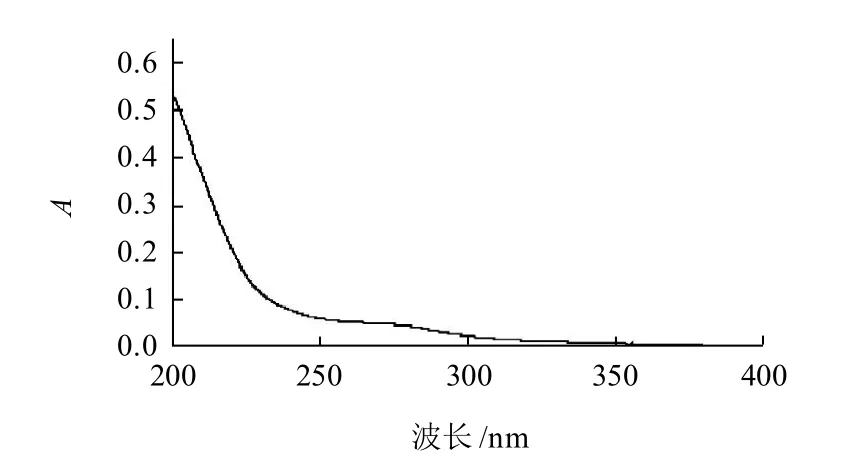
图6 紫外光谱纯度鉴定结果Fig.6 UV absorption spectrum of purified fraction Ⅱ
由图6紫外光谱可知,软枣猕猴桃多糖-Ⅱ组分在260、280nm波长处均无吸收峰,表明软枣猕猴桃多糖-Ⅱ组分不含核酸及蛋白。
2.4 分子质量的测定
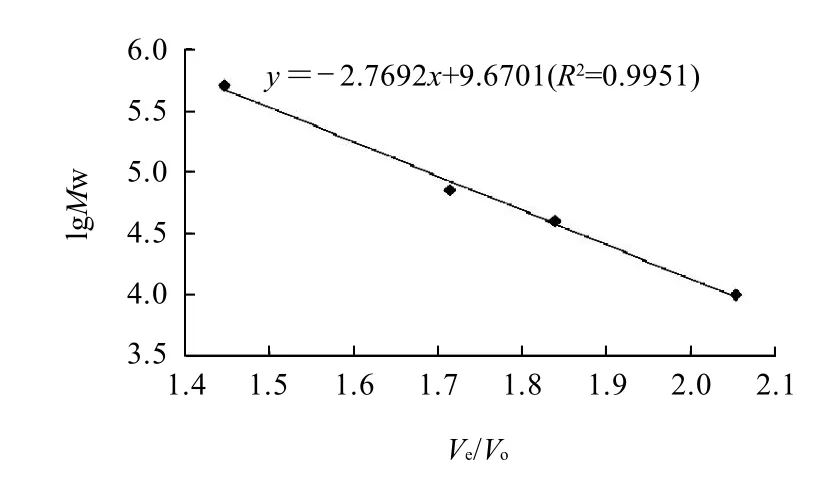
图7 多糖分子质量测定的标准曲线Fig.7 Calibration curve of standard dextrans for determining the molecular weight of purified fraction Ⅱ
由图7可知,经过Sephadex G-200柱层析,测得软枣猕猴桃多糖-Ⅱ的洗脱体积Ve为96mL,根据Ve/Vo值从标准曲线上求得软枣猕猴桃多糖-Ⅱ的分子质量为83733D。
3 结 论
利用DEAE-纤维素 52离子交换柱层析得到4种软枣猕猴桃多糖组分;选用Sephadex G-100、层析柱规格为D1.1cm×100cm,多糖质量浓度为10g/L的条件对软枣猕猴桃多糖组分进一步分离,得到含量较高的软枣猕猴桃多糖-Ⅱ纯品。通过Sephadex G-200凝胶柱层析鉴定软枣猕猴桃多糖-Ⅱ是均一的纯多糖,通过紫外光谱鉴定软枣猕猴桃多糖-Ⅱ不含核酸及蛋白。同时测得软枣猕猴桃多糖-Ⅱ的分子质量为83733D。
[1] 梁攀, 李书倩, 张博, 等. 野生软枣猕猴桃中脂肪酸成分分析[J]. 食品科学, 2011, 32(2): 237-239.
[2] 姜文文, 姜爱丽, 田密霞, 等. 果胶酶处理对软枣猕猴桃出汁率的影响[J]. 保鲜与加工, 2008(4): 48-50.
[3] 李继海, 沈育杰, 丰利. 软枣猕猴桃复合保健饮料功能评价研究[J].特产研究, 1999(3): 22-38.
[4] 李凤林, 张丽丽. 野生软枣猕猴桃果醋饮料的研制[J]. 中国酿造, 2006(3): 62-65.
[5] 刘长江, 杨智超, 许金光, 等. 响应面法优化软枣猕猴桃蛋白提取工艺[J]. 食品研究与开发, 2011, 32(3): 1-5.
[6] 栾云峰, 王菲, 刘长江, 等. 软枣猕猴桃总黄酮含量测定的方法研究[J]. 食品科学, 2011, 32(4): 155-158.
[7] 王菲, 许金光, 刘长江, 等. 软枣猕猴桃中的功能保健成分及其在食品加工中的应用[J]. 食品工业科技, 2010, 31(8): 421-423.
[8] 王涛, 赵谋. 多糖的研究进展[J]. 现代食品科技, 2005, 23(1): 103-106.
[9] JIANG Yong, TU Pengfei. Analysis of chemical constituents in Cistanche species[J]. Journal of Chromatography A, 2009, 1216(11): 1970-1979.
[10] HOKPUTSA S, HARDING S E, INNGJERDINGEN K, et al. Bioactive polysaccharides from the stems of the Thai medicinal plantAcanthus ebracteatus: their chemical and physical features[J]. Carbohydrate Research, 2004, 339(4): 753-762.
[11] WANG Jing, ZHANG Quanbin, ZHANG Zhongshan, et al. Antioxidant activity of sulfated polysaccharide fractions extracted fromLaminaria japonica[J]. International Journal of Biological Macromolecules, 2008,42(2): 127-132.
[12] 翠娥, 蒋立科, 李苗苗. 大豆多糖提取分离工艺的优化研究[J]. 安徽农学通报, 2009, 15(3): 148-150.
[13] 刘国凌, 宁正祥, 郭红辉, 等. 苦瓜果实中多糖的分离纯化及性质分析[J]. 食品科学, 2010, 31(3): 30-34.
[14] 高莉, 王强, 帕提古力·玛合木提. 核桃隔膜多糖的分离纯化及单糖组成分析[J]. 食品科学, 2010, 31(21): 182-185.
[15] 孟宪军, 秦琴, 高晓旭. 五味子多糖的分离纯化及清除自由基研究[J]. 食品科学, 2008, 29(1): 91-94.
[16] 谢丽源, 张勇, 郭勇, 等. 桑黄菌丝体多糖的分离纯化及理化性质分析[J]. 食品科学, 2011, 32(5): 143-147.
[17] 刘桂萍. 冬虫夏草多糖测定方法的研究进展[J]. 药学实践杂志, 2008,26(1): 53-54.
[18] WU Yaling, PAN Yuanjiang, SUN Cuirong. Isolation, purification and structural investigation of a water-soluble polysaccharide fromSolanum lyratumThunb[J]. International Journal of Biological Macromolecules,2005, 36(4): 241-245.
[19] LI Quanhong, FU Caili, RUI Yukui. Effects of protein-bound polysaccharide isolated from pumpkin on insulin in diabetic rats[J]. Plants Foods for Human Nutrition, 2005, 60(6): 13-16.
[20] 马淑凤, 陈利梅, 徐化能, 等. 白灵菇多糖的分离纯化及清除自由基研究[J]. 食品科学, 2009, 30(19): 109-113.
Isolation, Purification and Molecular Weight Determination of Polysaccharides fromActinidia argutaSieb. et Zucc. Fruits
PAN Song,LIU Chang-jiang*,LIANG Shuang
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Polysaccharides fromActinidia argutaSieb. et Zucc. were extracted by hot-water extraction, ethanol precipitation,protein removal by the Sevag method and then purified by DEAE-cellulose-52 ion exchange column chromatography. Four polysaccharide fractions were obtained. The best purification of Fraction Ⅱ was achieved by chromatographic separation on a Sephadex G-200 column (D1.1 cm × 100 cm) at a sample concentration of 10 g/L. As a result, a homogenous pure polysaccharide was obtained. The results of UV spectroscopic analysis revealed that the purified polysaccharide contained neither proteins nor nucleic acids. Moreover, the molecular weight of the purified polysaccharide was measured to be 83733 D.
Actinidia argutaSieb. et Zucc.;polysaccharide;isolation and purification;column chromatography;ultraviolet spectroscopy;molecular weight determination
Q539
A
1002-6630(2012)15-0066-05
2011-07-09
农业部公益性行业(农业)科研专项(200903013)
潘松(1986—),女,硕士研究生,研究方向为食品生物技术。E-mail:zcqpslove@163.com
*通信作者:刘长江(1955—),男,教授,硕士,研究方向为食品生物技术。E-mail:liucj597@sohu.com

