酶法提取鸡蛋壳膜胶原蛋白工艺
任 萌,宫新统,赵颂宁,张元元,孙研博,殷建伟,刘静波*
(吉林大学军需科技学院营养与功能食品研究室,吉林 长春 130062)
酶法提取鸡蛋壳膜胶原蛋白工艺
任 萌,宫新统,赵颂宁,张元元,孙研博,殷建伟,刘静波*
(吉林大学军需科技学院营养与功能食品研究室,吉林 长春 130062)
采用酶解法从鸡蛋膜中提取胶原蛋白,研究酶的种类、pH值、酶用量、料水比和提取时间对胶原蛋白提取的影响,采用单因素试验并结合L9(34)正交试验优化,得出酶法提取蛋壳膜中的胶原蛋白的最佳工艺条件为常温条件下质量分数6%木瓜蛋白酶在pH5、料水比1:100(g/mL)条件下、酶解5h,胶原蛋白的提取率达到0.91%。得到高效提取胶原蛋白的工艺,不仅解决了废弃鸡蛋壳膜的环境污染问题,而且在胶原蛋白生产工业有较大的实际利用价值。
蛋壳膜;胶原蛋白;酶法;提取
我国是禽蛋生产大国,禽蛋消费巨大随之也带来了蛋壳废弃物的增多,蛋清液、蛋壳膜腐败造成一定程度的环境污染。在提倡节能环保的今天,垃圾的资源化、减量化具有重要意义。
蛋壳占整蛋质量10%~12%[1]。废弃的蛋壳由蛋壳与蛋壳内膜组成。蛋壳中含有丰富的钙质,国内有利用蛋壳制成柠檬酸-苹果酸复合钙[2-4]的工艺研究,这类研究对蛋壳进行有效利用,可以减少资源浪费。与蛋壳相比,蛋壳膜具有更广泛的生物活性,其主要成分是蛋白质,类似细胞膜蛋白质的组成,以糖蛋白的形式存在[5]。壳膜约含有90%蛋白质、3%脂质体和2%糖类。其中,蛋白质有角蛋白、胶原蛋白、复合蛋白等[6]。壳膜中约含有其自重10%的胶原蛋白,然而成功从蛋膜中提取纯的胶原蛋白尚未见文献报道[7]。
胶原蛋白是具有极高生理活性的蛋白质,也是生物科技产业关键性的原材料之一,广泛的应用于各个领域中[8],因而提取胶原蛋白的原料也成为动物研究热点[9]。当今工业胶原蛋白的提取原料多为小腿皮肤和骨骼[10],若把蛋壳中的胶原蛋白提取出来将是对资源具有创新性的再利用。有研究表明,蛋壳膜胶原蛋白可以作为潜在的资源代替哺乳动物胶原的商业应用[11],从而降低了原料风险,已经证实,蛋壳膜的自身免疫和过敏反应很低[12]。综上所述:蛋壳膜应用于功能食品、化妆品和其他工业的可能性很大。随着胶原蛋白产品的畅销以及人们越来越重视其营养功能,正因如此胶原蛋白在医药、食品等行业中应用较多[13-15],胶原蛋白提取工艺也成为研究热点,有热水提取、碱法提取、酶提取[16]等,其中酶法提取最为广泛[17-18]。本实验利用酶解法从蛋壳膜中提取出胶原蛋白营养物质,使蛋壳膜成为提取胶原蛋白的创新可靠来源。
1 材料与方法
1.1 材料、试剂与仪器
废弃蛋壳、胃蛋白酶、胰蛋白酶、木瓜蛋白酶、羟脯氨酸标准品、柠檬酸缓冲液、氯胺T、高氯酸、对甲氨基苯甲醛。
紫外-可见分光光度计 日本岛津公司;AG204型电子天平 瑞士Mettle Toledo公司;华克电子天平 福州华志科学仪器有限公司;101-3-S型电热恒温鼓风干燥箱 上海跃进医疗器械厂;FN-200型高速万能粉碎机北京中兴伟业仪器有限公司。
1.2 方法
1.2.1 样品预处理理及试剂配制
样品预处理:将蛋壳清洗,手剥蛋壳,将得到的蛋壳膜干燥并粉碎成粉末,储存备用。
试剂配制:配制pH 6柠檬酸缓冲液(分析纯),0.05mol/L氯胺T溶液(分析纯),3.15mol/L过氯酸溶液(分析纯),10%对二甲氨基苯甲醛溶液(分析纯),1mg/mL羟脯氨酸贮存液(标准品),100μg/mL羟脯氨酸测定液(现用现配)。
1.2.2 分析方法(以羟脯氨酸计)[19]
羟脯氨酸与羟赖氨酸是胶原蛋白特有的氨基酸,在其他蛋白中少见[20]。所以可以通过测羟脯氨酸的含量间接计算胶原蛋白的含量。紫外可见分光光度法测定胶原蛋白含量,胶原蛋白提取率计算公式:
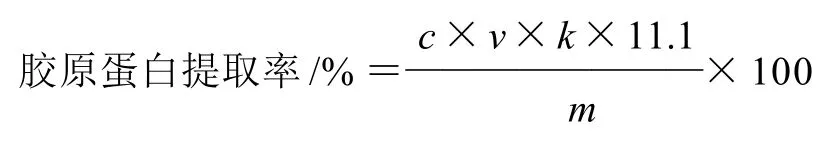
式中:c为羟脯氨酸的质量浓度/(μg/mL);V为离心后上清液体积/mL;k为稀释倍数;m为鸡蛋壳膜质量/g;11.1为羟脯氨酸与胶原蛋白的换算系数。
1.2.3 单因素试验设计
试验中考察酶解酶种类、pH值、酶用量(质量分数)、料水比、时间对鸡蛋壳膜中胶原蛋白提取的影响,单因素试验水平因素见表1。
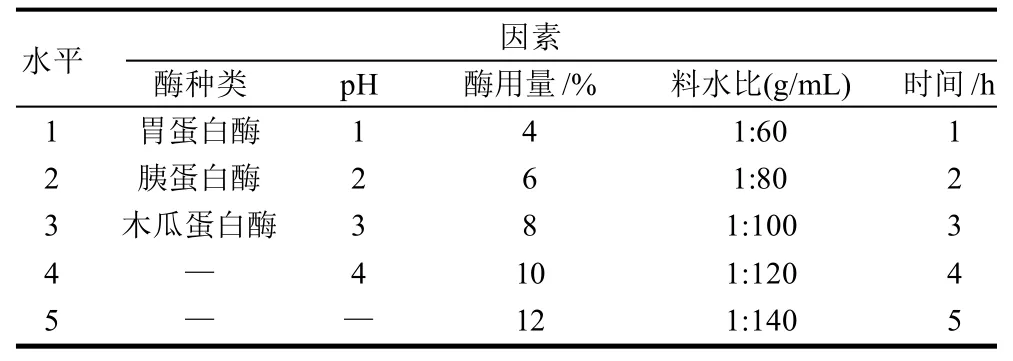
表1 单因素试验设计与因素水平表Table 1 One-factor-at-a-time design scheme
1.2.4 L9(34)正交试验设计
正交试验中选取了对鸡蛋壳膜中胶原蛋白提取影响较为显著的酶种类、pH值、酶用量、时间4因素,正交试验水平因素编码见表2。

表2 酶法提取蛋壳膜胶原蛋白工艺优化正交试验水平因素编码表Table 2 Factors and their coded levels in orthogonal array design
2 结果与分析
2.1 胶原蛋白测定标准曲线
采用紫外-可见分光光度法测定羟脯氨酸的标准曲线如图所示,其回归方程为:y=0.0575x+0.1191,其相关系数R2=0.9997,线性关系良好,因此可作为胶原蛋白含量测定的标准。
2.2 酶种类对胶原蛋白提取率的影响
取3份壳膜粉,分别加入质量分数6%的胃蛋白酶、胰蛋白酶、木瓜蛋白酶,反应温度为室温,料水比为1:100,酶解时间为4h,pH值条件为4、9.18、6.86(为各自最佳pH值条件)。酶解反应后过滤,得到胶原蛋白提取液,进行羟脯氨酸含量的测定,结果见图1。
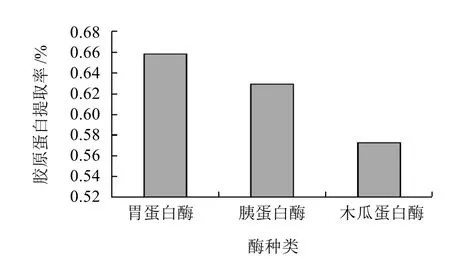
图1 酶种类对胶原蛋白提取率的影响Fig.1 Effect of enzyme type on extraction rate of collagen
由图1可知,胃蛋白酶、胰蛋白酶和木瓜蛋白酶的提取率逐渐降低,这说明胃蛋白酶的结构和成分更适合来水解作用于蛋壳膜粉,得到较高的提取率。
2.3 酶解pH值对胶原蛋白提取率的影响
取4份壳膜粉,分别加入6%胃蛋白酶,反应的温度为室温,p H值条件为1、2、3、4,料水比为1:100,酶解4h。酶解反应后过滤,得到胶原蛋白提取液,进行羟脯氨酸含量测定,结果见图2。
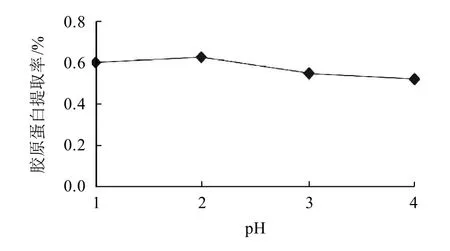
图2 酶解pH值对胶原蛋白提取率的影响Fig.2 Effect of hydrolysis pH on extraction rate of collagen
由图2可知,提取率随着pH值的增大呈先上升后下降的趋势,pH2时有最大的提取率。可能因为胃蛋白酶的最适pH接近2,在此环境下,酶的活性较好,水解蛋壳膜更彻底。
2.4 酶用量对胶原蛋白提取率的影响
取5份壳膜粉,分别加入质量分数4%、6%、8%、10%、12%的胃蛋白酶,在pH2、料水比1:100,酶解4h条件下进行酶解试验。酶解反应结后过滤,得到胶原蛋白提取液,进行羟脯氨酸含量的测定,结果见图3。
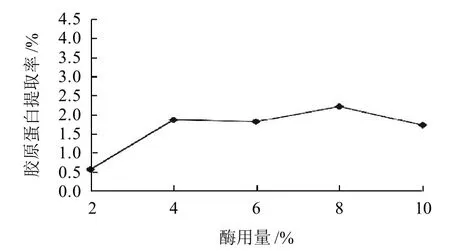
图3 酶用量对胶原蛋白提取率的影响Fig.3 Effect of enzyme dose on extraction rate of collagen
由图3可知,提取率随着酶用量的增加呈现先上升后下降的趋势,在酶用量8%时达到最大。底物相同,随着酶酶用量的增加,底物反应的更充分,超过8%后,提取率呈下降趋势,可能由于酶用量偏大,多余的酶可能发生凝聚,致使提取率降低,在某种程度上抑制了水解反应的进行。
2.5 酶解料水比对胶原蛋白提取率的影响
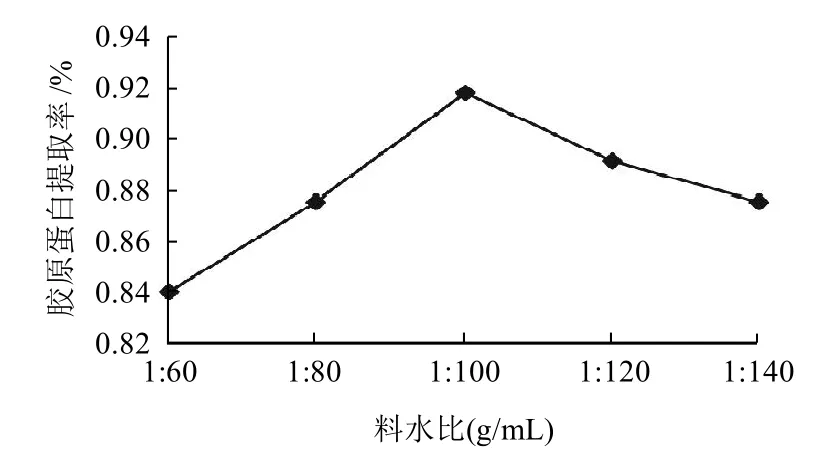
图4 酶解料水比对胶原蛋白提取率的影响Fig.4 Effect of material-to-water ratio on extraction rate of collagen
取5份壳膜粉,分别加入8%胃蛋白酶、pH2、酶解4h,料水比分别为1:60、1:80、1:100、1:120、1:140。酶解反应后过滤,得到胶原蛋白提取液,进行羟脯氨酸含量的测定,结果见图4。
由图4可知,提取率随着水的添加量的增加呈现先增加后下降的趋势,且在料水比为1:100时达到最高峰,这可能是由于较高的料水比体系中,所壳膜粉不能与溶剂充分反应,而当反应体系中溶剂的量达到一定值时,壳膜粉可与整个反应体系充分接触,促进胶原蛋白的生成,从而得到较高的提取率,而当水的添加量过高时,会较大地稀释溶剂酸,故而导致胶原蛋白提取率的下降。
2.6 酶解时间对胶原蛋白提取率的影响
取5份壳膜粉,分别加入8%胃蛋白酶,pH2,料水比1:100,酶解时间分别为1、2、3、4、5h。酶解反应后过滤,得到胶原蛋白提取液,进行羟脯氨酸含量的测定,结果见图5。
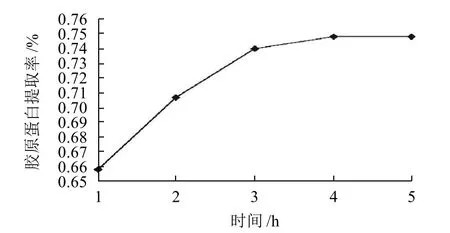
图5 酶解时间对胶原蛋白提取率的影响Fig.5 Effect of hydrolysis time on extraction rate of collagen
由图5可知,随反应时间的延长呈现先增加后趋于平稳的趋势。且当反应时间4h时达到最高值。随着反应时间的增加,使得酶与底物更充分接触反应,提取率逐渐增大。然而随着反应时间进一步增加,酶与底物的反应趋于完全,提取率不再增加,趋于平稳。
2.7 酶法提取蛋壳膜胶原蛋白工艺优化正交试验

表3 酶法提取蛋壳膜胶原蛋白工艺优化正交试验设计与结果Table 3 Orthogonal array design arrangement and corresponding results
通过单因素试验,在料水比1:100条件下通过正交试验,考察酶解的酶种类、p H值、时间、酶用量4个单因素对鸡蛋壳膜中胶原蛋白提取率的影响,结果见表3,通过正交试验所得结果进行极差分析,可知因素影响顺序为C>D>B>A,即酶用量>时间>pH值>酶种类。试验最优方案为A1B2C1D3,即采用木瓜蛋白酶、pH4、酶用量6%、酶解时间5h条件为最优工艺路线,按优选工艺进行验证实验,3次平行试验鸡蛋壳膜中胶原蛋白平均提取率为0.91%。
鸡蛋壳膜中胶原蛋白提取试验的方差分析结果见表4,从方差分析表中可以看出,在酶解种类、pH值、酶用量、时间4个单因素中,酶用量和酶解时间为显著因素,酶用量因素a=0.1,时间因素a=0.25,而酶种类以及pH值不为显著性因素,从经济节约以及简便的角度考虑,选择木瓜蛋白酶pH5、酶用量6%、反应时间5h为最优的胶原蛋白提取试验工艺参数。

表4 正交试验设计方差分析表Table 4 Analysis of variance for extraction rate of collagen with various hydrolysis conditions
3 结 论
通过L9(34)正交试验得出从鸡蛋壳膜中提取胶原蛋白的最佳工艺参数为选择木瓜蛋白酶在pH5、酶用量6%,反应时间5h,在此条件下鸡蛋壳膜中胶原蛋白的提取率达到0.91%。解决了废弃鸡蛋壳膜的环境污染问题,而且为胶原蛋白生产工业提供较大的实际利用价值,对蛋壳资源的综合利用具有一定的指导意义。蛋壳膜胶原蛋白的提取是对蛋壳膜潜在价值的挖掘,使蛋壳膜成为提取胶原蛋白安全可靠的来源。
[1] 马美湖. 禽蛋制品生产技术[M]. 北京: 中国轻工业出版社, 2003: 207-238.
[2] 汪之和, 施文正, 张丽华. 鸡蛋壳制备柠檬酸-苹果酸钙的研究[J].食品研究与开发, 2003, 22(2): 115-117.
[3] 赵颂宁, 王丽艳, 罗姗姗, 等. 响应面法优化微波制备柠檬酸-苹果酸复合钙的工艺研究[J]. 食品工业科技, 2010(7): 249-255.
[4] 罗姗姗, 王丽艳, 赵颂宁, 等. 超声波法制备蛋壳柠檬酸-苹果酸复合钙的优化研究[J]. 现代农业科技, 2010(5): 324-325.
[5] 王淑珍, 萧炜, 陈亮. 蛋壳膜美容保健奶研制及其营养分析[J]. 食品工业, 2004(6): 41-42.
[6] KIYOSHI M, HIROSHI M. Poultry eggshell strengthening composition:US , 6660294[P]. 1999-04-02.
[7] 周艳华, 马美湖, 蔡朝霞. 蛋壳膜中角蛋白与胶原蛋白的提取分离技术及功能多肽的研究[J]. 中国家禽, 2008, 30(15): 34-37.
[8] 焦道龙, 陆剑锋, 张伟伟, 等. 水产动物胶原蛋白的研究现状及发展趋势[J]. 食品科学, 2009, 30(17): 334-338.
[9] 张根生, 范爱月, 韩冰, 等. 响应曲面法优化碱性蛋白酶提取林蛙残体胶原蛋白[J]. 食品科学, 2011, 32(2): 93-97.
[10] LI H, LIU B L, GAO L Z, et all. Studies on bullfrog skin collagen[J].Food Chemistry, 2004, 84(1): 65-69.
[11] ZHAO Yuhong, 等. 蛋壳膜中提取出的胶原蛋白的表征[J]. 陈璎洁,译. 明胶科学与技术, 2009, 2(3): 132-135.
[12] LONG F D, ADAMS R G, DEVORE D P. Preparation of hyaluronic acid from eggshell membrane. US, 080388[P]. 2004-09-23.
[13] 赵玉红, 高天. 鹿骨胶原蛋白特性的研究[J]. 食品科学, 2008, 29(7):43-46.
[14] 段宙位, 申铉日, 陈秀明, 等. 罗非鱼尾胶原蛋白的提取与鉴定[J].食品科学, 2012, 33(6): 59-64.
[15] 汤俊, 魏东芝, 张国钧, 等. 胶原蛋白的高效制备及与明胶的鉴别[J].食品科学, 2010, 31(7): 54-60.
[16] 钟朝辉, 李春美, 梁晋鄂, 等. 鱼鳞胶原蛋白提取工艺的优化[J]. 食品科学, 2006, 27(7): 162-165.
[17] 刘静波, 赵颂宁, 林松毅, 等. 酶解法提取黑木耳中胶原蛋白的工艺优化[J]. 农业工程学报, 2012, 28(13): 282-286.
[18] MIZUTA S, TANAKA T, YOKOYAMA Y, et al. Hot-water solubility of mantle collagens in several cephalopod molluscs[J]. Food Science and Technology, 2009, 75(8): 1337-1338.
[19] ISO 3496. Meat and meat products- determination of hydroxyproline content[S]. 1994.
[20] 沈同, 王镜岩, 赵邦悌, 等. 生物化学: 上册[M]. 2版. 北京: 高等教育出版社, 1980: 154-160.
Enzymatic Extraction of Collagen from Egg Shell Membrane
REN Meng,GONG Xin-tong,ZHAO Song-ning,ZHANG Yuan-yuan,SUN Yan-bo,YIN Jian-wei,LIU Jing-bo*
(Laboratory of Nutrition and Functional Food, College of Quartermaster Technology, Jilin University, Changchun 130062, China)
In order to establish an enzymatic method for collagen extraction from egg shell membrane, the influence of enzyme type, pH, enzyme dose, material-to-water ratio and extraction time on extraction efficiency was investigated and these extraction parameters were optimized one-factor-at-a-time experiments combined with an L9(34) orthogonal array design. The optimal extraction condition was hydrolysis for 5 h with 6% papain at normal temperature and a material-to-water ratio of 1:100 (g/mL),resulting in an extraction rate of 0.91%. As a result, an efficient extraction method was obtained. Collagen extraction from egg shell membrane by this method not only avoids environmental pollution caused by abandoned egg shell membrane, but also has great practical value in the collagen production industry.
egg shell membrane;collagen;enzymolysis;extraction
TS253.9
A
1002-6630(2012)16-0096-04
2011-08-18
吉林大学本科生创新计划项目
任萌(1991—),女,本科生,研究方向为营养与功能食品。E-mail:happy13347008277@sina.com
*通信作者:刘静波(1962—),女,教授,博士,研究方向为营养与功能食品。E-mail:ljb168@sohu.com

