食品中单核细胞增生李斯特菌DNA环介导恒温扩增快速检测方法的建立
徐义刚,崔丽春,李丹丹,刘忠梅,李苏龙,张子群,张国财,*
(1.黑龙江出入境检验检疫局检验检疫技术中心,黑龙江 哈尔滨 150001;2.东北林业大学林学院,黑龙江 哈尔滨150040;3.海南出入境检验检疫局检验检疫技术中心,海南 海口 570125)
食品中单核细胞增生李斯特菌DNA环介导恒温扩增快速检测方法的建立
徐义刚1,崔丽春2,李丹丹3,刘忠梅1,李苏龙1,张子群1,张国财2,*
(1.黑龙江出入境检验检疫局检验检疫技术中心,黑龙江 哈尔滨 150001;2.东北林业大学林学院,黑龙江 哈尔滨150040;3.海南出入境检验检疫局检验检疫技术中心,海南 海口 570125)
基于单核细胞增生李斯特菌胞壁质水解酶iap基因,设计两对特异性引物,利用DNA环介导恒温扩增(loopmediated isothermal amplification,LAMP)技术,以扩增副产物焦磷酸镁实时浊度为判定标准,建立食品中单核细胞增生李斯特菌LAMP快速检测方法。结果显示,本LAMP方法特异性强,经过对29株细菌进行检测,所试单核细胞增生李斯特菌均为LAMP阳性,其他菌株为阴性;本LAMP方法对单核细胞增生李斯特菌纯培养菌的检测灵敏度为8CFU/管,对污染食品中单核细胞增生李斯特菌的检测灵敏度为12CFU/管。本研究建立的LAMP检测方法简便快速、结果判断直观。
单核细胞增生李斯特菌;iap基因;环介导恒温扩增;快速检测
李斯特菌属(Listeria)有2个群共7个种,第1群包括单核细胞增生李斯特菌(L. monocytogenes)、绵羊李斯特菌(L. ivanovii)、英诺克李斯特菌(L. innocua)、威尔斯李斯特菌(L. welshimei)、西尔李斯特菌(L. seeligeri);第2群为较少见的格氏李斯特菌(L. grayi)和莫氏李斯特菌(L. murrayi)[1]。其中,单核细胞增生李斯特菌是唯一能引起人类疾病的一种重要的人畜共患病和食源性疾病的致病菌,在自然界中广泛存在。人类主要食入被污染的食品而感染,主要引起以败血症、脑膜炎、流产和单核细胞增多为特征的临床症状[2],严重危害食品安全和人类健康。世界卫生组织(World Health Organization,WHO)指出,目前包括蔬菜、奶及奶制品、肉制品在内的消费性食品均不同程度的受到单核细胞增生李斯特菌污染,该菌种是我国进出口食品主要法检致病菌之一。因此,建立快速、准确的检测方法对防控单核细胞增生李斯特菌,增强食品安全具有重要意义。目前,针对食品中单核细胞增生李斯特菌的检测仍以传统方法为主[3],即先进行病原菌的分离培养,然后对可疑菌落进行系列生化反应、动力、溶血及毒力实验,完成鉴定工作一般需要7~10d,严重影响检测鉴定的速度。全自动免疫荧光检测方法[4]、聚合酶链式反应(polymerase chain reaction,PCR)方法[5]、显色培养基快速检测方法[6]和脉冲场凝胶电泳技术[7]的应用促进了单核细胞增生李斯特菌检测技术的发展,但存在一定的局限性。显色培养基检测方法虽然检测快速,但特异性和灵敏度差,在检测中,易造成漏检;PCR方法具备敏感性高及特异性强等优点,但核酸染料对人体健康和环境存在巨大安全隐患;全自动免疫荧光检测方法和脉冲场凝胶电泳技术对实验条件要求比较高,需要昂贵的仪器设备和专业人员,且操作相对复杂、检测成本高,基层单位难以开展。
更快捷、更精确、更灵敏、操作更简便的检测方法一直是致病微生物检测技术的发展方向。环介导恒温扩增技术(loop-mediated isothermal amplification,LAMP)是一种新颖的核酸恒温扩增方法,其原理是针对靶基因的6个区域设计4条特异引物,利用链置换DNA聚合酶在恒温60~65℃条件下,40~60min即可完成核酸扩增,直接通过扩增副产物焦磷酸镁沉淀的浊度判断是否发生反应[8-10]。LAMP方法操作简便、检测快速、灵敏度高且成本低廉,便于推广使用,该项技术已在疾病诊断、病原检测等领域得到广泛应用[11-18]。本研究拟利用该项技术建立单核细胞增生李斯特菌LAMP快速检测方法。
特异性靶基因的选择是建立LAMP检测方法的关键。p60蛋白是李斯特菌产生的一种胞外蛋白,由iap基因编码,具有胞壁质水解酶活性,与吞噬细胞溶解作用及其对机体的侵袭性密切相关[19]。李斯特菌属中的7个菌种均能够产生p60蛋白,编码p60蛋白N端和C端的基因片段高度保守,而不同种李斯特菌p60蛋白的中间区域各具特异性,利用此特异性可将单核细胞增生李斯特菌与其余6个种区分开来[20]。因此,本研究选择iap基因作为检测靶基因。
1 材料与方法
1.1 材料、试剂与仪器
实验所用菌株分别来自中国医学微生物菌种保藏管理中心和美国典型菌种保藏中心,单核细胞增生李斯特菌分离株由本中心分离保存(表1)。

表1 菌株及LAMP方法特异性检测结果Table 1 Bacterial strains used in this study and the specificity of LAMP assay
BstDNA Polymerase 美国 New England Biolabs公司;TaqDNA Polymerase、甜菜碱 美国Sigma公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司。
LA-320c LAMP实时浊度仪 济南贝林生物科技有限公司。
1.2 方法
1.2.1 LAMP引物设计
将单核细胞增生李斯特菌iap基因在Genbank上进行BLAST比对,选定同源性好的区域,通过Seqman软件分析,确定iap基因高度保守序列,并以此作为靶序列。将选定序列输入软件PrimerExplorer V3,通过调整3′端dG和Dimer dG参数,优化出LAMP引物,包括两条外引物F3和B3及两条内引物FIP和BIP(表2)。引物由宝生物工程(大连)有限公司合成。

表2 LAMP引物及序列Table 2 Primer sequences for LAMP used in this study
1.2.2 细菌基因组DNA的提取
试剂盒提取法提取细菌基因组DNA(主要用于LAMP方法的建立和灵敏度实验),具体操作步骤详见试剂盒说明书。煮沸法提取细菌DNA(主要用于LAMP方法的特异性实验):取1mL过夜培养菌液,10000r/min离心5min,弃去上清液,加入100μL含0.5% SDS的无菌水,充分悬浮菌体,100℃水浴10min,10000r/min离心5min,上清液于-20℃保存备用。
1.2.3 LAMP方法的建立
50μL反应体系中,含10×ThermoPoL Buffer 5μL(200mmol/L Tris-HCl、100mmol/L KCl、20mmol/L MgSO4、100mmol/L (NH4)2SO4、1.0% Tritonx-100)、2.5mmol/L dNTP 8μL、100mmol/L MgSO44μL、40mmol/L FIP 1μL、40mmol/L BIP 1μL、10mmol/L F3 1μL、10mmol/L B3 1μL、10mmol/L 甜菜碱 4μL、5U/μLTaqDNA Polymerase 2μL、8U/μLBstDNA Polymerase 2μL、单核细胞增生李斯特菌基因组DNA模板1μL,去离子水20μL。反应管置于LAMP浊度仪内,反应温度65℃,时间60min,设定对样品的浊度进行测定频率为1次/min,反应结束后,同时利用琼脂糖凝胶电泳验证是否发生LAMP反应。
1.2.4 LAMP灵敏度试验
将菌体浓度相当于8.3×107CFU/mL的单核细胞增生李斯特菌(ATCC 19111)进行10倍梯度稀释,使用试剂盒法提取每个稀释度细菌基因组DNA,以此作为模板进行LAMP扩增,观察每组样品的实时浊度变化,确定检测灵敏度。反应结束后,经电泳检测,验证其检测灵敏度。
1.2.5 LAMP特异性试验
利用建立的LAMP方法对表1中的病原菌进行检测,验证该方法的特异性。
1.2.6 污染食品中致病菌检测灵敏度试验
取10g经传统检测方法未检出单核细胞增生李斯特菌的新鲜鸡肉样品,加入90mL碱性蛋白胨水,制成匀浆;加入1mL菌体浓度约为1.2×108CFU/mL的单核细胞增生李斯特菌,充分混匀;取1g(约1mL)匀浆(含细菌浓度约为1.2×106CFU/g)进行10倍梯度稀释;每个稀释梯度分别取1g(约1mL),10000r/min离心5min,弃上清液,试剂盒提取DNA,进行LAMP扩增,观察每组样品的实时浊度变化,确定检测灵敏度。反应结束后,经电泳检测,验证其检测灵敏度。
1.2.7 验证实验
将建立的单核细胞增生李斯特菌LAMP快速检测方法应用于检验检疫实践工作中,以我国现行的单核细胞增生李斯特菌国家标准检测方法(GB/T 4789. 30—2008《食品卫生微生物学检验:单核细胞增生李斯特氏菌检验》)作为参考方法进行比较。
2 结果与分析
2.1 单核细胞增生李斯特菌LAMP方法的建立
选择单核细胞增生李斯特菌iap基因特异性区域设计两对LAMP引物,以试剂盒提取的单核细胞增生李斯特菌基因组DNA为模板,在BstDNA Polymerase作用下,65℃环境温度进行LAMP反应,结果如图1所示。随着反应的进行,核酸阳性反应管中溶液的浊度值逐渐升高,说明发生了LAMP反应,其扩增副产物焦磷酸镁的含量在逐渐增多,而阴性对照反应管溶液未变浑浊,没有发生LAMP反应;琼脂糖凝胶电泳验证结果显示,阳性反应管中发生LAMP扩增反应,出现典型的LAMP扩增泳带,而阴性对照未发生反应。结果说明,本研究建立的单核细胞增生李斯特菌LAMP检测方法可行。
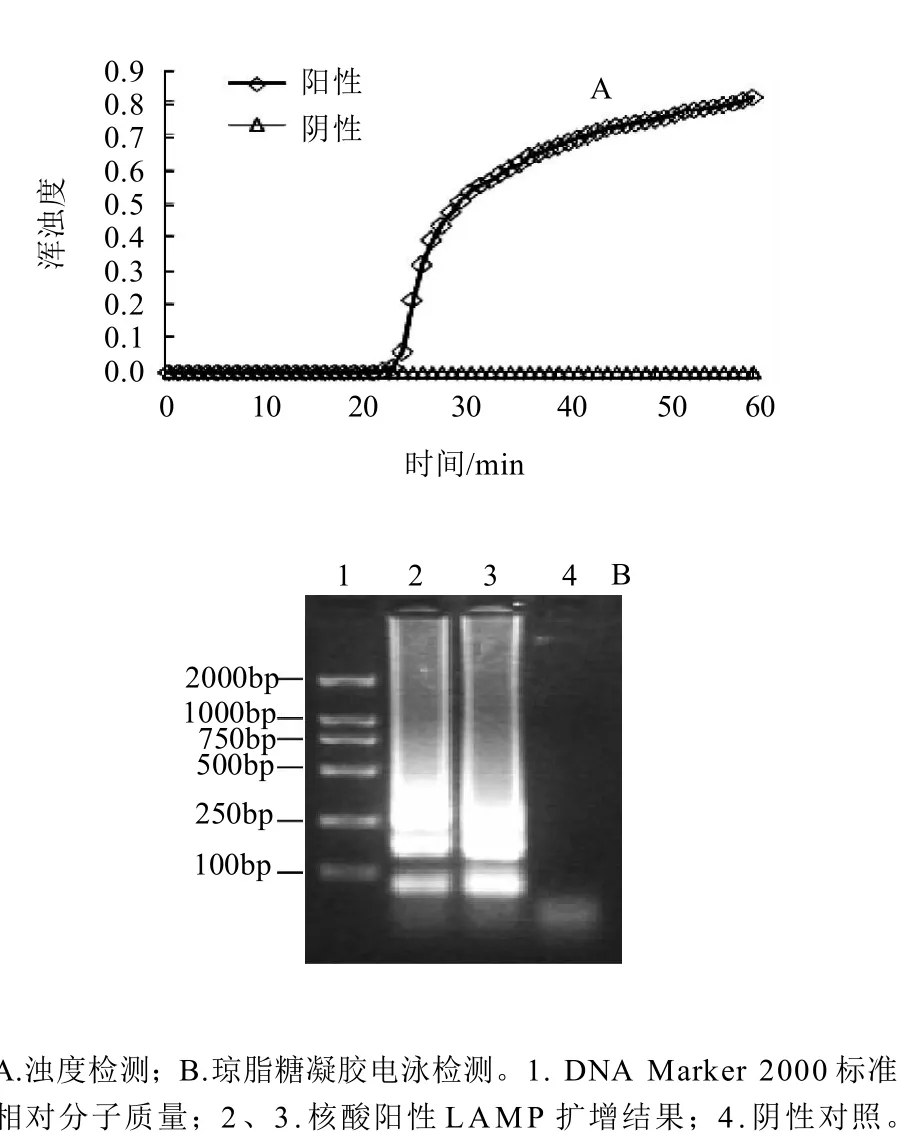
图1 单核细胞增生李斯特菌LAMP检测方法的建立Fig. 1 Development of LAMP method for the detection of L. monocytogenes
2.2 LAMP灵敏度实验结果
将菌体浓度相当于8.3×107CFU/mL的单核细胞增生李斯特菌(ATCC 19111)10倍梯度稀释,以每个稀释度提取的基因组DNA作为模板,进行LAMP扩增,结果如图2所示。结合每组反应管中溶液的实时浊度值和琼脂糖凝胶电泳检测结果可知,该LAMP方法的检测灵敏度为8CFU/反应管。
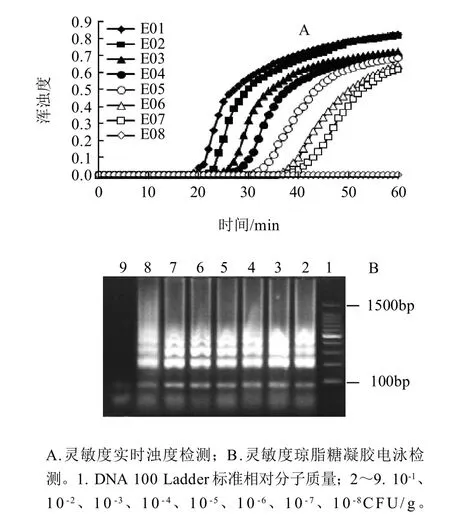
图2 单核细胞增生李斯特菌LAMP方法灵敏度的确定Fig.2 Determination of the sensitivity of LAMP method for L. monocytogenes
2.3 污染食品中单核细胞增生李斯特菌LAMP检测灵敏度
将含有单核细胞增生李斯特菌菌体浓度相当于1.2×106CFU/g的鸡肉匀浆液进行10倍梯度稀释,以每个稀释度提取的基因组DNA作为模板,进行LAMP扩增,结果如图3所示。从每组反应管中溶液的实时浊度值可知,样品经105倍稀释后,LAMP扩增仍能有效进行,扩增产物经琼脂糖凝胶电泳检测,证实该LAMP方法针对污染食品中单核细胞增生李斯特菌的检测灵敏度为12CFU/反应管。
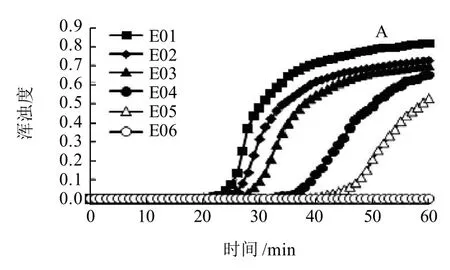

图3 污染食品中单核细胞增生李斯特菌LAMP方法灵敏度的确定Fig.3 Sensitivity of LAMP method for L. monocytogenes in contaminated foods
2.4 LAMP特异性实验
利用建立的单核细胞增生李斯特菌LAMP方法对表1中的29株细菌进行检测,结果表明:所试5株单核细胞增生李斯特菌均为LAMP阳性,而包括李斯特菌属其他菌株在内的27株细菌为阴性结果,说明本LAMP方法具有高度特异性。
2.5 验证实验
2010年1月至2011年3月期间,采用该LAMP方法对738份进出口食品样品、市场流通食品样品和人工污染食品样品进行了检测,结果见表3。其中,共检出23份单核细胞增生李斯特菌阳性样品,经国标法(GB/T 4789.30—2008)复检,两者检测结果符合率为100%,显示该LAMP方法具有良好的可靠性。
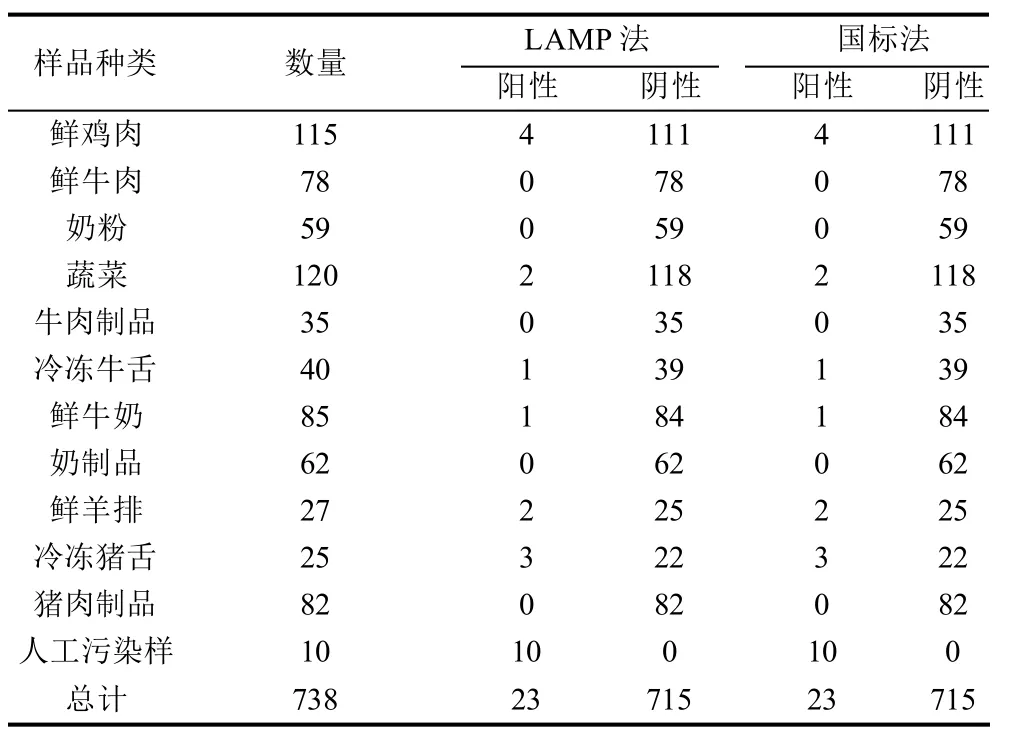
表3 LAMP方法实践检测Table 3 Practical applications of LAMP method
3 结 论
本研究建立的单核细胞增生李斯特菌LAMP快速检测方法操作简便、特异性强、灵敏度高,对单核细胞增生李斯特菌纯培养菌的检测灵敏度为8CFU/反应管,对污染食品中单核细胞增生李斯特菌的检测灵敏度为12CFU/反应管,60min内即可完成检测,达到快速检测目的。实践应用证明,本LAMP方法检测结果与国标法检测结果的符合率为100%,具有良好的实用性。
[1] JAY J M, LOESSNER M J, GOLDEN D A. 现代食品微生物学[M].何国庆, 丁立孝, 宫春波, 等, 译. 北京: 中国农业大学出版社, 2008.
[2] 何冬梅, 邓峰, 赖蔚苳, 等. 单核细胞增生李斯特菌生物学研究进展[J]. 华南预防医学, 2006, 32(6): 26-29.
[3] 余淑冰, 梁景涛, 周强忠, 等. 食品中单核细胞增生李斯特菌分离及药敏实验的研究[J]. 中国热带医学, 2004, 4(4): 515-516.
[4] 王刚, 邱阳, 王秋艳, 等. 食品中单核细胞增生李斯特氏菌快速检验的进展[J]. 检验检疫科学, 2007, 17(增刊1): 87-89.
[5] ZHOU Xiaohui, JIAO Xinan. Polymerase chain reaction detection ofListeria monocytogenesusing oligonucleotide primers targetingactAgene[J]. Food Control, 2005, 16(2): 125-130.
[6] NOTERMANS S H, DUFRENNE J, LEIMEISTER W, et al.Phosphatidylinositol-specific phospholipase C activity as a marker to distinguish between pathogenic and nonpathogenicListeriaspecies[J].Appl Environ Microbiol, 1991, 57(9): 2666-2670.
[7] REVAZISHVILI T, KOTETISHVILI M, STINE O C, et al. Comparative analysis of multilocus sequence typing and pulsed field gelelectrophoresis for haracterizingListeria monocytogenesstrains isolated from environmental and clinical sources[J]. J Clin Microbiol,2004, 42(1): 276-285.
[8] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12):63.
[9] MORI Y, NAGAMINE K, TMITA N, et al. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochem Biophy Res Co, 2001, 289(1):150-154.
[10] NAGAMINE K, WATANABE K, OHTSUKA K, et al. Loop-mediated isothermal amplification reaction using a nondenatured template[J]. Clin Chem, 2001, 47(9): 1742-1743.
[11] SONG T, TOMA C, NAKASONE N, et al. Sensitive and rapid detection ofShigellaand enteroinvasiveEscherichia coliby a loop-mediated isothermal amplification method[J]. FEMS Microbiol Lett, 2005, 243(1): 259-263.
[12] ENOMOTO Y, YOSHIKAWA T, IHIRA M, et al. Rapid diagnosis of herpes simplex virus infection by a loop-mediated isothermal amplification method[J]. J Clin Microbiol, 2005, 43(2): 951-955.
[13] SEKI M, YAMASHITA Y, TORIGOE H, et al. Loop-mediated isothermal amplification method targeting thelytAgene for detection ofStreptococcus pneumoniae[J]. J Clin Microbiol, 2005, 43(4): 1581-1586.
[14] YAMAZAKI W, TAGUCHI M, ISHIBASHI M, et al. Development and evaluation of a loop-mediated isothermal amplification assay for rapid and simple detection ofCampylobacter jejuniandCampylobacter coli[J]. J Med Microbiol, 2008, 57(4): 444-451.
[15] YAMAZAKI W, ISHIBASHI M, KAWAHARA R, et al. Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection ofVibrio parahaemolyticus[J]. BMC Microbiol, 2008, 8(9):163-169.
[16] YAMAZAKI W, SETO K, TAGUCHI M, et al. Sensitive and rapid detection of cholera toxin-producingVibrio choleraeusing a loop-mediated isothermal amplification[J]. BMC Microbiol, 2008, 8(6): 94-100.
[17] 徐义刚, 崔丽春, 杨君宏, 等. 食品中沙门氏菌 DNA环介导等温扩增快速检测方法的建立[J]. 中国兽医科学, 2010, 40(5): 452-458.
[18] 徐义刚, 李苏龙, 李丹丹, 等. 食品中金黄色葡萄球菌DNA环介导恒温扩增快速检测方法的建立与应用[J]. 中国农业科学, 2010, 43(8): 1655-1663.
[19] PILGRIM S, KOLB-MANRER A, GENTSCHEV I, et al. Deletion of the gene encoding p60 inListeria monocytogenesleads to abnormal cell division and loss of actin-based motility[J]. Infect Immunol, 2003, 71(6): 3473-3484.
[20] BUBERT A, KOHLER S, GOEBEL W. Homologous and heterologous regions within the iap gene allow genus- and species-specific identification ofListeriaspp. by polymerase chain reaction[J]. Appl Environ Microbiol, 1992, 58(8): 2625-2632.
Development of Loop-Mediated Isothermal Amplification Assay for Rapid Detection ofListeria monocytogenesin Foods
XU Yi-gang1,CUI Li-chun2,LI Dan-dan3,LIU Zhong-mei1,LI Su-long1,ZHANG Zi-qun1,ZHANG Guo-cai2,*
(1. Technical Centre of Inspection and Quarantine, Heilongjiang Entry-Exit Inspection and Quarantine Bureau, Harbin 150001, China;2. College of Forestry, Northeast Forestry University, Harbin 150040, China;3. Technical Centre of Inspection and Quarantine, Hainan Entry-Exit Inspection and Quarantine Bureau, Haikou 570125, China)
According to the iap gene ofListeria monocytogenes, two pairs of specific primers were designed, and then a rapid loop-mediated isothermal amplification (LAMP) assay for detectingListeria monocytogenesin foods was developed using realtime turbidity of the amplification byproduct magnesium pyrophosphate as the positive criterion. Twenty-nine bacterial strains were used to evaluate the specificity of the LAMP method. Our results showed that all testedListeria monocytogeneswere positive,while other strains were negative to LAMP detection, suggesting that this LAMP method was highly specific to the target bacteria. The sensitivity for cultivatedListeria monocytogenesand its contaminated foods were was 8 CFU and 12 CFU per test tube, respectively. The LAMP method developed in this study provides a sensitive, rapid and simple approach for the detection ofListeria monocytogenes.
Listeria monocytogenes;iapgene;LAMP;rapid detection
R155.5
A
1002-6630(2012)16-0137-05
2011-07-06
国家质检总局科技计划项目(2008IK162);黑龙江省博士后基金项目(LBH-Z09)
徐义刚(1978—),男,高级兽医师,博士后,研究方向为病原微生物防治与快速诊断技术。E-mail:yigangxu_china@yahoo.com.cn
*通信作者:张国财(1964—),男,教授,博士,研究方向为生物防治技术。E-mail:zhang640308@126.com

