大孔树脂纯化寒富苹果渣多酚工艺优化
吕春茂,宋雨涵,孟宪军,赵明慧,王 博
(沈阳农业大学食品学院,辽宁沈阳 110866)
大孔树脂纯化寒富苹果渣多酚工艺优化
吕春茂,宋雨涵*,孟宪军,赵明慧,王 博
(沈阳农业大学食品学院,辽宁沈阳 110866)
通过研究10种大孔树脂对寒富苹果渣多酚的静态吸附及解吸性能,筛选出一种最佳的大孔树脂,并利用这种树脂对寒富苹果多酚的纯化工艺进行优化。结果表明:HPD-826型树脂有较好的吸附和解吸性能,经实验确定其纯化苹果多酚的最佳动态吸附条件:苹果多酚提取液pH为5,浓度在0.5~0.8mg/mL之间,上样速度1mL/min;最佳洗脱条件:洗脱液为60%的乙醇溶液,解吸温度20℃,洗脱流速0.5mL/min。在此条件下,纯化样品的多酚纯度为52.26%。关键词:寒富苹果,多酚,大孔树脂,纯化
苹果 (Malus pum ila Mill),属于蔷薇科(Rosaceae)苹果属(Malus)落叶乔木。在世界范围均有种植,栽培历史悠久。苹果果实具有丰富的营养成分与食疗、辅助治疗等功能[1-2]。寒富苹果为沈阳农业大学李怀玉教授采用东光和富士杂交选育出的拥有自主知识产权的抗寒优质苹果品种[3]。苹果渣是苹果加工中的副产物,含有丰富的生物活性物质[4],它的综合利用不仅能提高企业的经济效益,还能避免大量的苹果废渣对环境造成污染。苹果多酚具有很高的药理、生理价值,因而广泛应用于医学、食品、日用化工等领域,发挥着不可替代的作用[5-6]。目前苹果多酚的提取主要采用有机溶剂提取法、超临界流体萃取、超声波辅助萃取法、微波辅助提取法等[7]。本研究利用有机溶剂提取法(超声波辅助提取),但得到的苹果多酚粗提物存在较多的杂质,因而需要进一步纯化。苹果多酚的分离纯化主要采用大孔树脂的柱层析技术[7]。大孔树脂是一种多孔性高分子吸附分离材料,比表面积很大,具有选择性强、吸附容量大、吸附速度快、解吸容易、成本低等优点[8]。本研究以筛选出的具有较佳吸附和解吸性能的树脂为介质,找出其最佳的吸附及解吸条件,并对寒富苹果渣中多酚粗提物进行初步纯化,以期为工业化生产提供有价值的参考意见。
1 材料与方法
1.1 材料与仪器
寒富苹果 采于沈阳市深井子金德胜果园; HPD-100、HPD-600、HPD-700、HPD-826、AB-8、S-8、WD-6、ADS-17、D101、D301 10种大孔树脂沧州宝恩吸附材料科技有限公司;没食子酸标准品、氢氧化钠 天津科密欧化学试剂有限公司;无水乙醇 天津市百世化工有限公司;钨酸钠、钼酸钠、硫酸锂 国药集团化学试剂有限公司;无水碳酸钠、盐酸 天津东华试剂厂;所有试剂 均为分析纯。
JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;TU-1810紫外可见分光光度计 北京普析通用仪器有限公司;DHG-9070A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;SHB-ⅢA循环水式真空泵 郑州长城科工贸有限公司;HH-6恒温水浴锅、SHA-C恒温水浴振荡器 常州国华电器有限公司;HL-25恒流泵 上海青浦沪西仪器厂; LG-5/12真空冷冻干燥机 北京广开源科学器材;榨汁机等。
1.2 实验方法
1.2.1 苹果多酚粗提物的制备 寒富苹果→苹果渣→乙醇溶液浸提(超声波辅助提取)→抽滤→真空浓缩→真空干燥→苹果多酚粗提物
1.2.2 苹果多酚含量测定方法 采用福林(Folin-Ciocalteus)法,以没食子酸为标准品测定苹果多酚提取液中多酚的含量。
提取液多酚物质含量的测定:从一定体积的提取液中吸取100μL置于10m L容量瓶中,加入福林试剂2.0m L,充分振荡后静置3~4m in,再加入10% Na2CO3溶液2.0m L,定容,摇匀置于25℃恒温水浴中反应2h,以试剂空白为对照,765nm下测定吸光度A765。根据标准曲线方程求得100μL待测液中多酚物质的含量,进一步算出提取液中多酚物质的含量[9-10]。
1.2.3 树脂的预处理及再生 各种大孔吸附树脂用无水乙醇在室温下密封浸泡8h,使其充分溶胀;然后用无水乙醇冲洗至无白色浑浊,蒸馏水洗至中性;再用5%的盐酸溶液浸泡8h,蒸馏水冲洗至中性;最后用5%的NaOH溶液浸泡8h,蒸馏水冲洗至中性,备用。
树脂每次处理过多酚后需再生,先用无水乙醇浸泡8h,用蒸馏水洗至中性后再按预处理方法用5%盐酸溶液和5%NaOH溶液处理,备用[11]。
1.2.4 静态吸附与解吸实验 准确称取用滤纸吸干表面水分的经过预处理的树脂1g(精确到0.0001g),置于250m L三角瓶中,加入已知浓度的苹果多酚粗提液100m L,避光密封,置于恒温水浴振荡器中,25℃,120 r/min振荡吸附使之达到吸附平衡。滤出树脂,用蒸馏水洗去表面残留多酚溶液后用滤纸吸干表面水分备用,FC法测定容液中剩余多酚浓度,根据以下公式计算树脂吸附率:

式中:Q为吸附量,mg/g;C0为粗提液中总多酚的起始浓度,mg/m L;Ce为吸附平衡时溶液中的总多酚浓度,mg/m L;VA为吸附液体积,m L;W为树脂质量(湿重),g;A为吸附率,%。
量取一定浓度的乙醇溶液100m L于25℃下振荡洗脱吸附了苹果多酚的树脂2h,FC法测定解吸液中总多酚浓度,计算洗脱率,公式如下:
洗脱率D(%)=CDVD/[(C0-Ce)×VA]×100%
式中:D为洗脱率,%;CD为洗脱液中总多酚浓度,mg/m L;VD为洗脱液体积,m L[12]。
以吸附量、吸附率、洗脱率这三个指标筛选出一种合适的树脂,并用这种树脂进行后续的静态和动态实验研究。
1.2.5 动态吸附与洗脱实验 准确量取经过预处理的树脂10m L,湿法装入1.6×60cm的层析柱中,用蒸馏水平衡后以一定流速上样并收集流出液,每10m L为一管,当流出液中多酚浓度达到上样液多酚浓度的10%时,即出现漏点,停止进样。根据流出液的总体积、吸附前以及吸附后粗提液中的多酚浓度计算动态吸附量。
吸附饱和后,用一定量蒸馏水洗去树脂表面残留的苹果多酚溶液及可溶性多糖等杂质后,以一定的流速用适当浓度的乙醇溶液洗脱,每10m L为一管分段收集洗脱液,测定洗脱液中多酚物质的含量,并绘制洗脱曲线[13-14]。合并多酚含量较高的洗脱液,制成苹果多酚样品粉末,计算回收率及样品多酚纯度,公式如下:
回收率R(%)=C2V2/C0V1×100%
式中:R为回收率,%;C0为粗提液中总多酚的起始浓度,mg/m L;V1为上样液的总体积,m L;C2为洗脱液中多酚浓度,mg/m L;V2为洗脱液体积,m L。
纯度P(%)=C2V2/M×100%
式中:P为样品中多酚纯度,%;M为多酚样品重量(干重),mg。
2 结果与分析
2.1 静态吸附与解吸实验
2.1.1 大孔吸附树脂的筛选 选择10种不同型号的大孔吸附树脂,通过静态实验考察其对苹果多酚的吸附及解吸性能,结果见图1。

图1 10种大孔树脂的吸附及解吸性能Fig.1 Adsorption and desorption properties of10 kinds of resins
通过图1可以看出,D301、S-8、HPD-100和HPD-826型树脂有较强的吸附能力,AB-8、HPD-600、HPD-700型树脂的吸附率也都超过了35%,D301、S-8、HPD-100、HPD-826型树脂和AB-8、HPD-600、HPD-700型树脂之间的吸附率差异显著(p<0.05)。但D301和S-8型树脂的解吸性能较差,说明大部分被吸附的多酚物质无法从树脂中分离出来,因而达不到分离纯化的目的。而HPD-700、HPD-826、ADS-17、HPD-600、HPD-100、WD-6型树脂的解吸性能则较好,解吸率较高,这六种树脂的解吸率差异不显著(p>0.05)。综合分析,HPD-826型树脂不仅有较好的吸附能力(吸附率50.50%),解吸性能也很强(解吸率84.13%),因此本实验选用HPD-826型树脂作为分离纯化寒富苹果多酚的材料。
2.1.2 HPD-826型树脂的静态吸附动力学实验 进行静态吸附实验时,定时从上清液中取样,测定多酚含量,绘制静态吸附曲线。吸附速度是树脂吸附性能的重要参考指标[15]。由图2可知,在吸附的初始阶段,HPD-826型树脂吸附苹果多酚的速率非常快,吸附1h时树脂对多酚的吸附量就达到了吸附总量的71.45%,2h时达到了87.20%,说明HPD-826型树脂对苹果多酚的选择性较强。随着时间的延长吸附速率急剧下降,吸附6h时吸附量为总吸附量的98.56%。随后树脂的吸附量缓慢增加,12h时基本趋于吸附饱和状态。
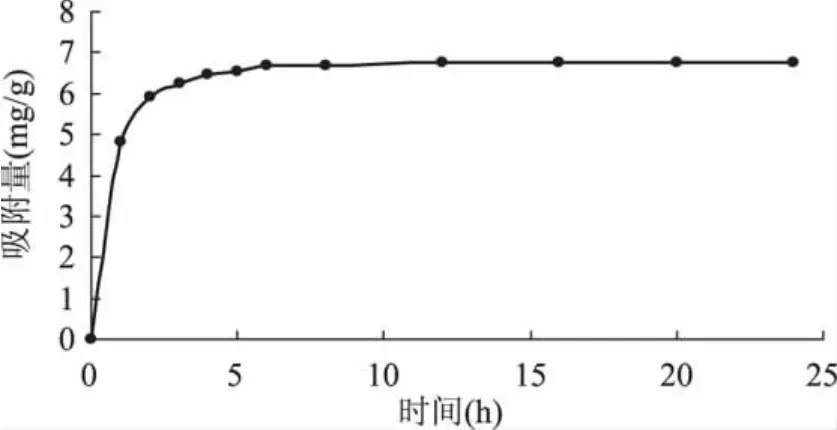
图2 HPD-826型树脂的静态吸附曲线Fig.2 Static adsorption curve of HPD-826 resin
2.1.3 提取液pH对吸附量的影响 从图3中可以看出,溶液的pH过高或过低时,树脂的吸附量都相对较低,当溶液的pH为5时,树脂对苹果多酚的吸附量最高,为7.57mg/g。通常情况下,酸性物质在适当的酸性溶液中被吸附的较好,碱性物质在适当的碱性溶液中可被充分吸附,中性物质则在中性条件下被吸附的较好[16]。苹果多酚具有多酚结构,也包含一些酚酸类物质,如绿原酸等,其提取液呈酸性[17],因此弱酸性溶液有利于多酚物质的吸附,所以调整溶液的pH为5可提高树脂的饱和吸附量。
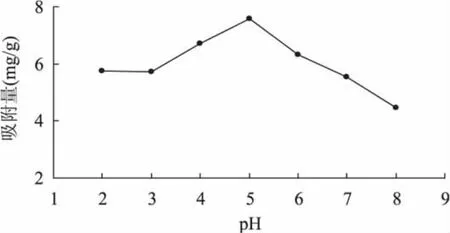
图3 pH对吸附量的影响Fig.3 Effect of pH value on adsorption ratio
2.1.4 提取液浓度对吸附量的影响 由图4可知,当溶液中多酚物质浓度较低时,随着溶液浓度的增大,吸附量也随之增大。当粗提液中多酚浓度增加到0.7613mg/m L时,吸附量最大,达到了16.53mg/g。但如果继续增大粗提液的浓度,溶液中不仅会出现絮凝和沉淀,吸附量也呈下降的趋势。这可能是由于粗提液中多酚浓度较低时,浓度的增大可以加强多酚分子与树脂的接触,加速多酚分子进入树脂内部并迅速扩散。而当粗提液浓度增大到一定程度后,树脂表面接触的多酚分子过多,互相有一定的阻碍作用,影响多酚分子在树脂内部的扩散,导致树脂吸附量下降。同时,浓度增加,粗提液中能与多酚竞争吸附的杂质也会增加[18]。因此,多酚溶液的浓度应控制在0.5~0.8mg/m L之间。
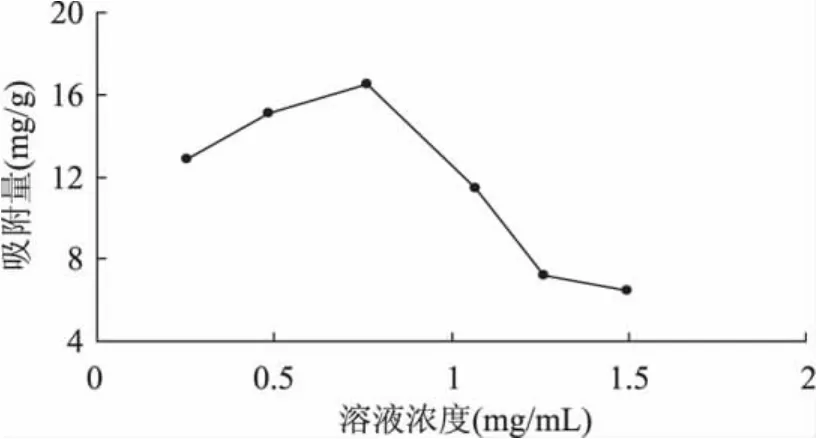
图4 溶液浓度对吸附量的影响Fig.4 Effect of solutiong concentration on adsorption ratio
2.1.5 解吸温度对解吸率的影响 吸附饱和的树脂在不同的温度下进行解吸实验,结果如图5所示,随着解吸温度的升高,树脂的解吸率呈下降的趋势。在20℃时,解吸效果最好,解吸率为84.26%,所以将温度控制在20℃左右将有利于树脂的解吸。

图5 温度对解吸率的影响Fig.5 Effect of temperature on desorption ratio
2.1.6 解吸剂浓度对解吸率的影响 本实验选择安全无毒的乙醇作为解吸剂。由图6可知,在乙醇浓度较低的条件下,增加乙醇溶液浓度,解吸率也随之增加,这可能是因为乙醇浓度较低时无法有效地破坏树脂与多酚之间形成的氢键,以致解吸率较低[19]。当乙醇浓度增加到60%时,解吸率为85.24%,继续增加乙醇浓度解吸率虽稍有下降,但也相对较高。考虑到高浓度乙醇易挥发且增加生产成本,选择60%的乙醇作为解吸剂较为合适。
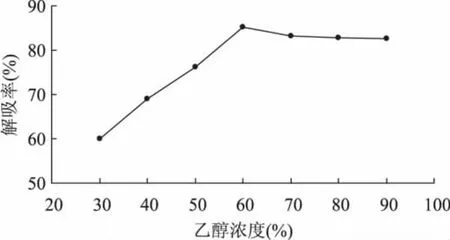
图6 乙醇浓度对解吸率的影响Fig.6 Effect of the concentration of ethanol on desorption ratio
2.2 动态吸附与洗脱实验
2.2.1 上样速率对动态吸附量的影响 上样速率主要是影响溶质向树脂表面的扩散,流速不同则树脂达到吸附饱和时的吸附量也不同。上样速度慢,虽有利于树脂对多酚物质的吸附,可是会延长树脂达到吸附饱和的时间,降低树脂吸附的效率。但当上样速率过大时,溶液中的多酚物质还未扩散到树脂的内表面,就被冲出柱子,从而造成树脂吸附率的下降[20]。从图7中可以看出,随着上样速率的增加,树脂对多酚的吸附量反而降低,上样速率为2.5m L/min时,树脂的吸附量仅为2.30mg/m L。上样速率为0.5m L/min时,吸附量最高,为6.06mg/m L。上样速率为1.0m L/m in时吸附量略低于0.5m L/m in上样的吸附量,为5.93mg/m L,相差不大。考虑到树脂的吸附量和工作效率的问题,控制上样速率为1.0m L/min较好。
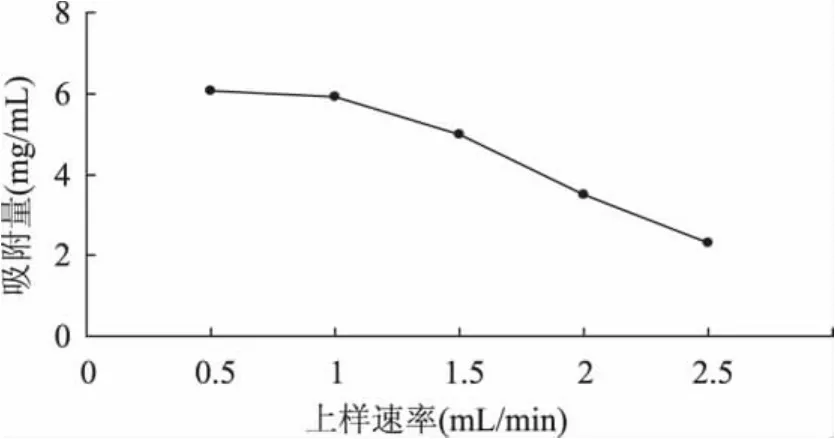
图7 上样速率对吸附量的影响Fig.7 Effect of feeding rate on adsorption capacity
2.2.2 洗脱速率对洗脱效果的影响 根据上述实验确定的吸附流速,选择0.5、1.0m L/m in两个洗脱速率来考察动态洗脱的效果[21]。从图8可以看出,少量的洗脱剂就可将吸附在树脂上的苹果多酚洗脱下来,但不同的洗脱速率对洗脱效果有较大的影响。以0.5m L/m in的速率进行洗脱时,峰形较集中,洗脱率可达到89.24%。其中2~4BV的洗脱液中多酚物质含量较高,合并多酚含量较高的洗脱液,经计算回收率可达到65.72%。合并的洗脱液经旋转蒸发浓缩后真空冷冻干燥得苹果多酚样品,纯度为52.26%。以1.0m L/m in的速率洗脱则洗脱带略宽,稍有拖尾现象,洗脱率只有79.59%,洗脱不完全。因为较低的速度能增加洗脱剂在树脂柱中停留的时间,有利于洗脱剂向树脂内部扩散,从而将苹果多酚从树脂中洗脱出来。因此选择0.5m L/min的洗脱流速。
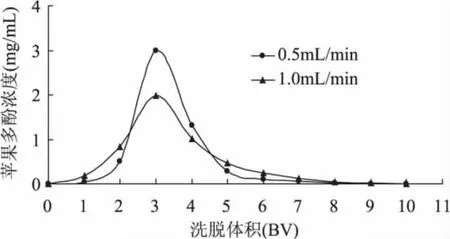
图8 动态洗脱曲线Fig.8 Dynamic elution curve
3 结论
3.1 通过静态吸附和解吸实验得出,HPD-826型树脂具有良好的吸附和解吸性能。并且由静态吸附动力学实验可以看出HPD-826型树脂对多酚的吸附速度较快,是初步分离纯化寒富苹果多酚的优良材料。
3.2 当多酚溶液浓度为0.5~0.8mg/m L,pH为5时,以1.0m L/m in的流速上样,HPD-826型树脂对寒富苹果多酚的吸附量较高。
3.3 在20℃以60%的乙醇作为洗脱剂,洗脱流速为0.5m L/m in时,洗脱效果较好,洗脱率为89.24%。洗脱液经浓缩干燥,多酚纯度可达52.26%。
[1]唐传核.植物功能性食品[M].北京:化学工业出版社,2004:228-242.
[2]姬德衡,孔繁东,侯青春.苹果多酚的开发与应用[J].中国果蔬,2001(2):26-27.
[3]赵德英,刘国成,吕德国,等.寒富苹果特异性状评价[J].果树学报,2009,26(1):6-12.
[4]白雪莲,岳田利,章华伟,等.响应曲面法优化苹果渣多酚纯化工艺[J].食品科学,2010,31(14):32-36.
[5]赵京矗.苹果多酚的特性及其应用[J].中国食物与营养,2010(3):24-25.
[6]Shoji T,Akazome Y,Kanda T,et al.The toxicology and safety of apple polyphenol extract[J].Food and Chemical Toxicology,2004,42(6):959-967.
[7]王博,王新现,吕春茂,等.苹果渣中多酚类物质的提取和应用研究进展[J].食品工业科技,2011(6):421-423.
[8]张茜,贾冬英,姚开,等.大孔吸附树脂纯化石榴皮多酚[J].精细化工,2007,24(4):345-349.
[9]郭娟,艾志录,崔建涛,等.苹果渣中多酚物质的福林法测定[J].食品工业科技,2006,27(2):178-180.
[10]郑虎哲,Hye-Ryun Lee,Sang-Han Lee,等.果胶酶对苹果渣中多酚类物质的提取效果研究[J].分析化学研究报告,2008,32(3):306-310.
[11]李建新.1-MCP对苹果贮藏期间多酚物质含量变化的影响及苹果多酚的纯化、功效研究[D].郑州:河南农业大学,2008.
[12]王丽媛,苗利利,仇农学.苹果渣中高纯度多酚物质的制备及体外抗氧化活性评价[J].农产品加工·学刊,2009(3): 29-33.
[13]吕群金,衣杰荣,丁勇.大孔吸附树脂对杨桃渣多酚吸附分离的优化[J].食品科学,2010,31(6):39-42.
[14]王育红,朱维军,潘治利,等.NKA-9大孔树脂对苹果多酚的动态吸附工艺优化[J].农业机械学报,2009,40(8): 119-123.
[15]朱静,陆晶晶,袁其朋.大孔吸附树脂对石榴皮多酚的分离纯化[J].食品科技,2010,35(1):188-193.
[16]龚志华,任国谱,舒青孝,等.大孔吸附树脂分离纯化金银花绿原酸研究[J].分析测试学报,2001,30(1):85-90.
[17]王育红.大孔树脂吸附苹果多酚特性及苹果多酚功效研究[D].郑州:河南农业大学,2007.
[18]艾志录,王育红,王海,等.大孔树脂对苹果渣中多酚物质的吸附研究[J].农业工程学报,2007,23(8):245-248.
[19]叶燕彬,李希璇,郜文,等.大孔吸附树脂分离纯化元宝枫叶总多酚[J].首都医科大学学报,2010,31(5):629-632.
[20]郭娟.苹果渣中苹果多酚的提取、纯化及功效研究[D].郑州:河南农业大学,2006.
[21]张泽生,徐英.大孔吸附树脂对苹果渣中苹果多酚吸附性能的研究[J].食品研究与开发,2006,27(9):24-27.
Optim ization of purification process of Hanfu apple pomace polyphenols w ith macroporous absorbent resin
LV Chun-mao,SONG Yu-han*,MENG Xian-jun,ZHAO M ing-hui,WANG Bo
(College of Food Science,Shenyang Agriculture University,Shenyang 110866,China)
Accrod ing to the p roperties of static adsorp tion and desorp tion of 10 kinds ofmacroporous absorbent resin for polyphenols in Hanfu app le pomace,the best one was sc reened to op tim ize the purified technology of app le polyphenols from Hanfu app le polyphenols.Results indicated that:mac roporous resin HPD-826 had the best p roperties of adsorp tion and desorp tion.The op timal adsorp tion conditions of app le polyphenols purification were determ ined as follows:app le polyphenols solution pH 5,solution concentration of app le polyphenols 0.5~0.8mg/m L,feed ing speed 1m L/m in.And the op timal desorp tion cond itions were ethanol concentration 60%,desorp tion temperature 20℃,elution speed 0.5m L/m in.Under these cond itions,the content of app le polyphenols in purified p roductwas 52.26%.
Hanfu app le;polyphenols;macroporous absorbent resin;purification
TS255.1
B
1002-0306(2012)06-0300-05
2011-06-21 *通讯联系人
吕春茂(1970-),男,博士,副教授,主要从事食品生物技术及其在果品深加工中应用的研究。
沈阳市大型仪器共享项目(4130199-1102-01083909001)。

