H3N2亚型猪流感病毒多克隆抗体的制备及间接ELISA方法的建立
陈国花 (山东省诸城市畜牧兽医管理局 266600)
H3N2亚型猪流感病毒多克隆抗体的制备及间接ELISA方法的建立
陈国花 (山东省诸城市畜牧兽医管理局 266600)
本试验将初步纯化的H3N2猪流感病毒注入到新西兰大白兔体内,获得了抗猪流感病毒多克隆抗体,以纯化后的猪流感病毒为抗原,初步建立了间接ELISA检测方法,确定了抗原最佳包被浓度为41.25µg/ml,血清的最佳稀释度为1:400,酶标抗体的最佳稀释度为1:1000,一抗的最佳作用时间为30min。
H3N2 猪流感病毒 多克隆抗体 间接ELISA
猪流感(Swine Influenza , SI)是全世界养猪国家常遇到的一种呼吸道疾病[1]。SIV属正粘病毒科A型流感病毒[2],对呼吸道上皮细胞具有高度亲嗜性,故SIV感染的主要部位是支气管和细支气管上皮;呼吸道末梢部分的黏膜感染是诱发猪肺炎的重要原因。猪具有AIV和人流感病毒的受体,成为毒株间基因重配的活载体[3],因此猪在流感病毒的禽-猪-人的种间传播过程中,扮演着流感病毒中间宿主和多重宿主的作用。
1 材料与方法
1.1 材料
1.1.1 主要仪器 高速台式离心机(上海安亭科学仪器厂)、紫外分光光度计UV2550(日本岛津公司)、5ml注射器、漩涡震荡器MM-1(恒丰仪器厂)。
1.1.2 主要试剂 H3N2亚型的SIV、新鲜鸡红细胞、甲醛、生理盐水、弗氏不完全佐剂(FIA)弗氏完全佐剂(FCA)(Sigma公司)、HRP标记的羊抗兔IgG(北京中杉金桥公司)。试剂由诸城市畜牧局检测中心实险室保存。
1.1.3 试验动物 鸡1只、新西兰大白兔2只。
1.2 方法
1.2.1 SIV的纯化 甲醛处理的红细胞吸附释放法。(1)取1ml 50%新鲜鸡红细胞加入1ml36%甲醛,充分混匀。(2)置4℃48h,每隔3h混匀1次。(3)2000rpm离心10min后弃去上清,剩余沉淀物中加入10ml生理盐水混匀。(4)2000rpm离心10min后弃去上清,然后加入10ml生理盐水进行再次洗涤,重复洗涤6次。(5)加500ml生理盐水配成50%甲醛处理过的鸡红细胞悬液。(6)取现有的SIV15ml,2000rpm离心30min后去沉渣,收集上清液。(7)取600ml 50%甲醛处理过的鸡红细胞悬液加入刚收集的上清液中,混匀,置4℃40min。(8)1500rpm离心10min后弃上清(另外收集该上清测血凝效价)。(9)残留沉淀物中加入500ml生理盐水,37℃水浴4h,每隔20min震摇1次。(10)1500rpm离心10min后收取上清并检测血凝效价。
1.2.2 SIV浓度的测定 用生理盐水作空白对照,紫外分光光度计测定纯化的SIV的OD280nm,OD260nm,计算SIV浓度。计算公式为:病毒浓度(mg/ml)=1.45×OD280nm-0.74×OD260nm。
1.2.3 多克隆抗体的制备 取2只2.5~3kg新西兰大白兔,用纯化的SIV与等量弗氏完全佐剂完全乳化后,脊柱两侧选6~8点皮下注射,2mg/只。二免、三免、四免分别于首免后2、4和6周用弗氏不完全佐剂与SIV乳化后作为抗原进行注射,部位相同,3mg/只。四免后心脏采血,分离血清,-20℃保存备用。
1.2.4 间接ELISA反应程序 (1)包被:将抗原用包被液稀释,加入96孔板,100µl/孔,置湿盒,4℃过夜。(2)洗涤:甩干包被液,用PBST洗涤3~5次,3~5min/次。(3)封闭:加入封闭液,100µl/孔,置湿盒,37℃孵育1h,甩干,同上洗涤。(4)加样:血清用抗体稀释液适当稀释,100µl/孔,置湿盒,37℃孵育1h,甩干,同上洗涤。(5)加二抗:用二抗稀释液将HRP标记的羊抗兔IgG稀释至工作浓度,100µl/孔,置湿盒,37℃孵育1h,甩干,同上洗涤。(6)加底物:每孔加入新鲜配制的底物溶液,100µl/孔,避光显色10min。(7)终止:加入2M H2SO4,50µl/孔,终止反应。(8)测OD值:用自动酶标仪测定各孔OD490 nm。
1.2.5 最佳抗原和血清浓度的确定 以方阵法测定,将抗原自50、100、200、400、800、1600倍稀释包被酶标板,将阴阳性血清自100、200、400、800、1600、3200倍稀释酶标板,作ELISA测定,用酶标板测定490nm波长下的OD值。取P/N最大,阳性OD490nm值在1.0附近,稀释倍数为最佳的抗原浓度,该点对应的抗体稀释度为最佳的抗体稀释度。
1.2.6 二抗最佳稀释度试验 以最适抗原包被浓度包被酶标板,倒掉包被液,PBST洗涤4次,3~5min/次。封闭液封闭3h,PBST洗涤4次。血清按最佳稀释度加入后反应60min,PBST洗涤4次,兔抗猪IgG-HRP选择1:500、1:1000、1:1500、1:2000四个稀释度,作用完后加入底物来确定最佳的抗体稀释度。
2 结果与分析
2.1 血凝效价
纯化前SIV效价为2-9,纯化后的SIV效价为2-9,前后保持一致。
2.2 病毒含量
紫外分光光度计测定纯化的SIV的OD280nm=0.780,OD260nm=0.414。因此,病毒浓度(mg/ml)=1.45×OD280nm-0.74×OD260nm=1.45×0.780-0.74×0.414=0.825(mg/ml)。由于该浓度是稀释5倍后的浓度,故原始浓度为4.125mg/ml。
2.3 最佳抗原和血清浓度
经多次方阵试验,当抗原1:100,血清1:400稀释时,P/N最大,OD490nm值接近于1.0。所以选择1:100为抗原最佳包被浓度(41.25µg/ml),血清的最佳稀释度为1:400。结果见表1。

表1 SIV最佳抗原包被浓度和最佳血清浓度的确定
2.4 酶标二抗最适稀释度的确定
SIV抗原和血清都按照最佳稀释度进行试验,封闭液选择最佳封闭液,HRP标记的羊抗兔IgG分别用1:500、1:1000、1:1500、1:2000四个稀释度,结果见表2。
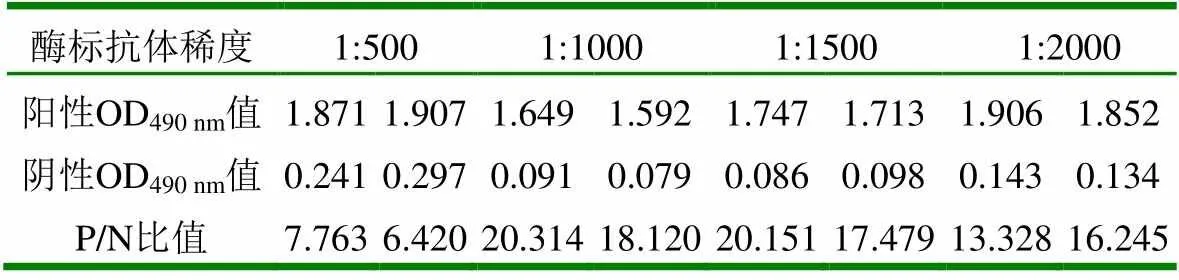
表2 二抗最佳稀释度的确定
从表2可以看出,当二抗稀释度为1:1000时,P/N比值最大,因此选择酶标抗体的最佳稀释度为1:1000。
2.5 一抗最佳作用时间的确定
将一抗选取30min,60min,90min,120min 4个作用时间进行试验,结果见表3。
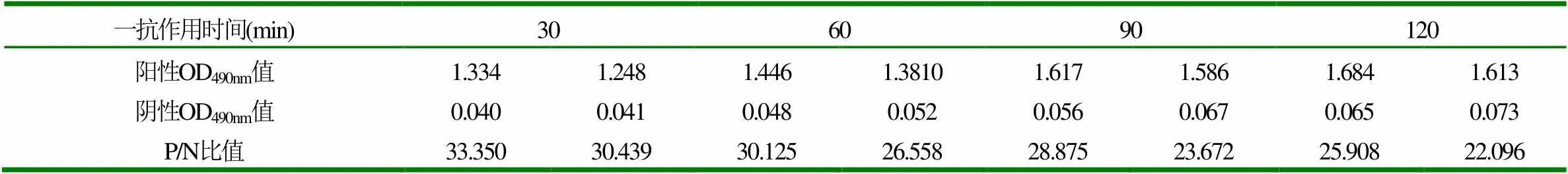
表3 血清最适结合时间的确定
从表3可以看出,当抗原抗体的作用时间为30min时P/N比值最大,因此确定一抗的最佳作用时间为30min。
2.6 特异性试验
按照已建立的检测方法,将猪细小(PPV)、猪圆环(PCV)、猪蓝耳(PRRSV)包被ELISA板进行特异性反应的测定,结果见表4,从表4结果可以看出,与PPV、PCV、PRRSV的反应均呈阴性,无交叉反应性,表明该方法具有较好的特异性。

表4 间接ELISA方法的特异性试验
3 讨论与结论
病毒的纯化一直是病毒学研究的一个难点,密度梯度离心是病毒纯化最常用的方法[4,5]。该方法精密度较高,使用该方法如果密度梯度选择恰当可以受到比较满意的效果,但是该方法操作过程比较繁琐,需要特殊仪器设备-超速离心机。鸡红细胞表面含有血凝素的受体唾液酸,血凝素可以与之结合并发生凝集,随后在一定的温度条件下流感病毒又可与鸡红细胞分离,而使用甲醛处理过的鸡红细胞无溶血现象,因此根据流感病毒的这一特性可以使用甲醛处理的红细胞吸附释放法来纯化流感病毒。通过2种纯化流感病毒方法的对比研究,认为甲醛处理的红细胞吸附释放法是一种操作简单,易于掌握,而且对设备要求不高,经济实用的纯化流感病毒的方法,值得推广,特别是使用甲醛处理过的鸡红细胞纯化效果更理想。
ELISA尽管具有高灵敏、强特异的优点,但是其结果却受操作影响很大,每个步骤包括加样、温育、洗涤、显色,都有可能对试验结果产生不利影响。如洗涤在ELISA过程中虽不是一个反应步骤,但却也可能决定着试验的成败。ELISA就是靠洗涤来达到分离游离的和结合的酶标记物的目的。通过洗涤以清除残留在板中没能与固相抗原或抗体结合的物质,以及在反应过程中非特异性的吸附于固相载体的干扰物质。聚苯乙烯等塑料等对蛋白质的吸附是普遍性的,而在洗涤时又应把这种非特异性的干扰物质洗涤下来。如果洗涤不彻底,特别是在最后一次,如有酶结合物的非特异性吸附,将使空白值升高。可以说在ELISA操作中,洗涤是一个关键技术,但是大家往往会忽略,这应引起高度重视。
[1] 卢中华, 王自振, 王亚宾等. 猪流行性感冒[J]. 河南畜牧兽医. 2001 增刊. 86-88.
[2] 斯特劳.赵德明等译. 猪病学(第8版)[M]. 北京:中国农业大学出版社, 2000, 665-669.
[3] Joe Vansickle Sr. Swine flu ranks third in pneumonia cases. National Hog Farmer.Nov 15, 2000. Vol. 45, Iss. 11; p. 14 (2 pages).
[4] 陈丽军, 王英, 胡建华等. 应用等密度梯度离心法提纯传染性支气管炎病毒[J]. 上海农业学报, 1998, 14(3):93-95.
[5] Lee KC, Lim D, Wong SM, et al.Purification, crystallization and X-ray analysis of hibiscus chlorotic ringspot virus[J]. Acta Crystallogr, 2003, 59(8):1481-1483.
(2011–11–14)
S859.79
A
1007-1733(2012)02-0003-04

