苏氨酸铬的安全性初步评价
乔李娜,胡晓波,聂少平,龚 毅,陶 浚,冯建萍,谢明勇
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
苏氨酸铬的安全性初步评价
乔李娜,胡晓波,聂少平,龚 毅,陶 浚,冯建萍,谢明勇*
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
对一种新型氨基酸微量元素螯合物——苏氨酸铬的安全性进行初步评价。以SD大鼠为研究对象,进行了30d喂养实验。结果表明:在实验期间,实验组和空白组动物情况良好,无异常症状和体征,也无中毒死亡情况发生;实验组雌、雄大鼠的体重、摄食量与食物利用率等都与空白组在统计学上无显著性差异。血液学指标、血液生化指标及脏器重量与空白组在统计学上无显著性差异。结论:苏氨酸铬对大鼠的生长、发育无明显影响,对脏器无明显损伤。
苏氨酸铬,30d喂养,安全性
近年来,许多研究表明,在碳水化合物、脂质代谢和胰岛素系统中[1-2],铬(Chromium,Cr3+) 一直被视为一个基本要素[3-5],起着非常重要的作用。因此,铬作为营养补充剂在减肥、肌肉发育和糖尿病治疗中应用非常广泛。由于铬缺乏与Ⅱ型糖尿病、心血管疾病以及神经系统紊乱等疾病有关,而适量补铬可改善葡萄糖耐量、预防动脉粥样硬化、增强机体免疫功能。因此,铬作为营养强化剂的安全性研究备受关注。铬补充剂分为无机铬和有机铬两类,无机铬的吸收率非常低,只有0.4%~3%,甚至更低[6],而有机铬的吸收率相对较高,可以达到无机铬的10倍以上,高达10%~25%[7]。有机铬包括吡啶甲酸铬(CrPic)、组氨酸铬(CrHis)、铬烟(CrNic,也被称为烟酸铬)、D-苯丙氨酸铬(Cr(D-phe)3)等。Stout M D等对吡啶甲酸铬的毒性及致癌性进行了研究,结果表明吡啶甲酸铬对雌性大鼠或雌雄性小鼠无致癌作用[8]。张华对蛋氨酸铬的急性毒性进行了研究,结果表明蛋氨酸铬是安全无毒的化学物质[9]。Halina Staniek等对甘氨酸铬的急性毒性进行研究,结果表明甘氨酸铬口服单剂量(2000g/kg·bw),无任何死亡例,并且没有造成任何肝、肾组织病理变化[10]。苏氨酸铬[11](Chromium threoninate chelate,CrThr) 作为一种新合成的营养强化剂,在补充铬的同时还能提供人体和动物所必需的氨基酸——苏氨酸[12],具有吸收好、稳定性高、生物效价高等优点。本研究通过30d喂养实验,对受试大鼠的行为、死亡情况、脏器器官进行了观察,对其安全性做出初步评价。
1 材料与方法
1.1 材料与仪器
苏氨酸铬 南昌大学食品科学与技术国家重点实验室,由苏氨酸和氯化铬通过水热合成、真空干燥、粉碎后过80目筛制得,铬含量为12.80%;水合氯醛 成都市科龙化工试剂厂,分析纯;中性缓冲固定液 天津致远化学试剂有限公司,分析纯。
SD(Sprague-Dawley)健康大鼠 南昌大学实验动物科学部,清洁级,受试动物在温度为20~25℃、相对湿度为40%~70%的环境下饲养,自由采食和饮水,受试动物所用饲料为实验动物配合饲料,由南昌大学实验动物科学部提供,按照国标GB 14924.3-2010[13]配制。
FA1004电子分析天平 上海上平仪器公司;DT1000A电子天平 江苏常熟市意欧仪器仪表公司;XS-800i五分类血细胞测定仪 日本东亚Sysmex公司;TGL-16C高速台式离心机 上海安亭科学仪器厂;Dimension RXLMAX全自动生化分析仪
表1苏氨酸铬对大鼠体重的影响(±s,n=10)Table 1Effect of chromium threoninate on body weight of rats(¯x±s,n=10)
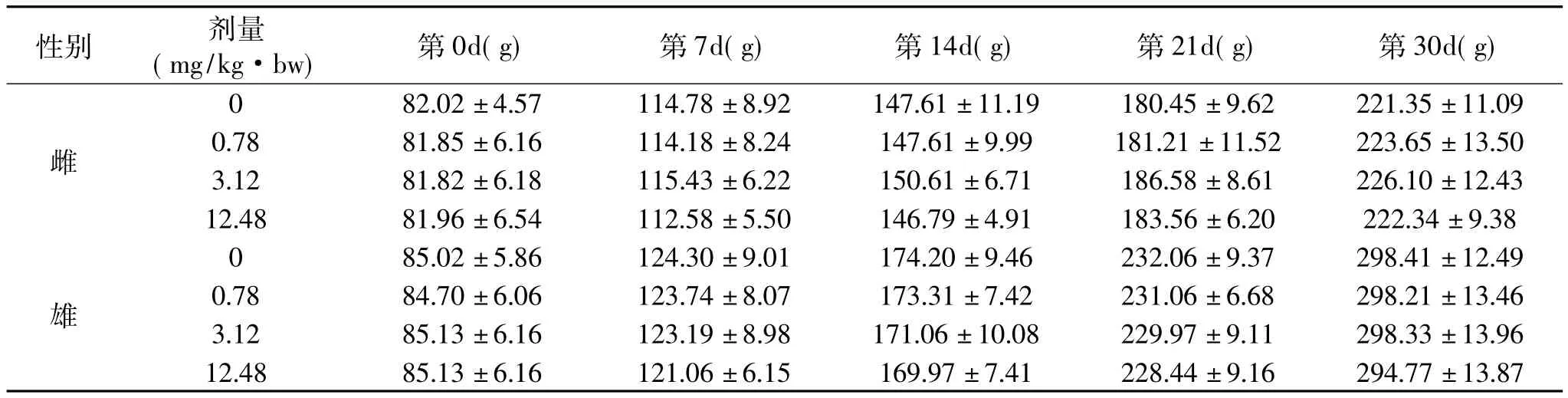
表1苏氨酸铬对大鼠体重的影响(±s,n=10)Table 1Effect of chromium threoninate on body weight of rats(¯x±s,n=10)
性别 剂量(mg/kg·bw) 第0d(g) 第7d(g) 第14d(g) 第21d(g) 第30d(g)雌82.02±4.57 114.78±8.92 147.61±11.19 180.45±9.62 221.35±11.09 0.78 81.85±6.16 114.18±8.24 147.61±9.99 181.21±11.52 223.65±13.50 3.12 81.82±6.18 115.43±6.22 150.61±6.71 186.58±8.61 226.10±12.43 12.48 81.96±6.54 112.58±5.50 146.79±4.91 18 0 3.56±6.20 222.34±9.38 85.02±5.86 124.30±9.01 174.20±9.46 232.06±9.37 298.41±12.49 0.78 84.70±6.06 123.74±8.07 173.31±7.42 231.06±6.68 298.21±13.46 3.12 85.13±6.16 123.19±8.98 171.06±10.08 229.97±9.11 298.33±13.96 12.48 85.13±6.16 121.06±6.15 169.97±7.41 22 0雄8.44±9.16 294.77±13.87
徳灵诊断产品有限公司;RM2235全新手动轮转切片机 德国Leica公司;KD-TS3D生物组织脱水机、KD-BM、BL生物组织冷冻包埋机、KD-2258轮转切片机 浙江金华市科迪仪器设备有限公司;BX41显微镜 日本OLYMPUS公司。
1.2 实验方法
1.2.1 剂量与分组 本实验选用清洁级SD健康大鼠80只,雌、雄各半。实验方法参照中华人民共和国国家标准 GB15193.13-2003[14]。将受试动物进行适应性饲养3d后,禁食16h(自由饮水),然后对其进行称重并记录,按体重将受试动物随机分成4个剂量组,每组 20只,雌、雄各半。设 0.78、3.12、12.48mg/kg·bw低、中、高三个剂量组(根据Estimated Safeand AdequateDailDietaryIntake,ESADDI推荐成人铬每日摄入量[15],分别为人体推荐摄入量的100、400、1600倍),另设一个空白组。用超纯水将样品分别配制成0.078、0.312、1.248mg/mL苏氨酸铬溶液。按10mL/kg·bw的体积给相应的剂量组动物灌胃,空白组用等体积的超纯水,每天灌胃一次。所有动物每周称2次体重,根据体重来调整灌胃体积。实验期间所有动物给予普通饲料,自由进食饮水,连续灌胃30d。实验结束后对大鼠进行腹腔注射10%的水合氯醛麻醉,麻醉后进行心脏取血,分别进行血液学指标及血液生化指标的测定,最后处死,对各项主要病理学指标进行观察测定。
1.2.2 观测指标[16]
1.2.2.1 大鼠的一般表现 每天观察并记录动物的一般表现、行为、中毒表现和死亡情况。计算动物每周及总的增重。
1.2.2.2 食物利用率 每周测2次动物的食物摄入量,计算每周及总的食物利用率。
1.2.2.3 血液学指标 将血液滴入加有EDTA-K2的抗凝管中,用手指轻轻弹击抗凝管,防止血液凝固。然后用血细胞测定仪测定全血中红细胞计数(RBC)、血红蛋白含量(HGB)、白细胞计数(WBC)及其分类,并将各剂量组血液学指标与空白组进行比较,考察苏氨酸铬对大鼠血液学指标的影响。
1.2.2.4 血液生化指标 将血液收集在离心管中,在常温下静置1h后,4000r/min离心5min,用移液枪吸取300μL大鼠血清,用全自动生化分析仪测定其血液生化指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐(CREA)、总胆固醇(GHOL)、甘油三酯(TGL)、血糖(GLU)含量,并将各剂量组血液生化指标与空白组进行比较,考察苏氨酸铬对大鼠血液生化指标的影响。
1.2.2.5 大体解剖与脏器称量 心脏取血后,处死大鼠并进行大体解剖,用肉眼观察各脏器形态,看其有无明显病变。然后小心分离其肝脏、肾脏、脾脏、睾丸、卵巢,用生理盐水洗净,滤纸吸水后称重,分别计算肝脏、肾脏、脾脏、睾丸、卵巢的绝对重量以及相对重量(脏/体),将各剂量组大鼠的脏器重量与空白组进行比较,考察苏氨酸铬对大鼠脏器重量的影响。
1.2.2.6 组织病理学检查 解剖后,取大鼠肝脏、脾脏、肾脏、胃、十二指肠、睾丸、卵巢用中性缓冲固定液(福尔马林)固定,石蜡包埋,切片,H.E染色后在显微镜下进行组织病理学检查。
1.3 数据处理
所有满足方差齐性要求的数据用¯x±s表示,SPSS 11.5软件处理数据,组间比较采用单因素方差分析(One-Way ANOVA),以α=0.05为检验标准,p<0.05表明在统计学上有显著性差异,p<0.01表明在统计学上有极显著性差异。
2 结果与讨论
2.1 一般观察在实验期间,实验组和空白组动物一般情况良好,无异常症状和体征,也无中毒死亡情况。
2.2 苏氨酸铬对大鼠体重的影响
由表1可见,实验组与空白组比较,雌、雄大鼠初始体重、第7d、第14d、第21d以及第30d的体重在统计学上均无显著性差异(p>0.05)。
从表2可以看出,实验组雌、雄大鼠每周体重增重和总的增重与空白组比较在统计学上均无显著性差异(p>0.05)。由此表明苏氨酸铬对雌、雄大鼠的体重、体重增重都无明显的影响。
2.3 苏氨酸铬对大鼠食物利用率的影响
由表3及表4可见,实验组雌、雄大鼠与空白组比较,摄食量与食物利用率在统计学上均无显著性差异(p>0.05)。表明苏氨酸铬对雌、雄大鼠的摄食量与食物利用率都无明显影响。
2.4 苏氨酸铬对大鼠血液学指标的影响
从表5中可以看出,实验组雌、雄大鼠的RBC、HGB、WBC及其分类与空白组比较在统计学上均无显著性差异(p>0.05),且其结果均在正常范围内[17-18],表明苏氨酸铬对大鼠的 RBC、HGB、WBC 及其分类均无明显影响。
表2苏氨酸铬对各组大鼠体重增重的影响(±s,n=10)Table 2Effect of chromium threoninate on body weight gain of rats(¯x±s,n=10)
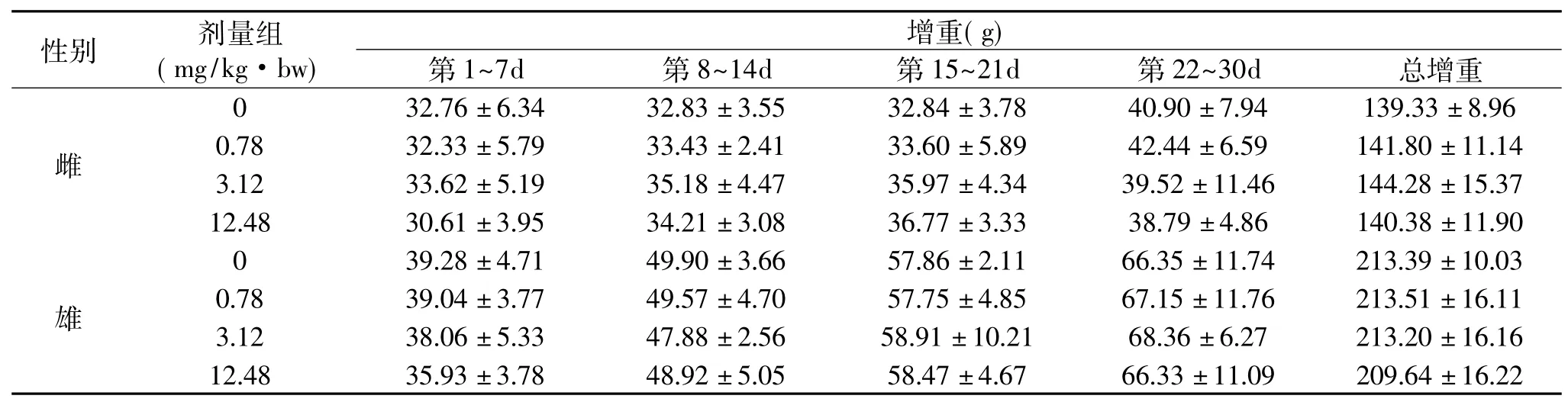
表2苏氨酸铬对各组大鼠体重增重的影响(±s,n=10)Table 2Effect of chromium threoninate on body weight gain of rats(¯x±s,n=10)
性别 剂量组(mg/kg·bw)增重(g)第1~7d 第8~14d 第15~21d 第22~30d 总增重雌32.76±6.34 32.83±3.55 32.84±3.78 40.90±7.94 139.33±8.96 0.78 32.33±5.79 33.43±2.41 33.60±5.89 42.44±6.59 141.80±11.14 3.12 33.62±5.19 35.18±4.47 35.97±4.34 39.52±11.46 144.28±15.37 12.48 30.61±3.95 34.21±3.08 36.77±3.33 38.7 0 9±4.86 140.38±11.90 0雄3±11.09 209.64±16.22 39.28±4.71 49.90±3.66 57.86±2.11 66.35±11.74 213.39±10.03 0.78 39.04±3.77 49.57±4.70 57.75±4.85 67.15±11.76 213.51±16.11 3.12 38.06±5.33 47.88±2.56 58.91±10.21 68.36±6.27 213.20±16.16 12.48 35.93±3.78 48.92±5.05 58.47±4.67 66.3
表3苏氨酸铬各组大鼠的摄食量(±s,n=10)Table 3Effect of chromium threoninate on food intake of rats(¯x±s,n=10)
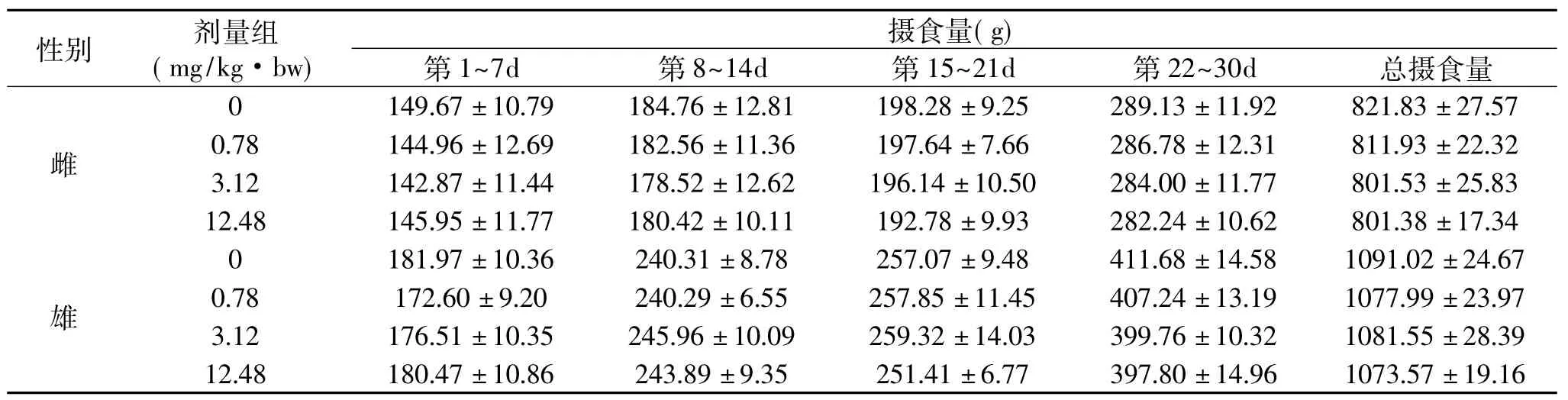
表3苏氨酸铬各组大鼠的摄食量(±s,n=10)Table 3Effect of chromium threoninate on food intake of rats(¯x±s,n=10)
性别 剂量组(mg/kg·bw)摄食量(g)第1~7d 第8~14d 第15~21d 第22~30d 总摄食量雌149.67±10.79 184.76±12.81 198.28±9.25 289.13±11.92 821.83±27.57 0.78 144.96±12.69 182.56±11.36 197.64±7.66 286.78±12.31 811.93±22.32 3.12 142.87±11.44 178.52±12.62 196.14±10.50 284.00±11.77 801.53±25.83 12.48 145.95±11.77 180.42±10.11 192.78±9.9 0 3 282.24±10.62 801.38±17.34 0雄397.80±14.96 1073.57±19.16 181.97±10.36 240.31±8.78 257.07±9.48 411.68±14.58 1091.02±24.67 0.78 172.60±9.20 240.29±6.55 257.85±11.45 407.24±13.19 1077.99±23.97 3.12 176.51±10.35 245.96±10.09 259.32±14.03 399.76±10.32 1081.55±28.39 12.48 180.47±10.86 243.89±9.35 251.41±6.77
表4苏氨酸铬对大鼠食物利用率的影响(±s,n=10)Table 4Effect of chromium threoninate on food utilization rate of rats(¯x±s,n=10)

表4苏氨酸铬对大鼠食物利用率的影响(±s,n=10)Table 4Effect of chromium threoninate on food utilization rate of rats(¯x±s,n=10)
性别 剂量组(mg/kg·bw)食物利用率(%)第1~7d 第8~14d 第15~21d 第22~30d 总利用率雌21.89±3.28 17.77±2.38 16.56±3.07 14.15±4.13 16.95±2.21 0.78 22.30±5.36 18.31±3.30 17.00±4.73 14.80±3.18 17.46±2.38 3.12 23.53±5.59 19.71±3.25 18.34±3.45 13.92±3.24 18.00±3.82 12.48 20.97±4.65 18.96±2.69 19.07±3.19 13.7 0 4±2.53 17.52±2.32 21.59±3.24 20.76±3.55 22.51±1.39 16.12±4.15 19.56±2.23 0.78 22.62±3.61 20.63±2.76 22.40±3.38 16.49±3.56 19.81±2.31 3.12 21.56±2.44 19.47±3.43 22.72±4.07 17.10±4.30 19.71±3.19 12.48 19.91±3.41 20.06±1.90 23.26±4.20 16.6 0雄7±3.28 19.53±2.30
2.5 苏氨酸铬对大鼠血液生化指标的影响
表6中结果表明,实验组雌、雄大鼠的 ALT、AST、TP等指标与空白组比较在统计学上均无显著性差异(p > 0.05),且其结果均在正常范围内[19-20]。说明苏氨酸铬对大鼠的ALT、AST、TP等指标均无明显影响。而实验组雌、雄大鼠的血糖值与空白组相比,极显著降低(p<0.01),但均在正常范围内,表明苏氨酸铬对大鼠具有降血糖作用,文献报道铬的化合物如吡啶甲酸铬、烟酸铬等具有降血糖的作用[21],苏氨酸铬作为一种新型降血糖制剂具有开发前景。
2.6 苏氨酸铬对大鼠脏器重量的影响
由表7可知,实验组雌、雄大鼠肝脏、脾脏、肾脏及性腺的绝对重量和相对重量与空白组比较,在统计学上均无显著性差异(p>0.05),表明苏氨酸铬对大鼠肝脏、脾脏、肾脏及性腺的重量均无明显影响。
2.7 组织病理学检查
大体解剖后用肉眼观察,实验组大鼠脏器均未发生明显病变,所以,仅选择高剂量组及空白组大鼠做组织病理学检查[22]。高剂量组和空白组大鼠的肝脏、脾脏、肾脏、胃、十二指肠、睾丸、卵巢的镜检结果均未见有明显的病理变化,各脏器颜色、形状都比较正常。图1为肝组织的镜检照片。
3 结论
通过30d喂养实验对苏氨酸铬的安全性进行了初步评价,得出以下结论:连续30d给予大鼠0.78、3.12、12.48mg/kg·bw苏氨酸铬,实验组和空白组实验动物情况良好,无异常症状和体征,也无中毒死亡情况发生;苏氨酸铬对大鼠的体重、增重无明显影响且对实验组大鼠的摄食量及食物利用率与空白组相比,均无显著性差异,表明苏氨酸铬对大鼠的生长发育未见明显影响;苏氨酸铬对大鼠RBC、HGB、WBC及其分类等血液学指标未见明显影响,对ALT、AST、TP等血液生化指标也未见明显影响,且各指标均在正常范围内。而苏氨酸铬极显著降低了大鼠血糖值,且血糖值也都在正常范围内,说明苏氨酸铬具有降血糖作用。大鼠的大体解剖及组织病理学检验均
未发现异常改变,其结果表明苏氨酸铬对大鼠的肝脏、脾脏、肾脏等脏器均无不良影响。
表5苏氨酸铬对大鼠血液学指标的影响(±s,n=10)Table 5Effect of chromium threoninate on haematological parameters of rats(¯x±s,n=10)
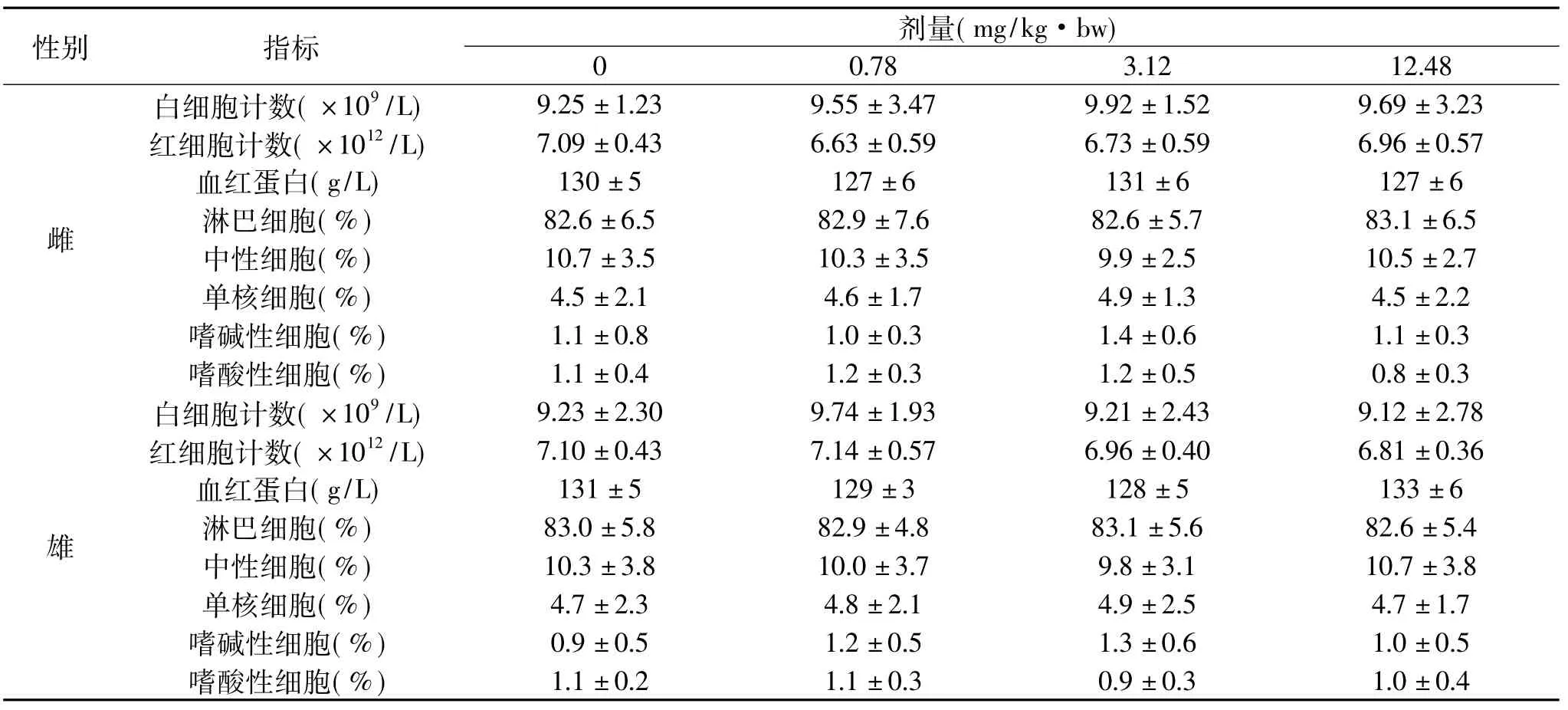
表5苏氨酸铬对大鼠血液学指标的影响(±s,n=10)Table 5Effect of chromium threoninate on haematological parameters of rats(¯x±s,n=10)
性别 指标剂量(mg/kg·bw)0 0.78 3.12 12.48雌白细胞计数(×109/L) 9.25±1.23 9.55±3.47 9.92±1.52 9.69±3.23红细胞计数(×1012/L) 7.09±0.43 6.63±0.59 6.73±0.59 6.96±0.57血红蛋白(g/L) 130±5 127±6 131±6 127±6淋巴细胞(%) 82.6±6.5 82.9±7.6 82.6±5.7 83.1±6.5中性细胞(%) 10.7±3.5 10.3±3.5 9.9±2.5 10.5±2.7单核细胞(%) 4.5±2.1 4.6±1.7 4.9±1.3 4.5±2.2嗜碱性细胞(%) 1.1±0.8 1.0±0.3 1.4±0.6 1.1±0.3嗜酸性细胞(%)1.1±0.4 1.2±0.3 1.2±0.5 0.8±0.3雄1.1±0.2 1.1±0.3 0.9±0.3 1.0±0.4白细胞计数(×109/L) 9.23±2.30 9.74±1.93 9.21±2.43 9.12±2.78红细胞计数(×1012/L) 7.10±0.43 7.14±0.57 6.96±0.40 6.81±0.36血红蛋白(g/L) 131±5 129±3 128±5 133±6淋巴细胞(%) 83.0±5.8 82.9±4.8 83.1±5.6 82.6±5.4中性细胞(%) 10.3±3.8 10.0±3.7 9.8±3.1 10.7±3.8单核细胞(%) 4.7±2.3 4.8±2.1 4.9±2.5 4.7±1.7嗜碱性细胞(%) 0.9±0.5 1.2±0.5 1.3±0.6 1.0±0.5嗜酸性细胞(%)
表6苏氨酸铬对大鼠血液生化指标的影响(¯±s,n=10)Table 6Effect of chromium threoninate on blood biochemical parameters(¯x±s,n=10)
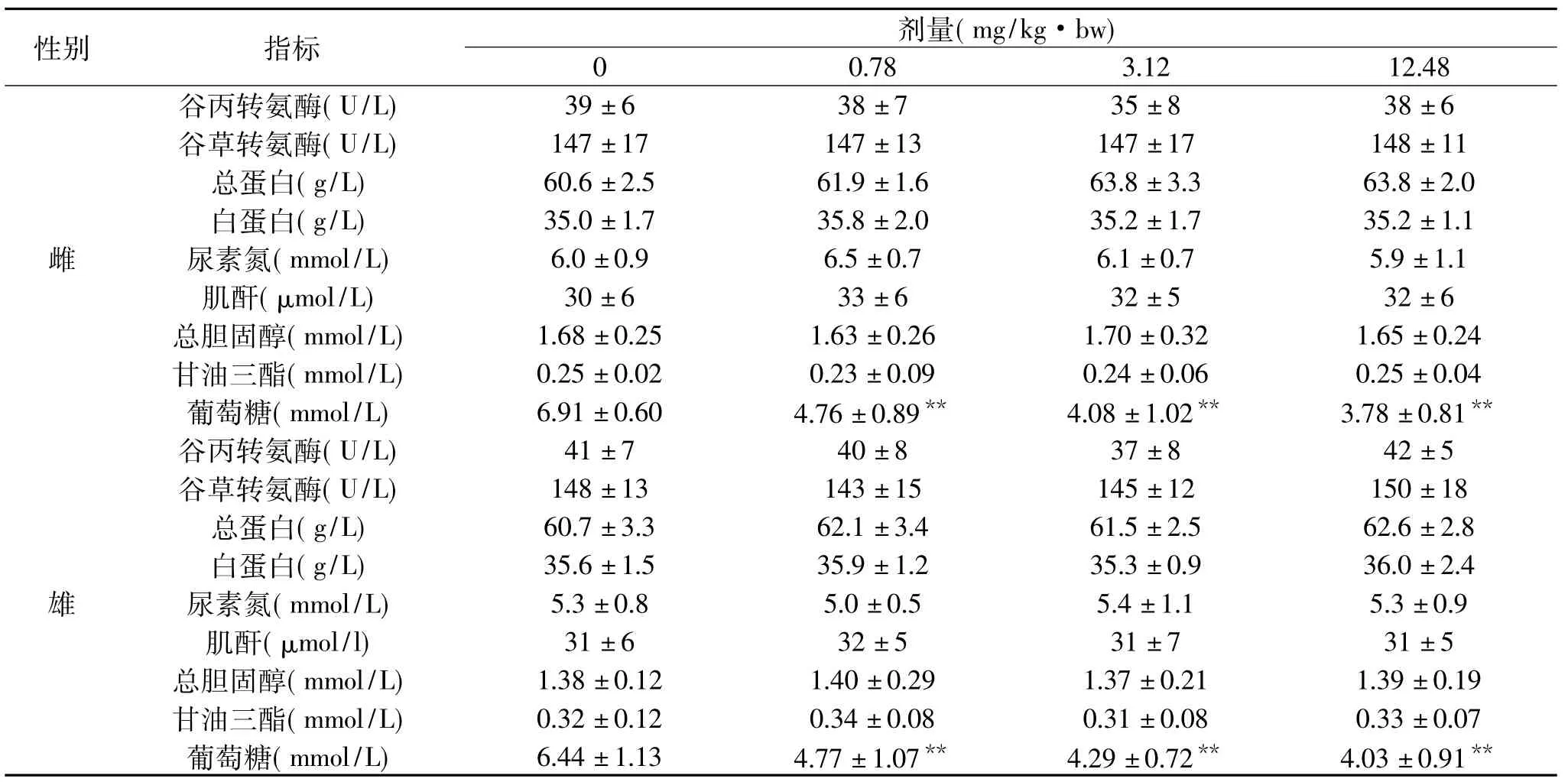
表6苏氨酸铬对大鼠血液生化指标的影响(¯±s,n=10)Table 6Effect of chromium threoninate on blood biochemical parameters(¯x±s,n=10)
注:“**”表示与空白组比较 p<0.01。
性别 指标剂量(mg/kg·bw)0 0.78 3.12 12.48雌谷丙转氨酶(U/L) 39±6 38±7 35±8 38±6谷草转氨酶(U/L) 147±17 147±13 147±17 148±11总蛋白(g/L) 60.6±2.5 61.9±1.6 63.8±3.3 63.8±2.0白蛋白(g/L) 35.0±1.7 35.8±2.0 35.2±1.7 35.2±1.1尿素氮(mmol/L) 6.0±0.9 6.5±0.7 6.1±0.7 5.9±1.1肌酐(μmol/L) 30±6 33±6 32±5 32±6总胆固醇(mmol/L) 1.68±0.25 1.63±0.26 1.70±0.32 1.65±0.24甘油三酯(mmol/L) 0.25±0.02 0.23±0.09 0.24±0.06 0.25±0.04葡萄糖(mmol/L) 6.91±0.60 4.76±0.89** 4.08±1.02** 3.78±0.81雄**谷丙转氨酶(U/L) 41±7 40±8 37±8 42±5谷草转氨酶(U/L) 148±13 143±15 145±12 150±18总蛋白(g/L) 60.7±3.3 62.1±3.4 61.5±2.5 62.6±2.8白蛋白(g/L) 35.6±1.5 35.9±1.2 35.3±0.9 36.0±2.4尿素氮(mmol/L) 5.3±0.8 5.0±0.5 5.4±1.1 5.3±0.9肌酐(μmol/l) 31±6 32±5 31±7 31±5总胆固醇(mmol/L) 1.38±0.12 1.40±0.29 1.37±0.21 1.39±0.19甘油三酯(mmol/L) 0.32±0.12 0.34±0.08 0.31±0.08 0.33±0.07葡萄糖(mmol/L) 6.44±1.13 4.77±1.07** 4.29±0.72** 4.03±0.91**
表7苏氨酸铬对大鼠脏器重量的影响(±s,n=10)Table 7Effect of chromium threoninate on weight of organs of rats(¯x±s,n=10)
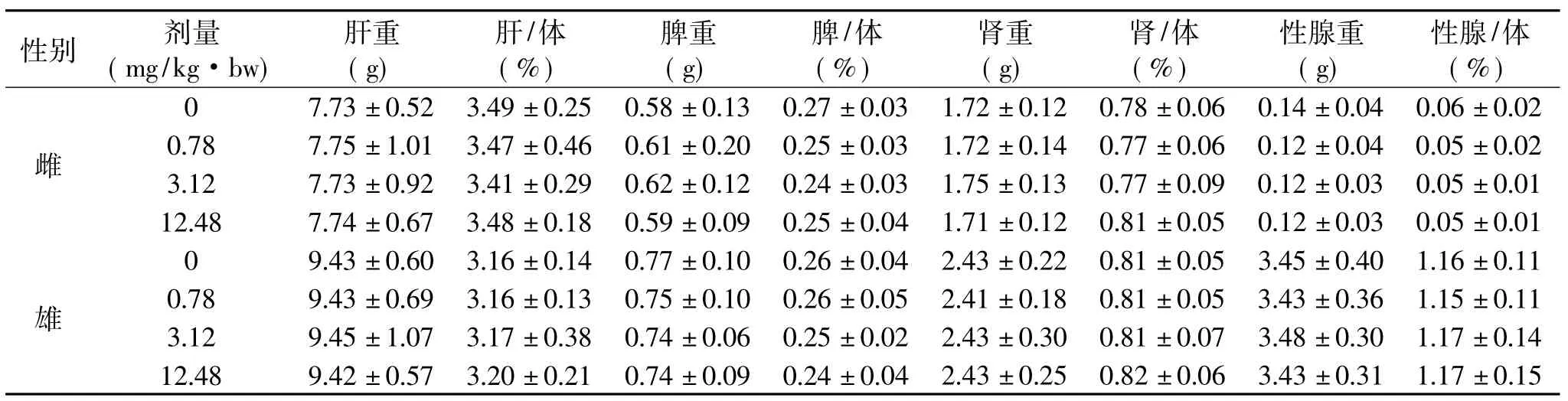
表7苏氨酸铬对大鼠脏器重量的影响(±s,n=10)Table 7Effect of chromium threoninate on weight of organs of rats(¯x±s,n=10)
性别 剂量(mg/kg·bw)肝重(g)肝/体(%)脾重(g)脾/体(%)肾重(g)肾/体(%)性腺重(g)性腺/体(%)雌0 7.73±0.52 3.49±0.25 0.58±0.13 0.27±0.03 1.72±0.12 0.78±0.06 0.14±0.04 0.06±0.02 0.78 7.75±1.01 3.47±0.46 0.61±0.20 0.25±0.03 1.72±0.14 0.77±0.06 0.12±0.04 0.05±0.02 3.12 7.73±0.92 3.41±0.29 0.62±0.12 0.24±0.03 1.75±0.13 0.77±0.09 0.12±0.03 0.05±0.01 12.48 7.74±0.67 3.48±0.18 0.59±0.09 0.25±0.雄04 1.71±0.12 0.81±0.05 0.12±0.03 0.05±0.01 04 2.43±0.25 0.82±0.06 3.43±0.31 1.17±0.15 0 9.43±0.60 3.16±0.14 0.77±0.10 0.26±0.04 2.43±0.22 0.81±0.05 3.45±0.40 1.16±0.11 0.78 9.43±0.69 3.16±0.13 0.75±0.10 0.26±0.05 2.41±0.18 0.81±0.05 3.43±0.36 1.15±0.11 3.12 9.45±1.07 3.17±0.38 0.74±0.06 0.25±0.02 2.43±0.30 0.81±0.07 3.48±0.30 1.17±0.14 12.48 9.42±0.57 3.20±0.21 0.74±0.09 0.24±0.
图1 肝脏病理组织学图像Fig.1 Histopathological images of liver
综上所述,苏氨酸铬对大鼠的无作用剂量在12.48mg/kg·bw以上,而ESADDI推荐成人铬每日摄入量为50~200μg/d(成人体重以50kg来计),换算成苏氨酸铬为7.8~31.2μg/kg·d,即苏氨酸铬对大鼠的无作用剂量是成人每日铬推荐摄入量的100倍以上。从毒理学角度来讲,其在此浓度条件下对人体和动物是相对安全的[23]。
[1]周保学,周定.铬(Ⅲ)的补给量及对体制和减肥的影响[J].微量元素与健康研究,1997,14(2):53-55.
[2]丁文军,柴之芳.铬的代谢和葡萄糖耐量因子的研究[J].微量元素与健康研究,2006,27(3):100-101.
[3]Mertz W.Chromium in human nutrition:a review[J].Journal of Nutrition,1993,123(4):626-633.
[4]张敏红.动物铬的营养研究进展[J].动物营养学报,1996,8(1):56-62.
[5]张晋挥,李德发.动物铬营养研究进展[J].饲料与畜牧,1999(3):15-18.
[6]Anderson R A,Kozlovsky A S.Chromium intake,absorption and excretion of subjects consuming self- selected diets[J].American Journal of Clinical Nutrition,1985,41(6):1177-1183.
[7]Seerley R W.Organic chromium and manganese in human nutrition[C].In:Lyons T P(ed).Proceeding of Allteach’s Ninth Annual Symposium,1993:41-51.
[8]Stout M D,Nyska A,Collins BJ,et al.Chronic toxicity and carcinogenicity studies ofchromium picolinate monohydrate administered in feed to F344/N rats and B6C3F1 mice for 2 years[J].Food Chem Toxicol,2009(47):729-733.
[9]张华.蛋氨酸螯合铬食品添加剂的研究[D].哈尔滨:东北农业大学,2003.
[10]Halina Staniek,Zbigniew Krejpcio,Katarzyna Iwanik,et al.Evaluation of the acute oral toxicity class of Trinuclear Chromium(III)Glycinate complex in rat[J].Biological Trace Element Research,2011,143(3):1564-1575.
[11]谢明勇,胡晓波,聂少平,等.一种苏氨酸铬化合物及其制备方法[P].中国:200910186539,2010.06.02.
[12]罗文华,蒋雨,赵子华.苏氨酸在畜禽营养中的研究进展[J].饲料广角,2003(9):38-41.
[13]中华人民共和国卫生部.GB 14924.3-2010中华人民共和国卫生部与中国国家标准管理委员会,实验动物配合饲料营养成分[S].北京:中国标准出版社,2010.
[14]中华人民共和国卫生部.GB 15193.13-2003中华人民共和国卫生部与中国国家标准管理委员会,30天和90天喂养实验[S].北京:中国标准出版社,2003.
[15]National Research Council.Recommended dietary allowances[M].Washington:National Academy Press,1989:241-243.
[16]Xiao-bo Hu,Yi Gong,Lei Li,et al.Safety evaluation of zinc threoninate chelate[J].International Journal of Toxicology,2010,29(4):372-379.
[17]林健,郑丽红,张荣标,等.大鼠血常规正常参考值范围及评价方法的探讨[J].海峡预防医学杂志,2007,13(4):57-58.
[18]赵毓梅,郑定仙.SD大鼠血常规、血液生化指标、脏体比正常参考值范围研究[J].中国卫生检验杂志,2002,12(2):165-167.
[19]王冬平,隋丽华,尚士臣,等.清洁级SD大鼠血液生理生化指标的测定[J].中国比较医学杂志,2009,19(9):44-46.
[20]宋立江,蒋东升,郭金铭,等.SD大鼠血液某些生化指标正常参考值的探讨[J].卫生毒理学杂志,2003,17(3):193-193.
[21]林健,郑丽红,陈润,等.SD大鼠血液生化指标正常参考值范围的探讨[J].医学动物防制,2005,21(5):321-322.
[22]考庆君,吴坤,邓晶,等.三价铬和六价铬对大鼠长期慢性毒性的比较[J].癌变 .畸变 .突变,2007,19(6):474-478.
[23]王岳飞.茶儿茶素制剂毒理学安全性评价与保健功效研究[D].杭州:浙江大学,2005.
Primary evaluation for the safety of chromium threoninate chelate
QIAO Li-na,HU Xiao-bo,NIE Shao-ping,GONG Yi,TAO Jun,FENG Jian-ping,XIE Ming-yong*(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
To evaluate the safety of chromium threoninate chelate preliminary,we did the 30-day feeding study in SD rats.The results showed that during the trial period,each dose group and the blank group were generally in good condition,no abnormal symptoms and signs and no toxic death were observed.Body weight,food intake and food efficiency of male and female rats of each dose group showed no significant difference with the blank group.Haematological parameters,blood biochemical parameters and weights of organs of male and female rats of each dose group showed no significant difference with a blank group after killed.It concluded that chromium threoninate chelate has no significant teratogenic effect on the growth,development,metabolism and organs of SD rats.
chromium threoninate chelate;30-day feeding study;safety
TS202.3
A
1002-0306(2012)17-0368-05
2012-02-01 *通讯联系人
乔李娜(1988-),女,硕士研究生,研究方向:营养与功能食品。
教育部长江学者和创新团队发展计划项目(长江学者奖励计划)(IR0540)。

