三种谷物的不同乙醇浓度提取物抗氧化活性研究
申迎宾,张 晖,齐希光,丁香丽,程素娇,赵兰涛,王 立
(江南大学食品学院科学与技术国家重点实验室,江南大学食品学院,江苏无锡 214122)
三种谷物的不同乙醇浓度提取物抗氧化活性研究
申迎宾,张 晖*,齐希光,丁香丽,程素娇,赵兰涛,王 立
(江南大学食品学院科学与技术国家重点实验室,江南大学食品学院,江苏无锡 214122)
以高粱、紫米、大黄米为原料,以水、60%、95%乙醇为提取介质,对提取物的总酚含量、DPPH·清除能力和总抗氧化能力进行了测定。同时,分析了三种谷物60%提取物对小鼠红细胞溶血性的影响。结果表明:高粱水提物的总酚含量为2.34mg/g(GAE/DW),分别是紫米和大黄米的4倍和12.23倍;DPPH·清除率达到43.58%,而紫米和大黄米的水提物基本无清除DPPH自由基的能力。高粱、紫米、大黄米的60%乙醇提取物的DPPH·清除能力分别为89.88%、90.16%、64.70%,高粱的总抗氧化能力为0.16mmol/g(TEAC/DW),分别是紫米和大黄米的3.99倍和24.89倍。大黄米的95%乙醇提取物总酚含量较高,达到1.38mg/g(GAE/DW),具有较强的总抗氧化能力,但DPPH·清除能力较低。高粱、紫米、大黄米在2mg/mL时对H2O2诱导的红细胞氧化溶血的抑制率分别为50.77%、16.73%、22.79%。可见,高粱具有一定的保护红细胞膜的作用。
谷物,抗氧化,DPPH·,FRAP,溶血性
大量的流行病学研究表明,长期食用全谷物食品[1]可以降低患心血管疾病、Ⅱ型糖尿病[2]、某些癌症(结肠癌)等慢性疾病[3]的风险。这可能是因为谷物中富含膳食纤维[4],植物化学素、矿物质及微量元素等功能性成分。这些功能性成分相互作用或者协调作用有助于改善机体的氧化还原平衡状态。谷物抗氧化已经成为食品领域的研究热点,谷物潜在的抗氧化能力受到越来越多的学者和专家的关注[5-8]。刘清[9]对大麦多酚进行了研究,其在体内外均表现了一定的抗氧化活性,张名位[10]对黑米进行了研究,分析了其花色苷抗氧化活性。但目前对谷物的研究主要集中在谷物外皮方面,对整粒籽粒的谷物抗氧化能力研究较少,关于谷物对小鼠红细胞溶血性方面的实验报道也较少。本文以高粱、紫米、大黄米为原料,比较了三种谷物在不同乙醇浓度提取时总酚含量、DPPH自由基清除能力和总抗氧化能力,分析了三种谷物对H2O2诱导的小鼠红细胞氧化溶血的抑制作用。为进一步研究谷物的抗氧化提供理论依据。
1 材料与方法
1.1 材料与仪器
红高粱(sorghum) 江苏省凌家塘农副产品批发市场,产地:东北;紫米(violet) 黑龙江延寿县和平粮油有限公司;大黄米(millet) 内蒙古鹏佳米业,用粉碎机整粒磨碎,过60目,备用;昆明种小白鼠 雄性,体重(35±2)g,由上海斯莱克动物公司提供;福林酚(Folin-CiocaLteu,FC)试剂,2mol/L 上海荔达生物科技有限公司;1,1-二苯基-2-苦基苯肼(1,1-Diphenyl-2-picry-hydrazyl,DPPH)、2,4,6-tri (2-pyridyl)-s-triazine(TPTZ) Sigma公司; 6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid(Trolox) Fluka Chemie AG (Buchs,Switzerland);其它试剂均为国产分析纯。
500g摇摆式高速中药粉碎机DFY-500 浙江温岭市林大机械有限公司;SHZ-B水浴恒温振荡器 上海市实验仪器厂;GZX-QF101-3S电热鼓风干燥箱 上海跃进医疗器械厂;722N型可见分光光度计 上海精密科学仪器有限公司;FA100精密电子天平 上海上平仪器公司;HH-S6数显恒温水浴锅 上海一恒科技有限公司;L550离心机 湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 谷物提取物的制备 体外抗氧化实验样品制备:分别取三种谷物1g,分别加入10mL的60%乙醇,60℃提取3h,离心,取上清,重复2次,合并提取液定容至25mL,40mg/mL(谷物质量/体积),待测。
溶血性实验样品制备:取一定量的粉状谷物,加入25倍体积的60%乙醇混合均匀,调节pH至3左右,于60℃下浸提3h,3000r/min离心,取上清,重复2次,将提取液于50℃减压浓缩,经真空冷冻干燥成粉,实验前用双蒸水配制成所需浓度。
1.2.2 DPPH自由基清除率的测定[15]准确称取7.88mg DPPH,用无水乙醇溶解,定容于100mL容量瓶中,摇匀,配制浓度为2×10-4mol·L-1的溶液,保存于冰箱中,备用。向4mL 2×10-4mol·L-1DPPH·溶液中加入0.5mL样品(空白用60%乙醇代替),摇匀于室温下放置30min,用无水乙醇作参比液,于517nm下测定其吸光值Ai;同时测定4mL 2×10-4mol·L-1DPPH·溶液与0.5mL无水乙醇混合液的吸光值Ac;再测0.5mL样品液与4mL无水乙醇混合液的吸光值Aj,根据以下公式计算样品对DPPH·的抑制率(%)=[1-(Ai-Aj)]/Ac×100。
1.2.3 总抗氧化能力测定 FRAP(ferric reducing/ antioxidant power assay)原理[11],为Fe3+-三吡啶三吖嗪(tripyridyl-triazine,TPTZ)可被样品中还原物质还原为二价铁形式,呈现出蓝色,并于593nm处具有最大光吸收。
FRAP试剂:0.1mol/L醋酸缓冲液(pH3.6)∶10mmol/L TPTZ(溶于40mmol/L盐酸)∶20mmol/L三氯化铁=10∶1∶1(V∶V∶V)。
取4mL FRAP试剂与0.1mL样品,反应10min后在593nm下测吸光值。以不同浓度梯度的Trolox溶液为标样作标准曲线,抗氧化能力用TEAC(trolox equivalent antioxidant capacity)表示,空白0.1mL 60%乙醇,得到吸光值(Y)与Trolox含量(x)之间的回归方程。
1.2.4 总酚的测定 总酚含量的测定采用Folin酚法[12],检测波长为765nm,取0.5mL样品,加入0.5mL Folin酚试剂和2mL 15%的碳酸钠溶液,充分混合,定容10mL摇匀,室温下反应60min,以不加碳酸钠溶液的反应液为空白,在特征吸收波长处测吸光度值,记录数据,根据没食子酸标准曲线,计算样品总酚的相对含量。以mg/g(GAE/DW)计算。
1.2.5 抑制双氧水诱导小鼠红细胞溶血实验 选取雄性昆明种小鼠,摘取小鼠眼球后眼眶静脉采血,制成抗凝[13-14]血液,3000r/min离心10min分离红细胞,吸弃上清液,用生理盐水洗3次,最后一次加约红细胞5倍体积的生理盐水,3000r/min离心10min,吸弃上清,制成体积分数为2%的红细胞悬液。取该悬液600μL,加入待测液600μL(对照组为加入生理盐水600μL),最后加400μL的200mmol/L的H202启动氧化反应,37℃作用1h后加6.4mL的生理盐水,3000r/min离心10min,取上清液测定415nm处的吸光值。

1.3 数据处理与分析
采用微软办公软件office2003,SPSS17.0软件处理数据,所有实验均做三个重复,结果以干基表示。
2 结果与讨论
2.1 总酚含量
三种谷物总酚含量如图1所示,结果表明,各谷物水提物总酚含量大小顺序:高粱>紫米>大黄米,高粱最高,为2.34mg/g(GAE/DW),分别是紫米和大黄米的4倍和12.23倍。各谷物60%乙醇提取物总酚含量大小顺序为:高粱>紫米>大黄米。各谷物95%乙醇提取物总酚含量大小顺序为:高粱>大黄米>紫米。紫米60%乙醇提取物的总酚含量较水提物有所提高,达到1.18mg/g(GAE/DW)。大黄米在95%乙醇浓度下,总酚含量最高,达到1.38mg/g(GAE/DW)。

图1 不同乙醇浓度对谷物总酚含量的影响Fig.1 Effect of different ethanol extraction on TPC of grains
2.2 DPPH·清除能力
三种谷物清除DPPH自由基能力如图2,结果表明,各谷物的水提取物DPPH清除能力较低,高粱水提物的DPPH清除率达到43.58%,而紫米和大黄米基本无清除DPPH自由基的能力。用60%乙醇提取时,高粱、紫米、大黄米均显示了最高的DPPH自由基清除能力,清除率分别达到为:89.88%、90.16%、64.70%。用95%乙醇提取时,高粱的DPPH清除能力仍然最强,而紫米和大黄米清除率较低。同时,相关性分析结果表明,总酚与DPPH清除率呈现正相关(r=0.595,p=0.09>0.05),但未到到显著水平。

图2 不同乙醇浓度对三种谷物清除DPPH·能力的影响Fig.2 Effect of different ethanol extraction on DPPH of grains
2.3 总抗氧化能力
三种谷物总抗氧化能力如图3所示,结果表明,三者的水提物均有总抗氧化能力。用60%乙醇提取时,高粱显示了最高的总抗氧化能力为0.16mmol/g (TEAC/DW),分别是紫米和大黄米的 3.99倍和24.89倍。用95%乙醇提取时,高粱等抗氧化能力仍为最强。大黄米的水提物总抗氧化能力为0.07mmol/g (TEAC/DW),表现了较强的抗氧化能力。同时,相关性分析结果表明,总酚含量与总抗氧化能力呈极显著正相关(r=0.832,p=0.005<0.01)。

图3 不同乙醇浓度对三种谷物总抗氧化能力的影响Fig.3 Effect of different ethanol extraction on total antioxidant capacity of grains
2.4 不同谷物对红细胞溶血性的影响
红细胞具有典型的生物体细胞膜[16]结构,作为一种容易得到的生物材料被广泛应用于膜脂质过氧化的研究中。在生物体内,红细胞处于充足的氧环境中,含有启动和催化脂质过氧化反应的金属络合物血红蛋白,且红细胞膜上富含多价不饱和脂肪酸,这些特点均使该类细胞对氧化损伤极为敏感,红细胞在生物体内不仅会发生部分发生自氧化解体,体外的温浴过程及自由基诱导剂同样会使其发生氧化溶血,产生大量的自由基。因而考察抗氧化剂对红细胞结构和功能的影响被公认为是研究细胞氧化损伤的重要方法之一。
2.4.1 高粱对红细胞溶血性的影响 高粱对溶血性的影响见表1,结果表明,较高浓度的高粱提取物对H2O2诱导的红细胞氧化溶血具有显著的抑制作用(p<0.05),随着提取物浓度的增强,抑制能力越强。高粱在2mg/mL时,抑制率为50.77%。可见高粱对H2O2诱导的红细胞氧化溶血有一定的抑制作用,在一定程度上保护红细胞膜。但是溶血率明显高于对照组,说明H2O2使红细胞膜受氧化而损伤,细胞内容物外流。

表1 高粱60%乙醇提取物对H2O2诱导的红细胞氧化溶血的抑制作用Table 1 Inhibition of 60%ethanol extraction of sorghum rice on red blood cell hemolysis induced by H2O2
2.4.2 紫米对红细胞溶血性的影响 紫米对溶血性的影响见表2,结果表明,高浓度紫米提取物对H2O2诱导的红细胞氧化溶血抑制作用效果不强。但是随着紫米提取物浓度增加,其抑制率变大。紫米在最高浓度2mg/mL时,抑制率为16.73%,较高粱低。不能很好地保护红细胞膜,导致了细胞内容物外流。
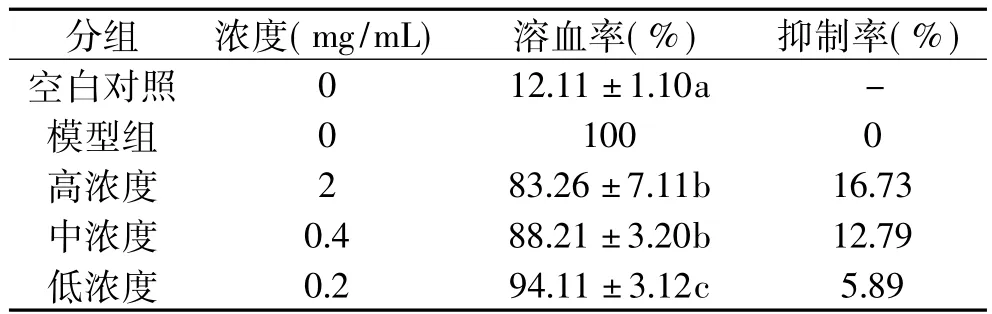
表2 紫米60%乙醇提取物对H2O2诱导的红细胞氧化溶血的抑制作用Table 2 Inhibition of 60%ethanol extraction of purple rice on red blood cell hemolysis induced by H2O2
2.4.3 大黄米对红细胞溶血性的影响 大黄米对溶血性的影响见表3,结果表明,高浓度大黄米提取物对H2O2诱导的红细胞氧化溶血抑制作用效果不强。但是随着大黄米提取物浓度增加,其抑制率变大,这与高粱、紫米的变化趋势类似。大黄米在最高浓度2mg/mL时,抑制率为22.79%。不能很好地保护红细胞膜,导致细胞内溶物外流。

表3 大黄米60%乙醇提取物对H2O2诱导的红细胞氧化溶血的抑制作用Table 3 Inhibition of 60%ethanol extraction of rhubarb rice on red blood cell hemolysis induced by H2O2
3 结论
3.1 各谷物水提物总酚含量大小顺序:高粱>紫米>大黄米,高粱最高,为2.34mg/g(GAE/DW)分别是紫米和大黄米的4倍和12.23倍。各谷物的水提取物DPPH·清除能力较低,高粱水提物的DPPH·清除率达到43.58%,而紫米和大黄米基本无清除DPPH自由基的能力。
3.2 紫米60%乙醇提取物的总酚含量较水提物有所提高达到1.18mg/g(GAE/DW)。大黄米的95%乙醇浓度下,总酚含量最高,达到 1.38mg/g(GAE/ DW)。
3.3 用60%乙醇提取时,高粱、紫米、大黄米均显示了最高的DPPH自由基清除能力,清除率分别达到89.88%、90.16%、64.70%。此时,高粱显示了最高的总抗氧化能力为0.16mmol/g(TEAC/DW),分别是紫米和大黄米的3.99倍和24.89倍。
3.4 三种谷物提取物都是随着浓度增加而其对红细胞氧化溶血的抑制率变大,但是在相同浓度下,高粱均高于紫米和大黄米。高粱、紫米、大黄米在2mg/mL时,抑制率分别为50.77%、16.73%、22.79%。高粱有一定的保护细胞膜作用,抑制细胞内容物的溶出,而紫米和大黄米起不到保护细胞膜的作用。
[1]BorneoR,AE Leon.Wholegrain cereals:functional components and health benefits[J].Food&Function,2012,3 (2):110-119.
[2]Browning LM,Jebb SA.Nutritional influences on inflammation and type 2 diabetes risk[J].Diabetes Technology&Therapeutics,2006,8(1):45-54.
[3]Wild SH,Roglic G,Green A,et al.Global prevalence of diabetes:Estimates for the year 2000 and projections for 2030-Response to Rathman and Giani[J].Diabetes Care,2004,27 (10):1047-1053.
[4]German J B.Effect of dietary fats and barley fiber on total cholesterol and lipprotein cholesterol distribution in plasma of Hamsters[J].Nutrition Research,1996,16(7):1239-1249.
[5]Anderson JW.Whole grains protect against atherosclerotic cardiovascular disease[J].Proceedings of the Nutrition Society,2003,62(1):135-142.
[6]Slavin J.Whole grains and human health[J].Nutrition Research Reviews,2009,17(1):99-110.
[7]Maras JE,Newby PK,Bakun PJ,et al.Whole grain intake:The baltimore longitudinal study of aging[J].Journal of Food Composition and Analysis,2009,22(1):53-58.
[8]Arndt EA.Whole-grain barley for today's health and wellness needs[J].Cereal Foods World,2006,51(1):20-22.
[9]Liu Q,Yao H.Antioxidant activities of barley seeds extracts[J].Food Chemistry,2007,102(3):732-737.
[10]张名位,黑米抗氧化与降血脂的活性成分及其作用机理[D].广州:华南师范大学,2003.
[11]Dudonne S,Vitrac X,Coutiere P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].Journal of Agricultural and Food Chemistry,2009,57(5):1768-1774.
[12]Ainsworth EA,KM Gillespie.Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J].Nat Protoc,2007,2(4):875-877.
[13]李志孝,黄成钢,蔡育军,等.天门冬多糖的化学结构及体外抗氧化活性[J].药学学报,2000,35(5):358-362.
[14]罗景慧,杨迎暴,林永成,等.海洋真菌 Halorosellina oceanicum 323代谢产物的体外抗氧化活性研究[J].中药材,2004,27(3):188-192.
[15]Prior RL,XL Wu,K Schaich.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].Journal of Agricultural and Food Chemistry,2005,53(10):4290-4302.
[16]阳冠明,叶司原,利基林.山莨菪碱对红细胞自氧化的影响[J].中国药理学通报,1999,15(5):460-464.
Antioxidant capacity of different ethanol extraction from three grains
SHEN Ying-bin,ZHANG Hui*,QI Xi-guang,DING Xiang-li,CHENG Su-jiao,ZHAO Lan-tao,WANG Li
(China State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The antioxidant capacity of different ethanol extraction from three grains(sorghum,purple rice,rhubarb rice)were evaluated.During the experiment,total phenols,DPPH·scavenging ability and total antioxidant capacity were measured with the water,60%,95%ethanol extractions of the three grains.Meanwhile,the mice blood cells hemolytic effect of 60%ethanol extracts of three grains was evaluated in vitro.The results showed that the total phenol content of sorghum water extraction was 2.34mg/g(GAE/DW),which was 4 times the content of purple rice and 12.23 times that of rhubarb rice,respectively.DPPH·scavenging ability of sorghum water extraction was 43.58%,however,DPPH·scavenging ability for the water extraction of purple rice and rhubarb rice was very low.In 60%ethanol concentration,the DPPH· scavenging ability of three grains were 89.88%,90.16%and 64.70%,respectively.The total antioxidant capacity,0.16mmol/g(TEAC/DW),was 3.99 times and 24.89 times that of purple rice and rhubarb rice.The total phenol content of 95%ethanol extraction of rhubarb rice was 1.38mg/g(GAE/ DW),total antioxidant capacity was strong,but the DPPH· scavenging ability was low.The inhibition rates of hemolytic effect of three grains were 50.77%,16.73%and 22.79%respectively at 2mg/mL.The results showed that sorghum could protect blood cells membrane modestly.
grain;antioxidant;DPPH·;FRAP;hemolytic
TS202.1
A
1002-0306(2012)21-0146-04
2012-03-28 *通讯联系人
申迎宾(1981-),男,博士研究生,主要从事粮食深加工及资源利用研究。

