北虫草菌丝发酵液和子实体抗氧化活性测定
郑剑玲,齐 贺,黄竹青,吴素琴,张中林,王美惠
(辽宁卫生职业技术学院免疫微生物教研室,辽宁 沈阳 110101)
超氧化物歧化酶(SOD)是广泛存在于生物体内重要的超氧阴离子自由基清除剂,保护细胞免受损伤。丙二醛(MDA)是氧自由基攻击生物膜中的多不饱和脂肪酸后形成的脂质过氧化物,含量的高低间接反应了机体受自由基攻击的严重程度。二者对机体的氧化与抗氧化平衡起着重要的作用。目前可利用SOD资源主要为动物血液、组织、高等植物以及微生物发酵产物[1]。北虫草是食药两用真菌,具有抗氧化、增强免疫能力等作用,有关虫草类真菌SOD的报道多集中于菌丝体及子实体中SOD的检测[2-4],但未见液体发酵液培养基中SOD活性和含量的研究。笔者采集野生北虫草菌种进行培育,选择不同发酵时间的北虫草发酵液培养基检测SOD及MDA,并比较由不同发酵时间的发酵液培育出的子实体SOD酶活性有无差异,观察不同培养阶段的北虫草发酵液抗氧化活性,以期为开发利用发酵液-培养基中SOD资源打下基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源 采集于棋盘山地区蚕蛹寄生北虫草。
1.1.2 实验仪器和主要试剂 紫外可见分光光度计UV755B,上海精密科学仪器有限公司;蒸汽灭菌器LDZX-50KB,上海申安医疗器械厂;离心机80-2B,上海菲恰尔分析仪器有限公司;水浴振荡器HZS-H,哈尔滨市东联电子技术开发有限公司;匀浆器JT-C,漯河市金田试验设备研究所;恒温水浴箱HHW21 Cr600,北京长源实验设备厂;SOD测试盒,南京建成生物工程研究所;无水乙醇、冰醋酸,分析纯,沈阳第一试剂厂;氯仿,分析纯,天津化学试剂厂。
1.2 方法
1.2.1 野生菌种分离培养 采集新鲜北虫草子座表面消毒,无菌水冲洗后无菌操作剪下0.1~0.2 cm小段子实体接种于斜面PDA培养基中,22℃恒温箱培养。待组织块周围长满新菌丝后转管培养。液体振荡培养,肉汤、沙保罗培养基,160 r/min,20℃培养期间观察菌丝生长情况。
1.2.2 培育子实体 配制营养液,成分含量:KH2PO43 g,MgSO41.5 g,蛋白胨3g,葡萄糖20 g,VB11片,蒸馏水1000 mL。配制小麦固体培养基,按发酵液体菌种与营养液1∶5比例接种至固体培养基中,500 mL瓶装培养,经接种、发菌、转色、出草培养55 d后采收新鲜子实体。
1.2.3 酶液的制备 分别取适量发酵5、7、15 d的北虫草发酵液,对照组为本室保存3.5个月的发酵液,3000 r/min分别离心10 min,取上清4 mL,加入适量无水乙醇。振混1 min,再加入适量氯仿,振混1 min,3000 r/min离心10 min,上层则为酶粗液。新鲜子实体剪碎匀浆后同法制备酶粗液。
1.2.4 发酵液-培养基总SOD活力计算 用黄嘌呤氧化酶法测发酵液SOD活力,发酵液-培养基取400 μL 时,反应体系体积为 1.7 mL,酶的百分抑制率为51%,与酶的活力呈成正比曲线关系,即选取400 μL作为最佳取样量。按SOD测试盒说明书操作,用721分光光度计进行比色,波长选择550 nm,测吸光度。以每毫升反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U)。发酵液-培养基总SOD活力计算公式:总SOD活力(U/mL)=((对照管吸光度-测定管吸光度)/对照管吸光度)÷50% ×反应体系稀释倍数×样本测试前的稀释倍数。
1.2.5 发酵液-培养基丙二醛(MDA)测定 硫代巴比妥酸(TBA)法测定发酵液-培养基中MDA含量。发酵液-培养基取400 μL,配制测定管、标准管、及各自空白管溶液,各反应体系体积均为4.4 mL,旋涡混合器混匀,95℃水浴40 min,流水冷却,4000 r/min离心10 min,取上清,532 nm处,1 cm光径,蒸馏水调零,测各管OD值。计算公式:MDA含量(nmol/mL)=((测定管OD值-测定空白管OD值)/(标准管OD值-标准空白管OD值))×标准管浓度×样本测试前稀释倍数。
1.2.6 子实体蛋白浓度的测定 采用考马斯亮兰蛋白测定法,子实体称重,4倍生理盐水稀释,制备成20%的组织匀浆,3000 r/min离心15 min,测定管样品0.05 mL、标准管为同体积的0.563 g/L标准液,蒸馏水为空白管,各管加入考马斯亮兰显色剂3 mL,混匀,静置10 min,595 nm波长处,1 cm光径,蒸馏水调零,测各管OD值。蛋白浓度(g/L)=((测定管OD值-空白管 OD值)/(标准管 OD值 -空白管 OD值))×标准管浓度(0.563 g/L)。
1.2.7 子实体中总SOD活力计算 测定管取样品50 μL按说明书加入各试剂后与显色剂反应,用721分光光度计进行比色,波长选择550 nm,测吸光度。以每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U)。计算公式:总SOD活力(U/mg)=((对照管吸光度-测定管吸光度)/对照管吸光度)÷50% ×(反应液总体积/取样量)÷待测样本蛋白浓度。
1.2.8 统计 采用软件SPSS13.0进行数据统计分析。3组比较采用单因素方差分析,组内两两比较采用LSD,以P﹤0.05为差异有统计学意义。
2 结果与分析
2.1 不同时期发酵液-培养基总SOD活力
表1结果显示,不同发酵时期发酵液-培养基SOD活力有所不同,各时间段之间进行比较,差异皆有统计学意义(P<0.05);15 d时的发酵液-培养基SOD活力最多,3.5个月时的最少。
表1 不同时期发酵液-培养基总SOD活力比较()Table 1 Fermentation liquid-medium SOD vitality comparison in different period()
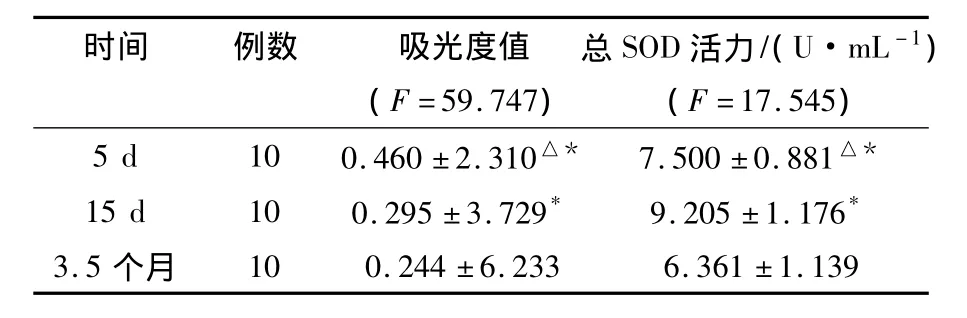
表1 不同时期发酵液-培养基总SOD活力比较()Table 1 Fermentation liquid-medium SOD vitality comparison in different period()
注:5 d与15 d比较,△为差异有统计学意义(P<0.05);与3.5个月的值相比较,*为差异有统计学意义(P<0.05),下表同
时间 例数 吸光度值 总SOD活力/(U·mL-1)(F=59.747) (F=17.545)5 d 10 0.460 ±2.310△* 7.500 ±0.881△*15 d 10 0.295 ±3.729* 9.205 ±1.176*3.5 个月10 0.244 ±6.233 6.361 ±1.139
2.2 不同时期发酵液-培养基丙二醛(MDA)测定
表2 不同时期发酵液-培养基MDA测定)Table 2 Fermentation liquid-medium MDA determination in different period()
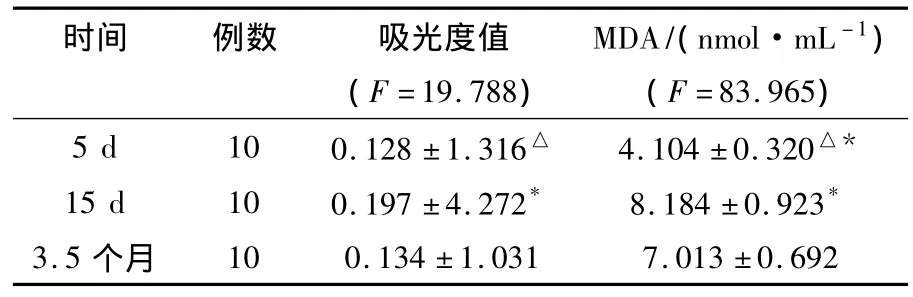
表2 不同时期发酵液-培养基MDA测定)Table 2 Fermentation liquid-medium MDA determination in different period()
时间 例数 吸光度值 MDA/(nmol·mL-1)(F=19.788) (F=83.965)5 d 10 0.128 ±1.316△ 4.104 ±0.320△*15 d 10 0.197 ±4.272* 8.184 ±0.923*3.5 个月10 0.134 ±1.031 7.013 ±0.692
15 d时的发酵液-培养基MDA含量最多,与5 d和保存3.5个月的发酵液-培养基MDA含量相比差异有统计学意义(P<0.05),发酵5 d和保存3.5个月的MDA含量差异无统计学意义(P>0.05)。
2.3 子实体中总SOD活力计算
表3 子实体中总SOD活力结果)Table 3 Result of Fruitbodies SOD vitality)

表3 子实体中总SOD活力结果)Table 3 Result of Fruitbodies SOD vitality)
时间 例数 吸光度值 酶活力 蛋白含量 总SOD 活力(F=0.211) /(U·mL-1) /(mg·mL-1) /(U·mg-1)(F=1.070)5 d 10 0.159 ±3.833 1.620 ±2.302 0.654 ±3.342 53.523 ±9.32815 d 10 0.161 ±2.525 1.527 ±2.246 0.639 ±2.427 63.782 ±24.9493.5 个月 10 0.152 ±2.621 1.539 ±2.185 0.563 ±2.794 53.392 ±15.621
结果显示,子实体发酵各时间点(5 d、15 d、3.5个月)的吸光度值、酶活力、蛋白含量、总SOD活力差异无统计学意义(P>0.05)。
3 讨论
机体内自由基产生过多或消除能力降低会导致各种疾病如炎症、癌症、衰老等,适量补充外源性抗氧化药物或给予能促使机体内源性抗氧化物质恢复到一定水平的药物越来越受到人们的关注。北虫草是食药两用真菌,含有的SOD酶可抑制人体内过氧化脂质的生成和清除衰老产物(氧化自由基)[5]。以往的实验研究多集中在对菌丝体和子实体的SOD酶活性观察。
本实验观察到不同发酵时期的菌丝体发酵液具有SOD活性,且不同发酵时期其含量有所不同,在液体发酵的第5天和第15天,随时间延长SOD、MDA含量皆逐渐增加。导致这一现象的原因可能是随着受氧自由基损伤程度的增加才促使北虫草分泌更多的SOD酶。发酵液-培养基中SOD活性可能是菌丝体分泌至胞外,在一定时间范围内,时间越长分泌至胞外的越多,当菌丝体SOD酶分泌殆尽时(3.5个月),发酵液-培养基中SOD不再无限量增长,活性反而有所降低。确定人工培育北虫草发酵液-培养基SOD活性最强发酵时间还需取多个时间点进行检测和观察。
北虫草子实体中SOD未受液体发酵时间影响,说明在培育过程中固体培养基的养分对子实体来说更重要,SOD活性由菌丝体随着对固体小麦培养基的吸收而转化至子实体中。至于同一菌种的菌丝体和子实体中SOD活性的高低比较需要对液体发酵和固体培养的条件做进一步的考察。
本实验表明北虫草菌丝体的发酵液中含有SOD活性,由于液体发酵培养菌丝简便,周期短的特点,易于大规模工业生产,通过液体培养菌丝体的同时也可以在发酵液中高效地得到SOD,为有效利用虫草资源提供实验依据。
[1]陆玲,潘欣,袁生,等.金针菇液体培养菌丝与子实体SOD特性比较研究[J].中国食用菌,1999,18(5):25-27.
[2]管代义,陈春华,孙璐玮,等.北虫草抗氧化作用的实验研究[J].中国药学杂志,1993,28(8):473-475.
[3]王琦,薛阳.野生蛹虫草与培植蛹虫草SOD酶活力的对比研究[J].安徽农业科学,2008,36(20):8649,8722.
[4]李华为,赵素云,铁梅.富硒蛹虫草抗氧化作用研究[J].食品科学,2010,31(23):61-64.
[5]徐锦堂.中国药用真菌学[M].北京:中国协和医科大学及北京医科大学联合出版社,1997:394-400.

