碱性果胶酶基因在毕赤酵母中的非诱导表达
张爱平,蔡少丽,杨 鹤,郑海英,柯崇榕,黄建忠
(福建师范大学工业微生物教育部工程研究中心生命科学学院福建省现代发酵技术工程研究中心,福建 福州 350108)
果胶酶(pectinases)是一类含多种酶的复合酶,可用于植物纤维中果胶质(由D-半乳糖醛酸以α-1,4-糖苷键连接形成的直链状的聚合物)的分解。已广泛应用于传统工业加工过程中,如果胶提取、酒类澄清、咖啡和茶的发酵、油的提取、污染果胶的污水处理等[1-2]。果胶酶可按照作用底物(果胶酸、果胶酯和原果胶等)、作用方式(裂解和水解)、作用位点(内切和外切)、作用适宜pH(酸性、中性和碱性)进行分类。碱性果胶酯裂解酶(EC 4.2.2.2.)是指可在碱性条件下水解聚乳糖醛酸α-1,4-糖苷键并释放出可溶性不饱和寡聚乳糖醛酸的一类碱性果胶酶,一般多指聚半乳糖醛酸裂解酶(polygalacturonate lyase,PGL)[3]。碱性果胶酶除广泛应用于食品(茶叶和咖啡发酵、榨油、诱导植物抗病的绿色食品生产)、环境保护(废水处理)、植物病毒纯化、饲料添加剂、洗涤剂以及纸浆漂白等方面,已成为绵织物处理过程中至关重要的生物制剂[4-5]。与传统的处理棉织纤维的工艺相比,在工艺上和处理效果上都有许多优势。碱性果胶酶主要来源于细菌,早期主要进行野生菌种筛选及酶学特性方面的研究[6],直至20世纪80年代后才渐渐有将其基因克隆进行异源表达的研究,但都主要集中在大肠埃希菌中表达,产量低,并且需要昂贵的IPTG作为诱导剂,并不太可能用于工业化生产[7-8]。于是近年来越来越多将其异源表达的研究转向了技术成熟并利于工业化生产的毕赤酵母。本研究通过蛋白质工程手段构建了以GAP为启动子的碱性果胶酶基因工程菌GS115-pGAPZαA-PGL,实现其在毕赤酵母GS115中无需甲醇诱导的表达,在理论上进一步完善了碱性果胶酯裂解酶在毕赤酵母中异源表达的研究,在实际应用中可为其进一步工业化生产和扩大应用范围奠定基础,具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 毕赤酵母EIM-60、大肠埃希菌(E.coli)DH5α、巴斯德毕赤酵母菌株(P.pastoris)GS115、pGAPZαA质粒由本实验室保存。pMD18T载体购自TaKaRa公司。
1.1.2 酶和试剂 Extaq酶、rTaq酶、限制性内切酶NotⅠ、KpnⅠ、AvrⅡ、T4DNA 连接酶均购自TaKaRa公司,胶回收试剂盒、Agar A、Zeocin均购自上海生工;PGA(polygalacturonic acid)购自Sigma公司;其余试剂均为进口或国产分析纯,引物由上海生工合成。
1.1.3 培养基(%) LB培养基:蛋白胨1,氯化钠1,酵母浸出物0.5;低盐LB培养基:蛋白胨1,氯化钠0.5,酵母浸出物0.5;YPD培养基:酵母提取物1,胰蛋白胨2,葡萄糖2。
1.2 方法
1.2.1 PGL基因的获得 根据实验室已有的碱性果胶酶的序列设计引物:P1:5'-TTGCT GAT TTA GGC CAT CAA ACG-3';P2:5'-CGGTTA ATT TAA TTT ACC AGC ACC CG-3',在P1前添加NotⅠ酶切位点,在P2前添加酶切位点KpnⅠ。用玻璃珠法从实验室菌株毕赤酵母EIM-60中获得酵母基因组 DNA[9],后经聚合酶链式反应(PCR)技术获得目的基因PGL。
1.2.2 毕赤酵母重组表达载体的构建与转化PCR产物经胶回收试剂盒回收后进行NotⅠ、KpnⅠ双酶切,与经过相同双酶切的pGAPZαA过夜连接,转化大肠埃希菌(E.coli)DH5α,得到重组质粒pGAPZαA-PGL,经AvrⅡ酶切线性化后,电转化至毕赤酵母GS115中,涂布在含有100 μg/mL的Zeocin+筛选标记的YPD平板上,28℃培养2~5 d至转化子出现。
1.2.3 重组毕赤酵母工程菌株的筛选和鉴定重组毕赤酵母菌株的鉴定:采用煮-冻-煮法提取酵母基因组 DNA,以此为模板[10],P1、P2 为引物,进行PCR扩增鉴定。
1.2.4 重组毕赤酵母工程菌株的表达 挑取验证成功的阳性克隆子于5 mL的YPD液体培养基中,28℃,230 r/min进行一级培养至OD值2~6时取1 mL培养液,重悬于30 mL的YPD中,28℃,230 r/min 振荡培养 6 d[11],12000 r/min,5 min,收集上清,即为粗酶液。
1.2.5 重组毕赤酵母表达产物的分析 ①SDSPAGE:取粗酶液80 μL,采用5%浓缩胶及12%分离胶的不连续垂直平板电泳,考马斯亮蓝G-250染色,进行SDS-PAGE分析重组蛋白的表达情况;②酶活的测定:取粗酶稀释液20 μL与2 mL的聚半乳糖醛酸混匀,45℃保温15 min,加入3 mL磷酸溶液混匀终止其反应。反应完毕后,选用1 cm石英比色皿在紫外分光光度计上读取235 nm时的吸光值。1个标准酶活单位(U)定义为每分钟使聚半乳糖醛酸裂解产生1 μmol的不饱和聚半乳糖醛酸所需的酶量。酶活计算:
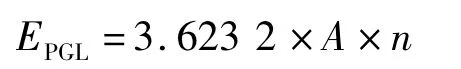
其中:EPGL为碱性果胶酸酯裂解酶酶活:μ/mL;A为235 nm处吸光度值;n为稀释倍数。
2 结果与分析
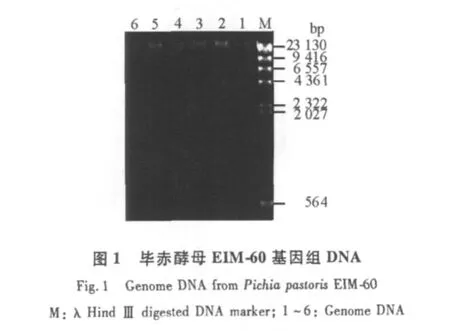
2.1 毕赤酵母基因组的提取
根据玻璃珠法从实验室菌株毕赤酵母EIM-60中获得酵母基因组DNA。
2.2 PGL基因的克隆
经PCR扩增得到的PGL目的片段经测序后为1206 bp,编码402个氨基酸,相对分子质量约43 ku,等电点为8.4。将PGL序列在NCBI上进行 Blast分析,与枯草芽胞杆菌 B.sutbtilis X74800.1的同源性为100%。

2.3 pGAPZαA-PGL表达载体的构建
纯化回收的PGL基因经NotⅠ、KpnⅠ双酶切后,与经过相同双酶切的pGAPZαA过夜连接,转化至大肠埃希菌(E.coli)DH5α,经筛选验证后得到重组质粒pGAPZαA-PGL,双酶切和测序结果表明,插入片段在pGAPZαA中有正确的阅读框。
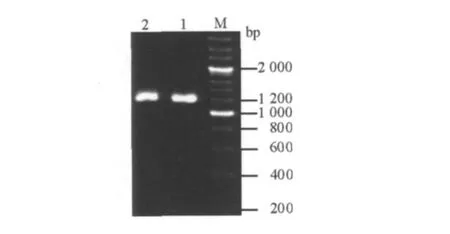
图3 pGAPZαA-PGL的PCR鉴定Fig.3 PCR identification of pGAPZαA-PGL M:200 bp DNA marker;1、2:PGL gene
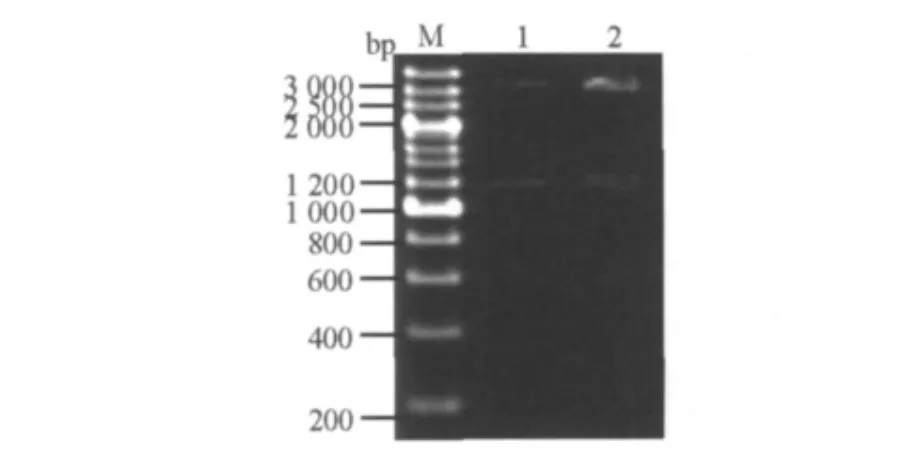
图4 pGAPZαA-PGL双酶切验证Fig.4 Digestion identification of pGAPZαA-PGL M:200 bp DNA marker;1、2:pGAPZαA and PGL gene
2.4 GS115-pGAPZαA-PGL 的筛选和鉴定
pGAPZαA-PGL经AvrⅡ酶切线性化后,电转化至酵母GS115中,挑取Zeocin+抗性板上的单菌落于3 mL YPD液体培养基中,30℃,230 r/min振荡培养过夜,分别进行菌液PCR鉴定及提取重组菌株的基因组DNA进行PCR鉴定,结果表明,目的基因PGL已成功整合到毕赤酵母GS115中。
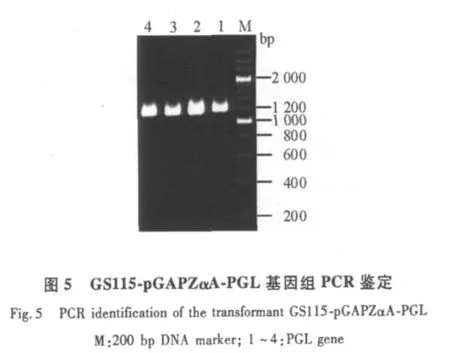
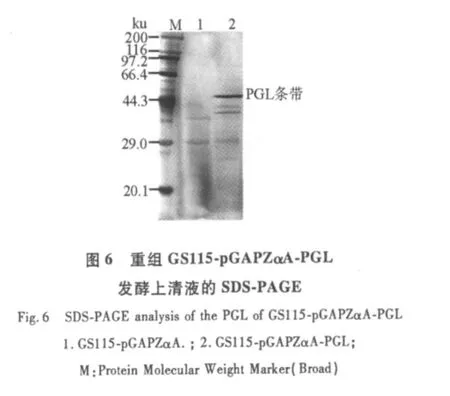
2.5 GS115-pGAPZαA-PGL表达产物的分析
银染结果表明,重组PGL实现了在毕赤酵母中的分泌表达,gel pro Analyser软件分析其表达蛋白的表观分子量约为44.3 ku(图7),通过考马斯亮蓝法蛋白浓度试剂盒测定其蛋白含量为0.430 g/L,通过BandScan软件分析,目的蛋白占总蛋白的41.4%,即0.178 g/L;酶活测定为1750 U/L。
3 讨论
毕赤酵母(Pichia pastoris)是近年来发展迅速的真核表达系统,具有许多真核表达系统的优点[12]。已有众多文献报道果胶酶在毕赤酵母中的甲醇诱导表达,但是该表达均以AOX1为启动子,表达需要以甲醇为诱导物[13-15]。虽然甲醇可严格调控和诱导AOX1基因的表达,但甲醇为有毒、易燃物质,操作麻烦,不利于工业上尤其是食品及其相关领域的生产,因此为进一步完善碱性果胶酯裂解酶基因(PGL)在毕赤酵母中的表达,扩大其应用范围,本研究采用甘油醛-3-磷酸脱氢酶基因为启动子进行PGL的表达。GAP启动子具有很强的组成型表达能力,以葡萄糖、甘油等无毒物质作为碳源,表达时无需更换碳源,发酵工艺更为简单,更适合大规模的工业化培养[16]。
本研究将碱性果胶酯裂解酶PGL基因克隆到pGAPZαA中,通过蛋白质工程手段成功实现该重组质粒在毕赤酵母中的非甲醇诱导表达。表达蛋白分子量为44.3 ku,发酵活力为1750 U/L,并不是很高,原因可能在于发酵条件未优化;毕赤酵母对其所表达的蛋白进行过度修饰;密码子偏好性,从而限制其蛋白质的翻译速度;或者整合的拷贝数过多,导致转录水平产生后生调节,影响重组蛋白的产率等[17-18]。
本研究成功地使碱性果胶酯裂解酶在毕赤酵母中获得了非甲醇诱导的表达,有一定的活性。酶活和表达量仍有很大的提升空间,今后可通过对其发酵条件优化寻找合适的表达条件,并对重组酶产酶动力学和酶学性质做详细研究;再通过上罐扩大培养,进一步改造目的基因,密码子优化,定点突变,增加整合拷贝数等手段使其产量得到进一步提升,以更好地应用于工业上的生产。
[1]Hoondal G S,Tiwari R P,Tewari R,et al.Microbial alkaline pectinases and their industrial applications:a review[J].Appl Microbiol Biotechnol,2002,59:409-418.
[2]Alkorta Itziar,Garbisu Carlos,J Maria.,et al.Industrial applications of pectic enzymes:a review[J].Process Biochemistry,1998,33:21-28.
[3]诸葛斌,堵国成,沈微,等.利用温控载体构建碱性果胶酯裂解酶工程菌[J].微生物学报,2006,46(4):657-659.
[4]Zhang J,Henriksson G,Johansson G.Polygalacturonase is the key component in enzymatic retting of flax[J].Journal of Biotechnology,2000,81(1):85-89.
[5]王芸.重组毕赤酵母高密度发酵生产碱性果胶酶的策略研究[D].江南大学,2008.
[6]王传槐,叶汉玲,王清.优良碱性果胶酶产生菌筛选[J].南京林业大学学报,1994,18(4):51-56.
[7]Zhai Chao,Cao Junwei,Wang Youliang.Cloning and expression of a pectate lyase gene from Bacillus alcalophillus NTT33[J].Enzyme and Microbial Technology,2003,33(2):173-178.
[8]肖静,路福平,杨晓杰,等.Bacillus subtilis碱性果胶酶基因在大肠埃希菌中的克隆和表达[J].高师理科学刊,2011,31(4):57-59.
[9]J萨姆布鲁克,DW拉塞尔,黄培堂,等.分子克隆实验指南(第3版)[M].北京:科学出版社,2002.
[10]剧海,梁东春,郭刚,等.用于PCR实验的毕赤酵母基因组DNA制备方法的比较[J].天津医药,2003,31(5):270-272.
[11]刘德辉,何俊,林云熊,等.抗菌肽 LL-37在毕赤酵母SMD168中的高效表达及活性鉴定[J].中国预防兽医学报,2010,32(2):98-101.
[12]王芸,华兆哲,刘立明,等.碱性果胶酶在重组毕赤酵母中高效表达的关键因素研究[J].微生物学通报,2008,35(3):341-345.
[13]Zhuge Bin,Du Guo Cheng,Shen Wei,et al.Expression of a Bacillus subtilis pectate lyase gene in Pichia pastoris[J].Biochemical Engineering Journal,2008,40(1):92-98.
[14]强慧妮,杨欣伟,田宝玉,等.黑曲霉果胶裂解酶基因在毕赤酵母Pichia pastoris GS115中的表达[J].生物工程学报,2009,25(12):1962-1968.
[15]高秋芳,郭安平,孔华,等.果胶裂解酶、木聚糖酶及果胶裂解酶、木聚糖酶基因在毕赤酵母中的表达[J].广东农业科学,2010,(8):1-5.
[16]邹有土.扩展青霉脂肪酶的异源表达及分子突变[D].福建师范大学,2008.
[17]魏联果.N-糖基化对在毕赤酵母中表达的瑞氏木霉外切纤维素酶酶活力的影响[D].山东大学,2006.
[18]林国滟,蔡少丽,黄平,等.中性纤维素酶外切葡聚糖酶CBHⅡ的异源表达[J].微生物学杂志,2011,31(6):88-91.

