落新妇甙对大鼠心脏移植细胞凋亡的作用
王潇 陈涛 潘铁成
器官移植术后,如何有效地抑制排斥反应一直是个难题,众多研究显示,T淋巴细胞在器官移植急性排斥反应中起核心作用,介导移植物损伤的效应细胞主要是细胞毒T细胞(CTL),其作用机制包括Fas/FasL系统和颗粒酶/穿孔素系统[1]。此外肿瘤坏死因子受体1(TNF-R1)和2(TNF-R2)基因也是重要的凋亡相关基因[2]。目前已有多种药物通过对T细胞的影响而发挥免疫抑制作用,最新文献报道中药落新妇甙(Astilbin)能使由植物血凝素激活的T淋巴细胞发生凋亡[3],并且能使肝炎动物肝脏周围浸润的活化T细胞发生凋亡,从而保护肝脏免受损害[4-5]。落新妇甙是从我国传统中药土茯苓中提取的单体成分,具有多种药理作用。那么,落新妇甙对移植排斥反应中活化T淋巴细胞是否也有促凋亡作用,能否抑制移植排斥反应是值得探讨的课题。以往研究均为体外实验,而器官移植后给予落新妇甙,移植器官会有何变化尚未见报道。本研究旨在通过建立大鼠心脏移植急性排斥反应模型,并于术后给予落新妇甙,观察移植心脏存活时间及心肌细胞凋亡情况的变化,探讨落新妇甙对大鼠心脏移植排斥反应及心肌细胞凋亡的影响。
1 材料和方法
1.1 大鼠心脏移植及取材
采用华中科技大学同济医学院实验动物中心的健康、清洁级、近交系、封闭群雄性Wistar大鼠和远交群(Sprague Dawley,SD)大鼠各 36只,体质量200~250 g。以 Wistar大鼠为受体,SD大鼠为供体,按照Chen[6]的方法进行颈部异位心脏移植。
1.1.1 供心切取 SD大鼠1%戊巴比妥钠腹腔注射(0.3 ml/100 g体质量)麻醉后固定。正中切开胸腹部皮肤,暴露胸骨,沿腹白线正中纵行开腹,推开肠管暴露下腔静脉,缓慢推注肝素生理盐水2 ml,3 min后剪开膈肌并沿双侧腋前线剪开至锁骨下缘,将胸壁翻起。剪开心包暴露心脏,以冰屑覆盖心脏,分离下腔静脉及右上腔静脉,以5-0丝线紧贴心房结扎并剪断,将右心耳结扎[7]。去除胸腺,游离升主动脉及无名动脉,在无名动脉与左颈总动脉之间结扎主动脉弓,再结扎远端将主动脉弓切断,将残端留长些以免丝线脱落,留无名动脉大约2~3 mm用来吻合。将显微镊插入心包横窦并扩张,可显露主肺动脉直至左右肺动脉分叉处,紧靠肺动脉分叉起始部剪断主肺动脉。注意将主动脉与肺动脉之间充分游离。提起心脏,以丝线将左上腔静脉及全部肺静脉一次性集束结扎、切断,取出心脏放入4℃肝素生理盐水中保存。
1.1.2 受体准备 Wistar大鼠麻醉固定后,自下颌骨下方至锁骨中线上缘,作一斜形切口,在10倍显微镜下,显露右颈外静脉至其第1属支处,结扎切断胸锁乳突肌,游离右颈总动脉至颈内、外动脉分叉处。
1.1.3 心脏移植 在受体Wistar大鼠的右颈总动脉远心端分叉处结扎颈总动脉。小血管夹夹闭近心端。在结扎线与血管夹间,切断颈总动脉。在颈外静脉近锁骨上缘处小血管夹夹闭,于第1个属支处结扎,近心端切断颈外静脉。生理盐水冲洗动、静脉腔后,将SD大鼠的供心置于切口内,在16倍显微镜下行供心无名动脉与受体右颈总动脉端端连续吻合、供心主肺动脉与受体颈外静脉端端连续吻合。在进行吻合时用蘸冷生理盐水溶液的小棉纱布覆于供心表面,以防复温。将干小棉球覆于吻合周围。先放开颈外静脉小血管夹,再放开颈总动脉小血管夹。移植心脏复跳后,待吻合口不出血时,取出小棉球。仔细放好移植心脏位置,关闭皮肤切口。
1.1.4 术后处理 术后肌注青霉素500 U/10 g体质量,用灯泡照射保温,大鼠在手术后1~2 h即可清醒,醒后双眼充血,能爬行、饮水。术后每日触摸颈部观察移植心脏的搏动情况。一般移植心脏搏动有力,200~300次/min,移植心脏搏动24 h以上标志移植成功。
术后将Wistar大鼠按手术先后顺序标为1~36号,完全随机法分为两组,每组18只。灌胃给药1次/d,对照组给予生理盐水1 ml,落新妇甙组给予落新妇甙 1 mg·kg-1·d-1。分别于术后第 3、5 和 7 天处死Wistar大鼠,摘取移植心脏左心室壁组织,中性甲醛固定,常规石蜡包埋、切片,厚4 μm。
1.2 急性排斥反应的诊断
各标本切片作常规苏木精-伊红 (HE)染色,显微镜观察,根据Stanford标准进行病理学诊断和分级[8]。(1)0级:无排斥,对应组织学分级量化值为0;(2)Ⅰ级ⅠA:有个别淋巴细胞浸润,对应组织学分级量化值为1.0;Ⅰ级ⅠB:有少量散在的淋巴细胞浸润,对应组织学分级量化值为1.5;(3)Ⅱ级:有单灶性侵袭性淋巴细胞浸润或伴有灶性心肌细胞损害,对应组织学分级量化值为2.0;(4)Ⅲ级ⅢA:有多灶性侵袭性淋巴细胞浸润或伴有心肌细胞损害,对应组织学分级量化值为3.0;Ⅲ级ⅢB:有弥漫性炎症并伴有心肌坏死,对应组织学分级量化值为3.5;(5)Ⅳ级:有弥漫性多种类型细胞的浸润并伴有出血、水肿和坏死,对应组织学分级量化值为4.0。
1.3 细胞凋亡的检测
采用细胞凋亡检测试剂盒(In Situ Cell Apoptosis Detection kitⅠ,POD),购自武汉博士德公司,其中主要试剂来源为末端脱氧核糖核酸转移酶(TdT),美国Promega公司;地高辛标记的三磷酸脱氧尿苷(DIG-dUTP),德国 Bochringe Mannheim公司,蛋白酶K、生物素标记的抗地高辛抗体(Anti-DIG-Biotin),美国Sigma公司。
方法:各标本切片常规脱蜡入水,体积分数为3%的新鲜H2O2处理,蒸馏水洗涤;加Tris缓冲盐溶液(TBS)1∶100稀释蛋白酶 K,37℃ 10 min,蒸馏水洗;加含TdT和 DIG-dUTP的标记缓冲液20 μl,37℃ 2 h,TBS 洗涤;加封闭液50 μl,室温30 min,甩干;加封闭液 1∶100 稀释的 Anti-DIG-Biotin 50 μl,37℃ 30 min,TBS洗涤;加 TBS 1∶100稀释的链霉亲合素-生物素-过氧化物酶复合物(SABC),37℃ 30 min,TBS洗涤;DAB显色20 min,蒸馏水洗;苏木素复染,TBS洗涤;脱水透明,封片[9]。显微镜观察,细胞核中有棕黄色颗粒者为凋亡细胞,每例切片计算出随机10个200倍视野中平均凋亡细胞数作为该例的凋亡指数(AI)。
1.4 统计学方法
2 结果
2.1 移植心脏急性排斥的病理变化
术后观察期内所有移植心脏存活良好,无停搏发生。切片HE染色显微镜观察:对照组术后第3天心肌组织结构基本正常,间质内有少数单个核细胞浸润;术后第5天出现灶性心肌坏死,间质水肿,并有散在淋巴细胞、中性白细胞浸润;第7天表现为弥漫性多类型细胞浸润,间质水肿伴心肌纤维素样坏死。与落新妇甙组比较,同一时间内后者发生的炎症细胞浸润明显减少,心肌组织的水肿及坏死显著减轻。急性排斥的病理分级比较见表1,两组组织学分级比较差异均有统计学意义(均为P<0.05)。
表1 术后不同时间大鼠移植心脏急性排斥的组织学分级()
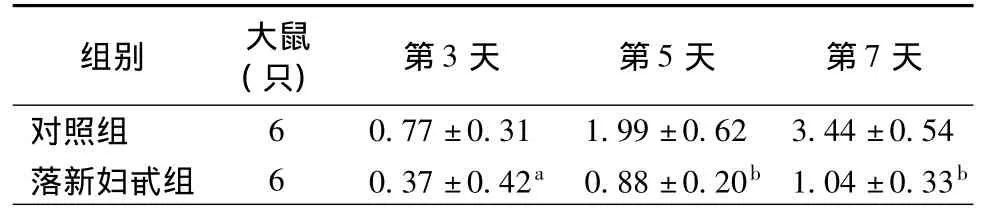
表1 术后不同时间大鼠移植心脏急性排斥的组织学分级()
注:与对照组比较,aP <0.05,bP <0.01
组别 大鼠(只) 第3天 第5天 第7天对照组6 0.77±0.31 1.99±0.62 3.44±0.54落新妇甙组 6 0.37±0.42a 0.88±0.20b 1.04±0.33b
2.2 急性排斥与细胞凋亡的关系
原位末端标记(TUNEL)切片观察可见移植心脏的细胞凋亡现象存在于排斥反应的整个过程,凋亡的细胞主要是心肌细胞,少数为浸润的淋巴细胞(图1)。
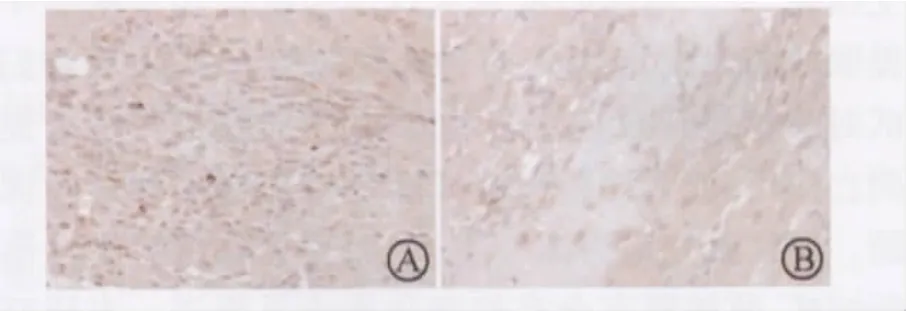
图1 两组术后第7天TUNEL切片观察(苏木素染色,×200)
随着急性排斥的加剧,凋亡细胞的出现率增加,而术后落新妇甙的应用明显减少了心肌细胞的凋亡发生。两组移植心脏的AI见表2,两组比较差异有统计学意义(P<0.05)。
表2 术后不同时间大鼠移植心脏的AI水平()

表2 术后不同时间大鼠移植心脏的AI水平()
注:与对照组比较,aP <0.05,bP <0.01
组别 大鼠(只) 第3天 第5天 第7天6 4.03±1.32 8.52±1.97 9.73±6.21落新妇甙组 6 0.87±1.11a 2.53±2.49b 4.71±2.99对照组b
3 讨论
本研究显示,细胞凋亡存在于急性排斥的整个过程,并且随着排斥程度的加剧而增加,表明细胞凋亡亦参与了心脏移植排斥反应,是心脏移植急性排斥中细胞死亡的重要机制。
而落新妇甙能明显减少移植心脏组织中炎症细胞的浸润,减轻急性排斥和移植物损伤,尤其在排斥反应较为严重的第5天和第7天效果最为突出。有研究显示,落新妇甙能明显减少移植心细胞凋亡的发生,落新妇甙对移植物的保护可能是通过抑制移植物细胞的凋亡来实现的[10]。细胞凋亡是一种受基因调控的程序性细胞死亡过程,为遗传决定的复杂分子过程[11],包括3个基本时相:启动相是接受了体内外指令性凋亡信息分子或信号的触发诱导,效应相则是很多促凋亡和抗凋亡基因以相互促进和相互制约的形式,组成一个完整的细胞凋亡系统并保持动态平衡,一旦失去平衡则进入清除降解相[12]。其中,Fas、Fas、TNF-R1 和 TNF-R2 基因是重要的凋亡相关基因[13]。
在急性移植排斥反应中,介导移植物损伤的效应细胞主要是CTL,其作用机制包括Fas/FasL系统和颗粒酶/穿孔素系统。CTL经移植抗原激活后表达FasL,与靶细胞表面的Fas结合可激活凋亡效应分子 caspases(一群含半胱氨酸蛋白酶)[14];同时CTL释放穿孔素和颗粒酶,穿孔素在靶细胞上形成跨膜的管状结构,颗粒酶由此进入靶细胞,通过蛋白水解亦可激活 caspases,从而启动靶细胞凋亡[15]。其中CD+CTL采用Fas和穿孔素等方式,CD4+CTL主要采用Fas/FasL系统杀伤靶细胞[16]。
目前落新妇甙免疫抑制作用的确切机制尚未完全清楚,落新妇甙是从传统中药土茯苓中提取的单体成分,有研究表明其可能通过增强促凋亡基因FasL、TNF-R1表达,抑制抗凋亡基因 TNF-R2表达[17],同时增强同种反应性T细胞Bax和Caspase-3的表达,降低Bcl-2表达诱导活化的T淋巴细胞凋亡而发挥抗排斥反应作用[18],落新妇甙的作用机制是多方面的,抑制移植物细胞的凋亡可能是它发挥免疫抑制作用的重要机制。
[1]Issa F,Schiopu A,Wood KJ.Role of T cells in graft rejection and transplantation tolerance.Expert Rev Clin Immunol,2010,6:155-169.
[2]Bharat A,Mohanakumar T.Allopeptides and the alloimmune response.Cell Immunol,2007,248:31-43.
[3]Gao SH,Chen T,Pan TC.Effect of Astilbin on expression of Bax,Bcl-2 and Caspase-3 in allograft reactive T cells.Chinese Journal of the Practical Chinese with Modern Medicine,2003,3:2110-2111.(in Chinese)高思海,陈涛,潘铁成.落新妇甙对同种反应性T细胞Bax、Bcl-2和Caspase-3表达的影响.中华实用中西医杂志,2003,3:2110-2111.
[4]Mu N,Jiang Y,Zhang SG,et al.Protective effect of astilbin on liver ischemia-reperfusion injury. Journal of Clinical Rehabilitative Tissue Engineering Research,2011,15:865-869.(in Chinese)慕宁,江艺,张绍庚,等.落新妇甙对肝缺血再灌注损伤的保护作用.中国组织工程研究与临床康复,2011,15:865-869.
[5]Lin HQ,Huang J,Shu Y.Effects of astilbin on peripheral blood T cell activation in rats with lung transplantation.Journal of Clinical Rehabilitative Tissue Engineering Research,2010,14:8225-8229.(in Chinese)林慧庆,黄杰,舒愠.落新妇甙对肺移植大鼠外周血T细胞活化的影响.中国组织工程研究与临床康复,2010,14:8225-8229.
[6]Chen ZH. A technique of cervical heterotopic heart transplantation in mice.Transplantation,1991,52:1009-1011.
[7]Yokoyama H,Ohmi M,Murata S,et al.Proposal of a working left heart model with a heterotopic transplantation technique in rats.J Heart Lung Transplant,2008,14:706-712.
[8]Delgado JF,Sanchez V,de la Calzada CS.Acute rejection after heart transplantation. Expert Opin Pharmacother,2006,7:1139-1149.
[9]Ginestà MM,Ribas Y,Mollevi DG,et al.Acute xenograft rejection,late xenograft rejection and long term survival xenograft in the hamster-to-rat heart transplantation model:histological characterisation under low-dose of FK506.APMIS,2002,110:737-745.
[10]Lin HQ,Wang JJ,Tang J,et al.Effect of Astilbin on Lung Allograft Rejection in Rats'Transplantation Model.Chinese Journal of Clinical Thoracic and Cardiovascular Surgery,2008,15:365-368.(in Chinese)林慧庆,王建军,唐建,等.落新妇甙对肺移植术后急性排斥反应的作用.中国胸心血管外科临床杂志,2008,15:365-368.
[11]Wu ZL,Shen XM,Du R,et al.Role of AT receptor in angiotensin Ⅱ induced apoptosis in endothelial progenitor cells.Chin J Cardiovasc Med,2010,15:230-232.(in Chinese)吴志莲,沈小梅,杜瑞,等.血管紧张素受体在内皮祖细胞凋亡中的作用.中国心血管杂志,2010,15:230-232.
[12]Freitas MC,Uchida Y,Zhao D,et al.Blockade of Janus kinase-2 signaling ameliorates mouse liver damage due to ischemia and reperfusion.Liver Transpl,2010,16:600-610.
[13]Nagata S.Apoptosis by death factor.Cell,1997,88:355-365.
[14]Elgueta R,Benson MJ, deVriesVC, etal. Molecular mechanism and function of CD40/CD40L engagement in the immune system.Immunol Rev,2009,229:152-172.
[15]Liu F,Kang SM.Heterotopic heart transplantation in mice.J Vis Exp,2007,10:238.
[16]Zhou RX,Huang YM,Liu H,et al.Expression of death signal pathway in thymocyte apoptosis.Chinese Journal of Anatomy,2006,29:171-174.(in Chinese)周瑞祥,黄云梅,刘卉,等.胸腺细胞凋亡的死亡信号表达.解剖学杂志,2006,29:171-174.
[17]Yan R,Xu Q.Astilbin selectively facilitates the apoptosis of interleukin-2-dependentphytohemagglutinin-activated jurkat cells.Pharmacol Res,2001,44:135-139.
[18]Crompton T,Outram SV,Hager-Theodorides AL.Sonic hedgehog signalling in T-celldevelopmentand ctivation.NatRev Immunol,2007,7:726-735.