东北鹤虱提取物LEGPS-Ⅱ对小鼠巨噬细胞氧化损伤的保护作用
王 萌 ,杨 柳 ,杨风蕊 ,阎 嘉 ,孟 林
(1.天津医科大学药理学教研室,天津300070;2.天坛生物制品股份有限公司,北京100024)
东北鹤虱(Lappula Echinata Gilib,LEG)为紫草科植物东北鹤虱的果实,盛产于我国华北、东北等地区。药书记载,其味苦、辛、平,入脾、胃、肝三经,可治疗虫积腹痛[1],民间用其果实或全草水煎治疗各种腹疼、腹泻,尤其对慢性、迁延性腹泻有独到的疗效。前期研究证明其提取物LEGPS-Ⅱ对淋巴细胞及巨噬细胞功能有增强或调节作用[2-3],本文旨在研究该提取物对小鼠巨噬细胞氧化损伤是否有保护作用,进一步探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 试剂和药物 LEG产地为我国黑龙江省,种子类药材,呈卵形,长约3~3.5mm,由黑龙江中医药大学药学院药用植物学教研室于加宾教授鉴定。取干燥的LEG,粉碎至20目,水煎煮,过滤除药渣后合并药液,以水提醇沉法及Sevag法收集并除蛋白,得到粉末状淡黄色提取物LEG-I。LEG-I经阴离子交换柱层析再浓缩透析冻干得东北鹤虱提取物(LEGPS-Ⅱ),淡黄色粉末,易溶于水,纯度为38.7%。药物用PBS缓冲液配制成1mg/mL储备液,0.22μm微孔滤膜过滤除菌,-20℃冰箱保存,临用前用PBS缓冲液稀释成所需浓度。
RPMI-1640培养液,北京天润善达生物科技有限公司;超级新生牛血清,美国Gibco公司;四甲基偶氮唑盐(Methyl thiazolyl tetrazole,MTT),瑞士 Fluka公司;二甲基亚砜(Dimethyl sulfoxide,DMSO),美国Amresco公司;一氧化氮(NO)测试盒(硝酸还原酶法),南京建成生物研究所,批号20101229;分型一氧化氮合成酶(NOS)测试盒,南京建成生物研究所,批号20101220;BCA蛋白浓度测定试剂盒,碧云天生物技术研究所;总超氧化物歧化酶(SOD)试剂盒,南京建成生物工程研究所,批号20110104;微量丙二醛(MDA)试剂盒,南京建成生物工程研究所,批号20101228。
1.1.2 实验动物 近交系清洁级昆明种小鼠,体质量均为(20±0.25)g,4~6 周龄,雌雄不拘,购自中国人民解放军军事医学科学院实验动物中心(批准文号:SCXK-2010-003),实验前置动物于室内适应环境1周,不限食水,室温18~22℃,相对湿度50%~70%。
1.1.3 仪器 SW-CJ-1F型超净工作台(苏州净化设备有限公司);Forma SeriesⅡ型二氧化碳孵箱(Thermo Electron Corporation);CK40生物倒置显微镜(Olympus);Model680型酶标仪(Bio-Rad);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);BFX5-320型低速自动平衡离心机(白洋离心机厂)。
1.2 实验方法
1.2.1 小鼠腹腔巨噬细胞的制备 昆明种小鼠1只,颈椎脱臼处死,完全浸入75%酒精内消毒5min后取出,移入超净台内固定其四肢。小鼠腹腔内注入冷PBS缓冲液5mL,轻揉腹部5min后,用眼科剪小心剪开腹部皮肤,暴露腹膜。于腹膜上剪一小口,用无菌吸管深入腹腔内吸回PBS液。将吸出液离心1 500 r/min 10min后弃上清,用含10%超级新生牛血清的RPMI-1640完全培养液重悬沉淀。台盼蓝测定细胞存活率为90%以上,计数,用RPMI-1640培养液调整细胞浓度为2×106/mL。无菌条件下收集正常小鼠腹腔MΦ悬液完毕。
1.2.2 LEGPS-Ⅱ对小鼠腹腔巨噬细胞活性的影响 RPMI-1640培养液调整细胞浓度为2×106/mL接种于96孔板,将培养的细胞分为5组:正常对照组:加入等量培养液,不加任何药物;HO损伤组:加入终浓度0.2mmol/L的H2O2作用0.5 h;LEGPS-Ⅱ(30,60,120 μg/mL)保护组:分别加入不同浓度的LEGPS-Ⅱ孵育3 h后加入0.2mmol/L的H2O2,继续孵育0.5 h。每个浓度组设重复孔6个,37℃二氧化碳培养箱培养,后弃原培养基,各孔加入含MTT 20μL(终浓度0.5mg/L)的培养基继续培养4 h,吸弃孔内培养液,每孔加入100μLDMSO,震荡5min,用酶标仪于570 nm波长处测定吸光度值,以 OD测定组/OD对照组×100%计算细胞存活率。
1.2.3 NO、T-SOD、MDA的测定 实验分组同上,指标测定按南京建成生物工程研究所试剂盒方法操作。
1.2.4 诱导型一氧化氮合酶(iNOS)的测定 将巨噬细胞接种于6孔板中,实验分组同上,用细胞刮将细胞刮下,将培养液在室温条件下1 000 r/min离心10min,弃上清留细胞沉淀。在细胞沉淀中加入0.5~1mL的生理盐水(等渗),轻轻颠倒混匀,将培养液在室温条件下1 000 r/min离心10min,弃上清留细胞沉淀。重复这一操作1~2次。超声破碎细胞,功率300W,每3~5 s超声1次,间隔4次(每次间隔时间30 s~1min),超声过程中保证冰水浴。最后1 000 r/min离心10min,所得上清即为样品。样品按南京建成生物工程研究所试剂盒方法操作。
1.3 统计学方法 实验数据应用SPSS17.0统计软件进行处理,结果均以形式表示。多样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(ONEWAY ANOVA),方差齐者采用LSD法检验,方差不齐者采用Dunnett’s T3法检验。
2 结果
2.1 LEGPS-Ⅱ对H2O2损伤的巨噬细胞存活率的影响 见图1。

与对照组比较,H2O2处理使细胞存活率明显降低(P<0.01);与H O 组比较,LEGPS-Ⅱ各浓度组均显著提高细胞存活率(P<0.05,P<0.01),且各给药组之间差异也有显著性(P<0.05,P<0.01)。
2.2 LEGPS-Ⅱ对小鼠腹腔巨噬细胞NO及其合酶的影响 与对照组相比,H2O2损伤组NO的含量增加1倍以上(P<0.01)、iNOS活力提高2倍(P<0.01);与H2O2组相比,LEGPS-Ⅱ各浓度组均使NO的含量降低(P<0.05,P<0.01)、iNOS 的活力下降,且各组间存在统计学差异(P<0.05,P<0.01)。见图 2、3。

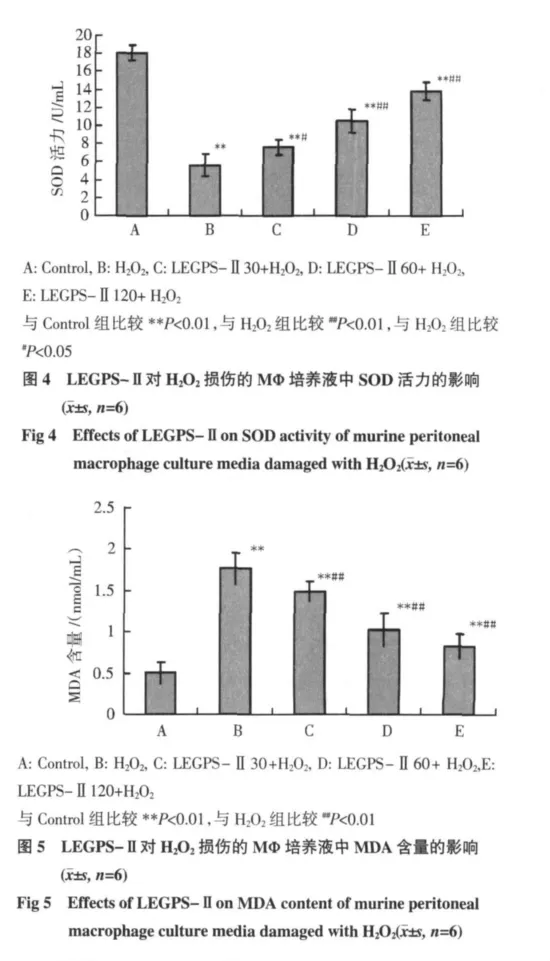
2.3 LEGPS-Ⅱ对小鼠腹腔巨噬细胞SOD的影响与对照组比较,H2O2处理使T-SOD活力显著降低(P<0.01);与H2O2组相比,LEGPS-Ⅱ各浓度组均显著提高T-SOD活力(P<0.05,P<0.01),但60μg/mL及120μg/mL LEGPS-Ⅱ给药组之间T-SOD活力差异无统计学意义。见图4。
2.4 LEGPS-Ⅱ对小鼠腹腔巨噬细胞MDA的影响 与对照组比较,H2O2处理使MDA含量明显升高(P<0.01);与H2O2组相比,LEGPS-Ⅱ各组均显著降低MDA含量(P<0.01),且各组间均有统计学意义(P<0.01),见图 5。
3 讨论
自由基是一种含有不成对电子的原子、分子或基团。超氧阴离子O2-·、羟自由基·OH、过氧化氢H2O2等通常称为活性氧自由基(ROS)。NO是一种小分子气体,含有一个未配对的电子,因而具有自由基性质。NO·及其生物体内激发产物统称为活性氮自由基(RNS)。生理情况下机体产生的自由基很少并参与机体的多种生理生化过程,体内还存在抗自由基系统:一类是酶性防御系统,包括SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)等;另一类是非酶性防御系统,包括维生素C、维生素E、谷胱甘肽(glutathione,GSH)[4-5]等。它们对清除自由基、保护细胞及机体正常生理功能起重要作用。氧化应激是指由于OFR过量生成或细胞内抗氧化防御系统受损,导致OFR及其相关代谢产物过量聚集,从而对细胞产生多种毒性作用的病理状态。ROS和RNS均可引起氧化应激。
H2O2是一种重要的ROS,极易透过细胞膜,与细胞内铁离子通过反应形成高活性的自由基,导致一系列反应,其易于获得,性质相对稳定,所以它已成为研究细胞氧化损伤的重要工具。本实验以H2O2造成小鼠腹腔巨噬细胞的氧化应激状态,观察东北鹤虱提取物LEGPS-Ⅱ的抗氧化损伤作用[6]。
iNOS主要分布于巨噬细胞、肝细胞等,当受到某些细胞因子,如内毒素、白介素、脂多糖及干扰素刺激后而表达。NO是在iNOS催化下L-精氨酸生成L-瓜氨酸的反应中形成的小分子气体自由基,研究证实NO在各种炎性疾病病理过程中起重要作用,炎性反应时,主要由巨噬细胞生成NO。适量的NO有助于杀灭病原微生物、减轻炎性反应等,但过量的NO可与超氧阴离子(O2-)等氧自由基反应,表现为明显的细胞毒效应。本实验中,H2O2处理使巨噬细胞培养液中iNOS活力增加,NO含量明显升高,提示H2O2可引起巨噬细胞氧化损伤。在LEGPS-Ⅱ的干预下,iNOS活力明显降低,NO含量明显减少。由iNOS催化合成的NO是介导细胞毒性的NO的主要来源,刺激因素下细胞内iNOS是NO产生的重要限速酶[7-8],提示LEGPS-Ⅱ可能是通过抑制iNOS表达从而抑制细胞内NO产生,因而发挥抗氧化作用。
SOD催化O2-歧化为O2和H2O2。此酶是已知抗氧化酶系中速率最快的抗氧化酶之一,Vmax约为2×109mol/Ls。SOD是生物体内清除自由基的首要物质,保护机体免受ROS损伤,其值可以间接反映机体清除ROS的能力[9]。本实验在H2O2诱导的巨噬细胞氧化损伤中,LEGPS-Ⅱ能提高巨噬细胞T-SOD活力,发挥抗氧化作用。
体内最重要的脂质过氧化代谢产物是MDA[10],MDA为极活泼的交联剂,随即与磷脂酰乙醇胺交联成荧光色素,然后与蛋白质、肽类或脂质结合成难溶性的无生理活性的色素斑点,沉积于细胞内,称为脂褐素。因此MDA是反映机体ROS损害的指标,测试MDA的量不仅可反映机体内脂质过氧化的程度,而且可间接反映细胞受ROS攻击而损伤的程度[11-12]。本实验中,LEGPS-Ⅱ能降低H2O2损伤下巨噬细胞MDA的含量,减少脂质过氧化损伤。
本实验结果表明,东北鹤虱提取物LEGPS-Ⅱ对自由基具有清除作用,能抑制iNOS表达而减少细胞内NO产生,能减少脂质过氧化产物MDA的生成量,还能提高抗氧化酶SOD活性,表现出多种途径的抗氧化作用。东北鹤虱具有广泛的生物活性,而抗氧化损伤是其重要的作用机制之一。
[1]冉先德.中华药海[M].哈尔滨:哈尔滨出版社,1987:1062-1064[2]于跃,杨柳,郭秀英,等.东北鹤虱水提取物对小鼠脾淋巴细胞体外增殖、分泌IL-2和TNF-α的作用[J].天津医科大学学报,2010,16(3):424
[3]杨柳,王萌,于跃,等.东北鹤虱多糖对免疫抑制小鼠腹腔巨噬细胞功能的影响[J].天津医科大学学报,2011,17(3):328
[4]徐敏.论人体的自由基和抗氧化剂-谷胱甘肽[J].医药产业资讯,2006,3(2)∶127
[5]谭峰,刘群良,张月娟,等.还少丹对大鼠谷胱甘肽过氧化物酶活性及丙二醛含量影响的研究[J].中医药导报,2006,12(7):1
[6]帅学宏,胡庭俊,张霞,等.蕨麻多糖组分抑制过氧化氢诱导小鼠脾淋巴细胞凋亡的作用[J].药学学报,2009,44(9):987
[7]Olas B,Saluk Juszczak J,Pawlaczyk I,etal.Antioxidant and anti aggregatory effects of an extract from Conyza canadensis on blood platelets in vitro[J].Platelets,2006,17(6):354
[8]杨学礼,冯娟.一氧化氮的生物效应及其作川机制的研究[J].生理科学进展,2008,39(1):91
[9]Barba I,Chavarria L,Ruiz-Meana M.Effect of intracellular lipid dropletson cytosolic Ca2+and celldeath during ischaemia-reperfusion injury in cardiomyocytes[J].JPhysiol,2009,587(6):1331
[10]熊彦红,齐双岩,金若敏,等.川楝子对大鼠肝毒性的时效和量效关系研究[J].江苏中医药,2008,40(7):83
[11]Jusman SW,Halim A,Wanandi S I,et al.Expression of hypoxia-inducible factor-1alpha(HIF-1 alpha) related to oxidative stress in liver of rat-induced by systemic chronic normobaric hypoxia[J].ActaMed Indones,2010,42(1):17
[12]Oka T,Itoi T,Terada N,et al.Change in the membranous lipid composition accelerates lipid peroxidation in young rathearts subjected to2 weeksofhypoxia followed by hyperoxia[J].Circ J,2008,72(8):1359

