化学液相还原法制备零价铁纳米颗粒研究进展及展望
樊明德,袁 鹏,何宏平,陈天虎,朱建喜,刘 冬,郝 娇
(1内蒙古大学环境与资源学院,内蒙古 呼和浩特 010021;2中国科学院广州地球化学研究所,矿物学与成矿学重点实验室,广东 广州 510640;3中国科学院广州地球化学研究所,广东 广州 510640;4合肥工业大学资源与环境工程学院,安徽 合肥 230009)
进展与述评
化学液相还原法制备零价铁纳米颗粒研究进展及展望
樊明德1,2,袁 鹏3,何宏平3,陈天虎4,朱建喜3,刘 冬3,郝 娇1
(1内蒙古大学环境与资源学院,内蒙古 呼和浩特 010021;2中国科学院广州地球化学研究所,矿物学与成矿学重点实验室,广东 广州 510640;3中国科学院广州地球化学研究所,广东 广州 510640;4合肥工业大学资源与环境工程学院,安徽 合肥 230009)
零价铁纳米颗粒磁性能卓越应用潜力巨大,已受到广泛关注。本文综述了采用化学液相还原法制备纳米铁的研究进展。总结了纳米铁制备过程中容易团聚和氧化两个关键问题:使用稳定剂可降低纳米铁团聚程度,表面包覆外壳可抑制纳米铁深度氧化。并详细介绍了水合肼、多元醇、碱金属硼氢化物 3种常用还原剂的还原性能及其在制备过程中表现出的优缺点。提出化学液相还原制备纳米铁技术的发展依赖于对稳定剂与包覆剂的深入研究,对于还原反应工艺流程的工业化放大以及如何降低成本。
化学液相还原;零价铁纳米颗粒;水合肼;多元醇;碱金属硼氢化物
零价铁纳米颗粒以其卓越的磁性能及巨大的应用潜力备受瞩目,可广泛用于磁流体制备、磁共振成像、磁性细胞分离、磁存储材料开发、镍-铁电池制造及催化与环境修复等众多领域[1]。特别在环境修复领域,纳米级铁颗粒比毫米微米级铁颗粒处理效率更高,用其处理有机氯化物[2]、重金属离子[3]、染料[4]及硝酸盐[5]等污染物的探索工作已大量展开,为铁纳米颗粒研究注入了强大活力。
当前,已发展出多种物理、化学方法用于零价铁纳米颗粒的制备,主要有高能球磨法、电沉积法、化学气相沉积法、溶胶-凝胶法、共沉淀法、热分解羰基铁法及化学液相还原法等[6]。就效率、复杂程度、成本而言,这些方法互不相同,其中热分解羰基铁法和化学液相还原法是两种广为应用的重要方法。热分解羰基铁法可制得粒径分布均匀的细小高纯铁纳米颗粒,但热能损耗大、原料毒性强、成本高且产量有限不能满足大规模需求[7],从费用效益角度看存在一定的局限性。比较而言,化学液相还原法更为简便、经济、安全、高效[8],这种方法通常是在水溶液中利用化学还原剂还原Fe2+或Fe3+来制备零价铁纳米颗粒。本文概述了化学液相还原法制备零价铁纳米颗粒的研究进展,讨论分析了其中存在的问题及常用还原剂的效能,并对该制备技术的发展做了进一步展望。
1 化学液相还原法制备零价铁纳米颗粒存在的两个问题
1.1 零价铁纳米颗粒容易团聚
由于粒径微小表面能较大,为降低自身表面能,零价铁纳米颗粒容易团聚。团聚会使零价铁纳米颗粒尺寸变大、失去许多基于小尺寸的纳米特性,从而影响其实际应用价值。如何阻止团聚是零价铁纳米颗粒制备过程中亟需解决的关键问题。从现有研究成果来看,较为有效的解决办法是加入稳定剂(也称分散剂)阻止零价铁纳米颗粒团聚。稳定剂的作用机理涉及配位效应、静电效应和空间效应,具体到某一种稳定剂,其作用机理还需具体分析,对该问题的深入了解可参考王立英等的评述文章[9]。
化学液相还原法制备零价铁纳米颗粒过程中,聚合物与表面活性剂是最为常用的稳定剂,通常能取得良好的分散效果。例如,Huang和 Ehrman[10]利用硼氢化钠还原溶液中的Fe2+制备零价铁纳米颗粒时,以聚丙烯酸(PAA)为稳定剂,有效提高了铁颗粒的分散程度。Zhang等[11]以表面活性剂十六烷基三甲基溴化铵(CTAB)为稳定剂,通过水合肼液相还原Fe2+,成功制备了分散程度较高的棒状零价铁纳米颗粒。聚合物与表面活性剂分散效果良好,但存在价格较高、环境友好性不强、可能造成污染等问题,为此,多种无机化学惰性载体(如硅胶[12]、氧化铝[13]、活性炭[14]、碳纳米管[15]、沸石分子筛[16]、硅酸盐黏土矿物[17-20]等)也被用来稳定零价铁纳米颗粒。纳米颗粒稳定于载体上易于回收、循环利用,加之载体本身具备一定的机械强度,使其在催化、吸附及环境修复等方面的应用更为有利、更具环境友好性。蒙脱石是一种天然产出的硅酸盐黏土矿物,具有2∶1型的层状结构,其结构单元层由二个Si—O4四面体片中间夹一个Al—O4(OH)2八面体片构成,单元层之间通过微弱的偶极作用力或Van der Waals力进行堆垛,使得水分子及其它极性分子能够进入层间,导致晶格沿c轴方向膨胀,形成面积较大的层间域,层间域由水合阳离子占据以平衡同晶取代所产生的层板负电荷,通过离子交换易向其中引入其它阳离子。独特的阳离子交换及膨胀性能可促进蒙脱石层间域内插层反应的进行,同时在其层板外表面还可发生吸附反应[21],使得利用蒙脱石层板内、外表面作为“反应器”制备并分散纳米颗粒较为适合。作者以蒙脱石为载体和稳定剂,通过硼氢化钠液相还原Fe3+,制备了分散程度较高的零价铁纳米颗粒[1,17,22]:未加蒙脱石制得的铁纳米颗粒由于静磁作用呈链状团聚态[图1(a)],蒙脱石作用下制得的铁纳米颗粒高度分散[图1(b)],分散作用主要来源于蒙脱石层板负电荷对铁纳米颗粒成核、长大过程的限制[17]。此外,淀粉[23]、壳聚糖[24]、树脂[25]等物质也被用来分散零价铁纳米颗粒,这些物质价格较低、无毒无害、分散效果较好,用作稳定剂也具有一定优势。
1.2 零价铁纳米颗粒容易氧化
除了容易团聚,零价铁纳米颗粒比表面积大、反应活性强还容易氧化,为其实际应用带来新的困难。一般而言,脱离超高真空或惰性气氛全程保护,铁纳米颗粒的表面氧化难以杜绝,常用的解决办法是表面包覆形成核-壳结构,抑制深度氧化。化学液相还原法制备零价铁纳米颗粒过程中,常以聚合物、表面活性剂、贵金属与过渡金属及无定形二氧化硅和石墨等物质形成表面包覆层。例如,Bonder等[26]以不同种类聚乙二醇包覆零价铁纳米颗粒,结果表明直链聚乙二醇和甲氧基封端的聚乙二醇不能有效阻止铁纳米颗粒氧化;羧基封端的聚乙二醇可有效提高铁纳米颗粒抗氧化能力,使其α-Fe含量明显增多。An等[27]在铁纳米颗粒表面通过化学键和作用包覆油酸钠,赋予了铁颗粒良好的空气稳定性。利用贵金属与过渡金属包覆铁纳米颗粒的研究较多,效果不一,通常贵金属包覆较为有效。Jafari等[28]成功制备了表面包覆金的铁纳米颗粒,金外壳可有效阻止铁核氧化,他们采用的方法是先在反胶束体系中合成铁纳米颗粒,再向体系中引入HAuCl4,通过硼氢化钠还原 HAuCl4在铁颗粒表面形成金包覆层,可以理解为借助化学还原反应形成金属包覆层。相似的方法也被用来向铁纳米颗粒表面引入镍[29]和钴[30]包覆层。另一种更为简便的方法是将制得的铁纳米颗粒浸于活性较低金属的盐溶液中,利用电化学反应在铁颗粒表面形成金属包覆层,如 Zhang等[31]利用这种方法在铁纳米颗粒表面包覆了铂外壳。二氧化硅和石墨均为稳定无机物,用于表面包覆可有效提高铁纳米颗粒抗氧化能力,Cheng等[32]在制得的铁纳米颗粒表面通过Stöber法包覆了无定形二氧化硅,Kosugi等[33]在铁纳米颗粒表面包覆了石墨。采用这些物质表面包覆,虽效果理想,但常涉及复杂操作,不容易进行。

图1 Fan等制备的零价铁纳米颗粒[17,22]

图2 Martin等[36]制备的表面包覆铁氧化物外壳的零价铁纳米颗粒
上述方法均倾向引入外来物质包覆铁纳米颗粒,实际上,也可直接以铁颗粒表面自生的铁氧化物层作为包覆外壳。例如,Wang等[34]以Ni2O3薄层包覆铁纳米颗粒,但该薄层未能阻止铁核继续氧化,在铁核表面与Ni2O3薄层之间形成了铁氧化物层,铁纳米颗粒最终通过铁氧化物层的保护实现稳定。具有铁氧化物外壳的零价铁纳米颗粒已得到极大关注,众多研究集中于此[17,22,35-36],外壳一般由铁氧化物纳米多晶构成,厚2~5 nm(图2),其中的铁氧化物常为尖晶石型磁赤铁矿、磁铁矿、非化学计量磁铁矿或它们的混合物,也可能是方铁体[37]。相对而言,在铁纳米颗粒表面形成铁氧化物包覆层较为简单,很多研究在铁纳米颗粒制备过程中不刻意控制氧化,利用自发形成的铁氧化物层保护铁颗粒,往往也能取得满意的抗氧化效果,特别是聚合物或表面活性剂参与铁纳米颗粒制备时,表面铁氧化物层常起到实质性抗氧化作用[10,38-39]。此外,铁氧化物外壳成分可通过控制铁纳米颗粒和空气或氧气的接触速率方便的加以调节。例如,Kuhn等[37]将铁纳米颗粒以两种不同方式和空气接触进行氧化:一种是和空气逐步接触,得到磁赤铁矿表面包覆层;另一种是和空气快速接触,得到非化学计量磁铁矿表面包覆层。这种成分可控性调节为深入研究铁氧化物外壳功用及性能提供了便利。
值得指出的是,表面包覆纳米颗粒形成核-壳结构也是一种重要的修饰手段,在保护内核的同时还可调节颗粒性能,使颗粒显示出一些新的物理、化学特性。如,和纯金胶体相比,包覆金外壳的铁纳米颗粒胶体表面等离子振动吸收出现红移、宽化现象,且显示出不同于纯金胶体的粒径分布及聚沉特性[40];二氧化硅包覆层可赋予内核新的反应位,改变其传导和光学性能,提高内核分散稳定性[41];也有研究证实表面包覆可以改变纳米颗粒磁性能,提高颗粒生物兼容性[42]。对于铁纳米颗粒,被包覆才能在环境条件中稳定存在,包覆外壳在保护铁核的同时还对颗粒电荷及质量传递起到重要作用[43-44],需要考虑外壳结构、性质对颗粒整体性能的影响。
总体比较,以聚合物和表面活性剂包覆铁纳米颗粒,其抗氧化效果难以保证,这种包覆很大程度上依赖铁纳米颗粒表面铁氧化物层发挥作用;贵金属和过渡金属种类的选择在应用中可能出现问题,它们并非全部有效;二氧化硅和石墨效果明显,但复杂的操作阻碍了其普遍应用;以表面自生的铁氧化物层包覆铁纳米颗粒简单、有效且充分考虑了表面铁氧化物难于避免的实际情况,极具吸引力。
2 化学液相还原法制备零价铁纳米颗粒常用的3种还原剂
液相化学还原铁盐制备零价铁过程中,由于零价铁化学势能较高,铁盐倾向转化为化学势能较低的氢氧化物,获取零价铁并不容易[45]。目前,主要是利用水合肼、多元醇和碱金属硼氢化物3种还原剂实现液相还原制备零价铁纳米颗粒。
2.1 水合肼
水合肼(又称水合联氨)还原能力强、成本低、用其制备的金属纳米颗粒杂质较少,已成功用于多种金属纳米颗粒的制备。Zheng研究组[30,32,46-47]详细研究了利用水合肼液相还原Fe2+或Fe3+制备零价铁纳米颗粒的可行性,给出了有意义的结论:比较标准电动势,理论上开放体系中常压条件下水合肼能够还原铁离子制备零价铁纳米颗粒,但还原反应发生之前水合肼先行分解,导致还原反应难以进行;解决办法是提高反应体系压力抑制水合肼分解,增大反应体系碱浓度加强水合肼还原能力,两种措施可共同起作用促进还原反应。据此,他们提出了利用高压釜控制水热条件制备零价铁纳米颗粒的一步法,典型步骤为:溶一定量铁盐于适当溶剂(水、乙醇、乙二胺等),之后向其中加入适量 NaOH和水合肼,搅拌均匀后移入高压釜密封恒温反应,所得产物用蒸馏水和乙醇漂洗,真空干燥后得到铁纳米颗粒。一步法不仅可成功制备零价铁纳米颗粒,还可通过调节溶剂组成控制铁颗粒的大小及形状,且操作简便,具有极大的应用前景。例如,Ni等[47]以一步法制备零价铁纳米颗粒时,分别采用水和乙醇为溶剂,水溶剂条件下制得的铁纳米颗粒呈立方形、粒径较大[图3(a)],乙醇溶剂条件下却得到细小的粒状铁纳米颗粒[图3(b)]。这种尺寸和形状上的差异也导致两种铁纳米颗粒磁性能产生差异,和水溶剂条件下制得的铁颗粒相比(矫顽力为198 Oe),乙醇溶剂条件下制得的铁颗粒具有更大的矫顽力(达247 Oe)[47]。此外,朱燕超等[48]利用柠檬酸根先行与Fe2+络合、避免难还原Fe(OH)2的生成,在常温常压条件下通过水合肼还原制备了零价铁纳米颗粒,也为利用水合肼液相还原制备铁纳米颗粒提供了启示。

图3 Ni等以一步法制备的零价铁纳米颗粒[47]
2.2 多元醇
多元醇液相化学还原金属盐是一种重要的金属纳米颗粒制备方法,反应体系中多元醇不仅是还原剂,还充当金属盐的溶剂,并可在一定程度上阻止产物氧化[49-51],多元醇的这种多功用性使这一方法简便实用。一般而言,多元醇在其沸点可直接还原金属氧化物,还原金属氢氧化物时经历氢氧化物脱水及脱水产物的氧化过程,均较为简单。多元醇还原其它金属络合物或化合物时反应较复杂,因为对反应起重要作用的还原速率受多元醇自身还原势能、反应温度、氢氧根离子浓度、金属盐浓度及多元醇与金属盐种类等多种因素影响:还原势能大,金属离子被快速还原形成大量晶核,晶体生长所需离子不足,晶粒会较小;反应温度影响多元醇还原势能,随着反应温度的升高多元醇还原势能增大,在其沸点达到最大值;氢氧根离子能加快还原反应速率,理论解释为它可在较低温度下促进反应中间体的生成,但尚未实验证实;增大金属离子浓度也可加快还原反应速率;不同种类的多元醇还原势能不同,影响反应中氢氧根离子需用量,制备相同大小的颗粒时,还原势能较高的多元醇所需氢氧根离子量较少,多元醇种类不同时反应中间体生成条件也会发生改变,这种改变同时受金属盐种类的影响[49]。利用该复杂反应制备金属纳米颗粒需全面考虑上述各种因素,对还原势能的考虑尤为必要,但由于实验测定的困难及其受温度影响所具有的不确定性,对不同种类多元醇还原势能的比较并不容易[49]。三乙二醇(TEG)、乙二醇(EG)、1,3-丙二醇(TMEG)在纳米颗粒制备中应用价值较高,Jeyadevan等[49]利用分子轨道理论对其还原势能进行了比较,由弱到强依次为TEG<EG<TMEG,与已有实验观察相吻合。
以往研究认为多元醇参与下铁纳米颗粒的形成依赖于铁离子的歧化作用,多元醇还原能力弱不足以还原铁离子制备铁颗粒[52],然而,Jeyadevan研究组[49,53-54]证实了可以通过多元醇还原铁离子制备铁纳米颗粒。Joseyphus等[54]研究了多元醇液相还原制备铁纳米颗粒的可行性,并基于多元醇还原反应的复杂性,在考虑到铁盐种类与浓度、氢氧根离子浓度、反应温度等影响因素的情况下对多元醇种类所起作用进行了细致考察。结果表明,所用的3种多元醇TEG、EG和TMEG均可在393 K较低温度下制得铁纳米颗粒,颗粒粒径变化规律与其受多元醇还原势能影响的理论预测一致。特别的,颗粒产量及粒径受多元醇种类影响,证实了铁纳米颗粒的形成依赖于多元醇还原作用而非铁离子歧化作用。Joseyphus等[54]还对利用EG还原制备铁纳米颗粒做了进一步考察,发现最优条件下可减小颗粒氧化程度,得到纯度较高的亚微米级立方铁颗粒[图4(a)],这种铁颗粒具备铁磁性,由于氧化程度减小,饱和磁化强度高达182.5 A m2/kg[图4(b)]。Jeyadevan研究组的工作订正了不能以多元醇还原制备铁纳米颗粒的传统认识,为利用多元醇发展简便实用的铁纳米颗粒制备方法提供了依据。

图4 Joseyphus等[54]以EG为还原剂制备的亚微米级立方铁颗粒及磁滞回线图
2.3 碱金属硼氢化物
碱金属硼氢化物(如硼氢化钠与硼氢化钾)水解产生氢气,酸性介质中水解反应被加强[55],可有效还原多种金属盐,过去数十年内,用其液相还原制备纳米颗粒的研究已大量展开[56-58],但该制备过程受众多因素影响较为复杂、重现性差,反应介质、反应物浓度、硼与金属比值、介质pH值、反应温度、混合方式、洗涤与干燥过程等均可能影响产物的成分、结构、大小和形态[59]。用碱金属硼氢化物在水溶液中还原铁盐制备铁纳米颗粒尤为困难,常因硼的介入生成无定形硼化物而非零价铁[59-60]。Glavee等[57]研究了硼氢化钠在水介质和有机介质中还原Fe2+与Fe3+的情况,揭示了碱金属硼氢化物还原铁离子的化学本质。研究发现,水溶液中硼氢根离子还原Fe2+遵守化学方程式(1)。

反应受体系介质影响显著,真空保护下在水介质中形成α-Fe和Fe2B,若水中混有有机物还将形成Fe23B6,且各成分相对含量受混合介质中水量影响显著,对此的解释为反应有中间体[Fe(H2O)5(OHBH3)]+生成,它的聚合及还原反应对产物成分组成及各成分相对含量有重要影响。水溶液中还原Fe3+的情况与还原Fe2+类似,也是先生成中间体([Fe(H2O)5(OHBH3)]2+),最终得到氢氧化硼与铁的混合物,遵守化学方程式(2)。
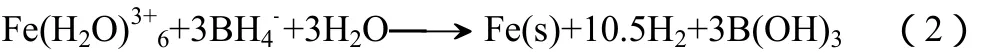
需指出的是,Glavee等的研究是在严格真空或惰性气氛条件下进行的,脱离这一条件,产物和空气接触被氧化形成铁氧化物和硼酸盐,不能得到铁纳米颗粒,这一条件增加了制备过程操作的复杂性。
实际应用和理论研究中显然希望利用碱金属硼氢化物液相还原制备铁纳米颗粒操作更简便、制备过程更容易控制、铁颗粒的分散及抗氧化性能更好,制备过程中使用稳定剂同时引入表面包覆外壳为实现这一愿望创造了条件。例如,Wang等[34]以月桂基硫酸钠(SLS)为稳定剂利用硼氢化钾成功制备了铁纳米颗粒,颗粒用含Ni2+修饰液处理形成表面包覆层抑制氧化,制备过程并未涉及真空保护及惰性气氛条件,操作较为简便。Wang等[61]还利用硼氢化钾在反胶束体系中制备了表面包覆铁氧化物外壳的铁纳米颗粒,制备过程同样没有涉及真空及惰性气氛条件。Schrick等[62]在PAA参与情况下利用硼氢化钠还原制备了铁纳米颗粒,没有对反应器中的氧加以特别控制。Huang和Ehrman[10]在空气环境中以PAA为稳定剂,利用硼氢化钠还原制备分散程度较高的铁纳米颗粒同样取得了成功,所得铁颗粒在5 K温度下表现出铁磁性,在350 K温度下由于热扰动表现出超顺磁性。可见,适当控制反应条件、合理利用抗氧化措施、明智选择稳定剂,有望使碱金属硼氢化物液相还原制备铁纳米颗粒这一方法更为简便、实用和有效。
3 结 语
零价铁纳米颗粒磁性能卓越化学活性强,在催化、吸附、材料开发及环境修复等诸多领域有着广阔的应用前景。利用化学液相还原法制备零价铁纳米颗粒简便、经济、安全、高效,和其它方法相比,具有独特的优越性,制备过程中需解决零价铁纳米颗粒容易团聚和氧化两个关键问题。团聚问题常通过在反应体系中引入稳定剂加以解决,氧化问题常通过在铁纳米颗粒表面形成包覆外壳加以解决。化学液相还原过程中,水合肼、多元醇、碱金属硼氢化物是3种最为常用的还原剂,均可有效还原铁离子制备铁纳米颗粒。
用于分散铁纳米颗粒的稳定剂种类较多,选用无机化学惰性载体作稳定剂可同时实现对铁颗粒的负载,便于铁颗粒的回收、循环利用,使其环境友好性增强。层状硅酸盐黏土矿物(如蒙脱石、高岭石)价格低廉、无毒无害、具有天然微-介孔结构,用作无机稳定剂较为适合,理论研究及实际应用中需深入了解其稳定效果与作用机理。表面自生的铁氧化物层可有效抑制铁纳米颗粒深度氧化,且生成条件简单、成分可调节,用作包覆外壳较为理想,实际应用中铁氧化物包覆层还对颗粒起到修饰作用,研究包覆层结构、性质对颗粒整体性能的影响将是一个重要的发展方向。水合肼、多元醇、碱金属硼氢化物均可有效还原制备零价铁纳米颗粒,为了零价铁纳米颗粒的商业化应用,需结合各类还原剂作用特点注重工艺的放大研究和低成本化研究。值得关注的是,多元醇在反应体系中可同时作为还原剂和金属盐溶剂,并可在一定程度上起到稳定剂作用,这种多功用性使多元醇液相还原制备零价铁纳米颗粒操作较为简便、有望实现工业放大。
[1] Fan M,Yuan P,Chen T,et al. Synthesis,characterization and size control of zerovalent iron nanoparticles anchored on montmorillonite[J].Chinese Science Bulletin,2010,55(11):1092-1099.
[2] Liu Z,Zhang F S. Nano-zerovalent iron contained porous carbons developed from waste biomass for the adsorption and dechlorination of PCBs[J].Bioresource Technology,2010,101(7):2562-2564.
[3] Boparai H K,Joseph M,O’Carroll D M. Kinetics and thermodynam ics of cadm ium ion removal by adsorption onto nano zerovalent iron particles[J].Journal of Hazardous Materials,2011,186(1):458-465.
[4] Satapanajaru T,Chompuchan C,Suntornchot P,et al. Enhancing decolorization of reactive black 5 and reactive red 198 during nano zerovalent iron treatment[J].Desalination,2011,266(1-3):218-230.
[5] Kassaee M Z,Motamedi E,M ikhak A,et al. Nitrate removal from water using iron nanoparticles produced by arc dischargevs. reduction[J].Chemical Engineering Journal,2011,166(2):490-495.
[6] Huber D L. Synthesis,properties,and applications of iron nanoparticles[J].Small,2005,1(5):482-501.
[7] Amara D,Felner I,Now ik I,et al. Synthesis and characterization of Fe and Fe3O4nanoparticles by thermal decomposition of triiron dodecacarbonyl[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2009,339(1-3):106-110.
[8] Sun Y P,Li X,Cao J,et al. Characterization of zero-valent iron nanoparticles[J].Advances in Colloid and Interface Science,2006,120(1-3):47-56.
[9] 王立英,蔡灵剑,沈頔,等. 金属纳米颗粒制备中的还原剂与修饰剂[J]. 化学进展,2010,22(4):580-592.
[10] Huang K C,Ehrman S H. Synthesis of iron nanoparticlesviachemical reduction w ith palladium ion seeds[J].Langmuir,2007,23(3):1419-1426.
[11] Zhang D,Ni X,Zheng H. Surfactant-controlled synthesis of Fe nanorods in solution[J].Journal of Colloid and Interface Science, 2005,292(2):410-412.
[12] Moreno M S,Weyland M,M idgley P A,et al. Highly anisotropic distribution of iron nanoparticles w ithin MCM-41 mesoporous silica[J].Micron.,2006,37(1):52-56.
[13] Karabelli D,Ünal S,Shahwan T,et al. Preparation and characterization of alum ina-supported iron nanoparticles and its application for the removal of aqueous Cu2+ions[J].Chemical Engineering Journal,2011,168(2):979-984.
[14] Tseng H H,Su J G,Liang C. Synthesis of granular activated carbon/zero valent iron composites for simultaneous adsorption/dechlorination of trichloroethylene[J].Journal of Hazardous Materials,2011,192(2):500-506.
[15] Liu S,Wehmschulte R J. A novel hybrid of carbon nanotubes/iron nanoparticles:Iron-filled nodule-containing carbon nanotubes[J].Carbon,2005,43(7):1550-1555.
[16] Wang W,Zhou M,Mao Q,et al. Novel NaY zeolite-supported nanoscale zero-valent iron as an efficient heterogeneous Fenton catalyst[J].Catalysis Communications,2010,11(11):937-941.
[17] Fan M,Yuan P,Zhu J,et al. Core–shell structured iron nanoparticles well dispersed on montmorillonite[J].Journal of Magnetism and Magnetic Materials,2009,321(20):3515-3519.
[18] Frost R L,Xi Y,He H. Synthesis,characterization of palygorskite supported zero-valent iron and its application for methylene blue adsorption[J].Journal of Colloid and Interface Science,2010,341(1):153-161.
[19] Zhang X,Lin S,Chen Z,et al. Kaolinite-supported nanoscale zero-valent iron for removal of Pb2+from aqueous solution:Reactivity,characterization and mechanism[J].Water Research,2011,45(11):3481-3488.
[20] Xi Y,Megharaj M,Naidu R. Dispersion of zerovalent iron nanoparticles onto bentonites and use of these catalysts for orange Ⅱdecolourisation[J].Applied Clay Science,2011,53(4):716-722.
[21] Chen B,Evans J R G. Preferential intercalation in polymer-clay nanocomposites[J].The Journal of Physical Chemistry B,2004,108(39):14986-14990.
[22] Fan M,Yuan P,Bergaya F,et al. A critical textural evolution study of zerovalent iron/montmorillonite nanosized heterostructures under various iron loadings[J].Clays and Clay Minerals,2011,59(5):490-500.
[23] Alidokht L,Khataee A R,Reyhanitabar A,et al. Reductive removal of Cr(Ⅵ) by starch-stabilized Fe0nanoparticles in aqueous solution[J].Desalination,2011,270(1-3):105-110.
[24] Gupta A,Yunus M,Sankararamakrishnan N. Zerovalent iron encapsulated chitosan nanospheres——A novel adsorbent for the removal of total inorganic Arsenic from aqueous systems[J].Chemosphere,2012,86(2):150-155.
[25] Comba S,Sethi R. Stabilization of highly concentrated suspensions of iron nanoparticles using shear-thinning gels of xanthan gum[J].Water Research,2009,43(15):3717-3726.
[26] Bonder M J,Zhang Y,Kiick K L,et al. Controlling synthesis of Fe nanoparticles w ith polyethylene glycol[J].Journal of Magnetism and Magnetic Materials,2007,311(2):658-664.
[27] An Y,Li T,Jin Z,et al. Effect of bimetallic and polymer-coated Fe nanoparticles on biological denitrification[J].Bioresource Technology,2010,101(24):9825-9828.
[28] Jafari T,Simchi A,Khakpash N. Synthesis and cytotoxicity assessment of superparamagnetic iron-gold core-shell nanoparticles coated with polyglycerol[J].Journal of Colloid and Interface Science,2010,345(1):64-71.
[29] Xu J,Dozier A,Bhattacharyya D. Synthesis of nanoscale bimetallic particles in polyelectrolyte membrane matrix for reductive transformation of halogenated organic compounds[J].Journal of Nanoparticle Research,2005,7(4-5):449-467.
[30] Yang D,Ni X,Zhang D,et al. Preparation and characterization of hcp Co-coated Fe nanoparticles[J].Journal of Crystal Grow th,2006,286(1):152-155.
[31] Zhang X B,Yan J M,Han S,et al. Magnetically recyclable Fe@Pt core-shell nanoparticles and their use as electrocatalysts for ammonia borane oxidation:The role of crystallinity of the core[J].Journal of the American Chemical Society,2009,131(8):2778-2779.
[32] Cheng J,Ni X,Zheng H,et al. Preparation of Fe (core)/SiO2(shell) composite particles w ith improved oxidation-resistance[J].Materials Research Bulletin,2006,41(8):1424-1429.
[33] Kosugi K,Bushiri M J,Nishi N. Formation of air stable carbon-skinned iron nanocrystals from FeC2[J].Applied Physics Letters,2004,84(10):1753-1755.
[34] Wang C Y,Chen Z Y,Cheng B,et al. The preparation,surface modification,and characterization of metallic α-Fe nanoparticles[J].Materials Science and Engineering:B,1999,60(3):223-226.
[35] Zhang G,Liao Y,Baker I. Surface engineering of core/shell iron/iron oxide nanoparticles from m icroemulsions for hypertherm ia[J].Materials Science and Engineering:C,2010,30(1):92-97.
[36] Martin J E,Herzing A A,Yan W,et al. Determ ination of the oxide layer thickness in core-shell zerovalent iron nanoparticles[J].Langmuir,2008,24(8):4329-4334.
[37] Kuhn L T,Bojesen A,Timmermann L,et al. Structural and magnetic properties of core-shell iron-iron oxide nanoparticles[J].Journal of Physics:Condensed Matter,2002,14(49):13551-13567.
[38] Cirtiu C M,Raychoudhury T,Ghoshal S,et al. Systematic comparison of the size,surface characteristics and colloidal stability of zero valent iron nanoparticles pre- and post-grafted w ith common polymers[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2011,390(1-3):95-104.
[39] Sun Y P,Li X Q,Zhang W X,et al. A method for the preparation of stable dispersion of zero-valent iron nanoparticles[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2007,308(1-3):60-66.
[40] Lin J,Zhou W,Kumbhar A,et al. Gold-coated iron (Fe@Au)nanoparticles:Synthesis,characterization,and magnetic field-induced self-assembly[J].Journal of Solid State Chemistry,2001,159(1):26-31.
[41] Hardikar V V,Matijevic E. Coating of nanosize silver particles w ith silica[J].Journal of Colloid and Interface Science,2000,221(1):133-136.
[42] de la Presa P,Multigner M,Morales M P,et al. Synthesis and characterization of FePt/Au core-shell nanoparticles[J].Journal of Magnetism and Magnetic Materials,2007,316(2):e753-e755.
[43] Sohn K,Kang S W,Ahn S,et al. Fe(0) nanoparticles for nitrate reduction:Stability,reactivity,and transformation[J].Environmental Science & Technology,2006,40(17):5514-5519.
[44] Nurmi J T,Tratnyek P G,Sarathy V,et al. Characterization and properties of metallic iron nanoparticles:Spectroscopy,electrochemistry,and kinetics[J].Environmental Science & Technology,2005,39(5):1221-1230.
[45] Su X,Zheng H,Yang Z,et al. Preparation of nanosized particles of FeNi and FeCo alloy in solution[J].Journal of Materials Science,2003,38(22):4581-4585.
[46] Qi B,Li D,Ni X,et al. A facile chem ical reduction route to the preparation of single-crystalline iron nanocubes[J].Chemistry Letters,2007,36(6):722-723.
[47] Ni X,Su X,Zheng H,et al. Studies on the one-step preparation of iron nanoparticles in solution[J].Journal of Crystal Growth,2005,275(3-4):548-553.
[48] 朱燕超,赵敬哲,周兵,等. 单质铁纳米颗粒的液相还原制备[J]. 高等学校化学学报,2008,29(10):2020-2024.
[49] Jeyadevan B,Shinoda K,Justin R J,et al. Polyol process for Fe-based hard (fct-FePt) and soft (FeCo) magnetic nanoparticles[J].IEEE Transactions on Magnetics,2006,24(10):3030-3035.
[50] Sun Y,Xia Y. Shape-controlled synthesis of gold and silver nanoparticles[J].Science,2002,298(5601):2176-2179.
[51] Toneguzzo P,Viau G,Acher O,et al. CoNi and FeCoNi fine particles prepared by the polyol process:Physico-chem ical characterization and dynam ic magnetic properties[J].Journal of Materials Science,2000,35(15):3767-3784.
[52] Viau G,Fiévet-Vincent F,Fiévet F. Monodisperse iron-based particles:Precipitation in liquid polyols[J].Journal of Materials Chemistry,1996,6:1047-1053.
[53] Joseyphus R J,Shinoda K,Kodama D,et al. Size controlled Fe nanoparticles through polyol process and their magnetic properties[J].Materials Chemistry and Physics,2010,123(2-3):487-493.
[54] Joseyphus R J,Kodama D,Matsumoto T,et al. Role of polyol in the synthesis of Fe particles[J].Journal of Magnetism and Magnetic Materials,2007,310(2):2393-2395.
[55] Schlesinger H I,Brown H C,Finholt A E,et al. Sodium borohydride,its hydrolysis and its use as a reducing agent and in the generation of hydrogen[J].Journal of the American Chemical Society,1953,75(1):215-219.
[56] Moshe A B,Markovich G. Synthesis of single crystal hollow silver nanoparticles in a fast reaction-diffusion process[J].Chemistry of Materials,2011,23(5):1239-1245.
[57] Glavee G N,Klabunde K J,Sorensen C M,et al. Chem istry of borohydride reduction of iron(Ⅱ) and iron(Ⅲ) ions in aqueous and nonaqueous media:Formation of nanoscale Fe,FeB,and Fe2B powders[J].Inorganic Chemistry,1995,34(1):28-35.
[58] Wonterghem J V,Mφrup S,Christion J W,et al. Formation of ultra-fine amorphous alloy particles reduction in aqueous solution[J].Nature,1986,322(14):622-623.
[59] Corrias A,Ennas G,Musinu A,et al. Amorphous transition metal-boron ultrafine particles prepared by chemical methods[J].Chemistry of Materials,1993,5(12):1722-1726.
[60] Zhang L,Manthiram A. Ambient temperature synthesis of fine metal particles in montmorillonite clay and their magnetic properties[J].Nanostructured Materials,1996,7(4):437-451.
[61] Wang C Y,Jiqng W Q,Zhou Y,et al. Synthesis of α-Fe ultrafine particles in a saturated salt solution/isopropanol/PVP m icroemulsion and their structural characterization[J].Materials Research Bulletin,2000,35(1):53-58.
[62] Schrick B,Hydutsky B W,Blough J L,et al. Delivery vehicles for zerovalent metal nanoparticles in soil and groundwater[J].Chemistry of Materials,2004,16(11):2187-2193.
Review and prospect of zerovalent iron nanoparticles synthesized by chem ical solution reduction process
FAN Mingde1,2,YUAN Peng3,HE Hongping3,CHEN Tianhu4,ZHU Jianxi3,LIU Dong3,HAO Jiao1
(1School of Environment and Resources,Inner Mongolia University,Hohhot 010021,Inner Mongolia,China;2CAS Key Laboratory of M ineralogy and Metallogeny,Guangzhou Institute of Geochemistry,Chinese Academy of Sciences,Guangzhou 510460,Guangdong,China;3Guangzhou Institute of Geochem istry,Chinese Academy of Sciences,Guangzhou 510460,Guangdong,China;4School of Resources and Environmental Engineering,Hefei University of Technology,Hefei 230009,Anhui,China)
Zerovalent iron nanoparticles (ZVINs) have attracted much attention for their excellent magnetic properties and great potential in many practical applications. This review summarizes the details of synthesizing ZVINs by chem ical reduction of iron salts in aqueous solution. ZVINs are easy to agglomerate and oxidize,which makes them difficult to prepare,study,and utilize. Agglomeration of ZVINs can be largely inhibited by stabilizing them w ith various dispersing agents and oxidation of ZVINs can be minim ized by coating them w ith different shells. In the chem ical solution reduction process,three kinds of reducing agents of hydrazine hydrate and polyols and alkali metal borohydrides w ith different reduction performance are often used to synthesize ZVINs. The advantages and disadvantages of these reducing agents for synthesizing ZVINs are discussed. Further developments of the chemical solution reduction process,to a great extent,depend on the insight into the behavior of dispersing agents and coated shells,on the industrial scale-up of the chem ical reduction process,and on the low-cost preparation of ZVINs.
chem ical solution reduction;zerovalent iron nanoparticle;hydrazine hydrate;polyol;alkali metal borohydride
O 614.81+1
A
1000–6613(2012)07–1542–08
2011-12-21;修改稿日期:2012-03-23。基金项目:教育部科学技术研究重点项目(211028)、内蒙古自治区自然科学基金(2010BS0606)、中国科学院矿物学与成矿学重点实验
室合作研究基金(KLMM20110203)、内蒙古大学高层次人才引进科研启动项目(Z20090131)及内蒙古大学国家大学生创新性实验计划项目(101012615)。
和联系人:樊明德(1979—),男,博士,讲师,主要从事环境矿物学研究。E-mail fanmd99@126.com。

