甲醇水蒸气催化重整制氢技术研究进展
闫月君,刘启斌,隋 军,金红光
(1中国科学院工程热物理研究所,北京 100190;2中国科学院研究生院,北京 100149)
进展与述评
甲醇水蒸气催化重整制氢技术研究进展
闫月君1,2,刘启斌1,隋 军1,金红光1
(1中国科学院工程热物理研究所,北京 100190;2中国科学院研究生院,北京 100149)
针对甲醇水蒸气催化重整制氢的应用背景,综述了甲醇水蒸气重整制氢的反应机理和动力学,对用于该反应的催化剂进行了总结分类,阐述了催化剂制备和反应阶段相关因素对催化剂特性的影响。在此基础上,指出甲醇水蒸气重整制氢技术研究与应用存在的问题与瓶颈,并对两种创新的研究——太阳能驱动的甲醇水蒸气重整制氢技术和甲醇重整制氢微通道反应器的开发技术进行了总结展望。
制氢;甲醇重整;催化剂;太阳能制氢;微通道反应器
氢气作为一种高效、清洁的能量载体受到国内外科学家与工业界的广泛关注。目前制氢方法可分为以下几类:化学制氢、电解水制氢和生物质制氢等。由于反应条件(温度、压力等)、制氢成本(包括反应物及后续纯化过程成本)、反应过程的安全性等因素的制约,大规模制氢的主流仍然是化学制氢,化学制氢中应用较多的是有机物催化重整技术,这其中甲醇水蒸气重整技术受到重视。其主要原因为:①作为化工生产的基本原料,甲醇的年产量大,超过2500万吨,是仅次于乙烯、氨的第三大商用化学品。尤其在中国、美国,煤基多联产系统可以产出大量的替代液体燃料甲醇;②甲醇催化重整制氢所需操作条件简单,容易实现。甲醇催化重整制氢的温度为150~300℃,压力为常压到中压,比烃类化合物要低,其转化过程简单高效、经济可行,能产生高体积比的氢气,储存、运输方便,并且后续纯化程序简单。这些优点也使得甲醇重整制氢技术广泛应用于燃料电池领域。
本文依据现有的甲醇重整制氢技术研究成果,综述了甲醇水蒸气重整制氢的反应机理和动力学,总结了催化剂的研究现状,分析了甲醇重整技术研究与应用存在的瓶颈,阐述了两种相关的创新研究趋势。
1 甲醇重整制氢的反应机理和动力学研究
1.1 甲醇重整制氢的反应机理
甲醇水蒸气重整(SRM)是一个较强的吸热反应,见式(1)。

针对该反应的机理,文献[1-7]开展了大量的研究,但仍存在一定争议,归结起来有以下三类观点[8]。
(1)平行反应机理 早期的研究认为产物中的二氧化碳和一氧化碳是由甲醇和水经不同反应过程生成的[9]。

该机理对应的反应式如式(2)~式(4)。

随着研究的深入,许多学者提出了以下不同的观点。
(2)分解变换机理 即甲醇先分解生成一氧化碳和氢气,再变换生成二氧化碳。
部分学者[10-12]认为甲醇水蒸气重整反应是甲醇裂解反应(5)和水汽变换反应(6)的总包反应。

Tesser等[13]在一个管状填充床反应器中对几种典型的反应机理进行了模拟验证,考虑了沿反应管道以及催化剂颗粒内部的传热传质,依据上述反应机理式(5)、式(6)得出了催化剂作用下管道内的反应速率表达式,该表达式与模拟结果符合较好。
但是按照这一机理,反应后CO的浓度应该大于等于式(6)代表的反应平衡得到的浓度,这与实验结果相反。Amphelett等[14]提出了催化剂表面上碳分解的理论来解释这一实验现象,但催化剂表面上生成CO会造成催化剂中毒,与事实不符。李言浩等[9]采用原位红外光谱法对铜系催化剂上的甲醇蒸气重整过程进行分析,结果有力地证实了反应过程中的二氧化碳不是在一氧化碳之后产生的。
(3)分解逆变换机理 甲醇和水首先生成二氧化碳和氢气,然后部分二氧化碳和氢气发生逆变换反应,生成一氧化碳和水。

Takahashi等[15-17]结合实验提出了式(7)~式(9)所示的反应机理:甲醇水蒸气重整反应直接生成CO2和H2O。该反应的中间产物有甲酸甲酯。

其中反应式(7)甲醇脱氢是速控步,反应过程中CO是由水汽变换反应的逆反应(RWGS)产生的,反应式见式(10)。

此理论较好的解释了实验得出的CO含量较低的现象。
Takezawa等[18]提出了式(11)~式(13)所示的反应机理,认为反应后的气体中含体积分数约为1%的CO,CO同样是由水汽变换反应的逆反应所产生。这一机理也被Breen and Ross[19]的研究所证实。

Sanjay等[20]在 Cu/ZnO/A l2O3质量分数分别为10%、5%、85%的催化剂上,分别针对式(7)~式(10)和式(11)~式(13)中所包含的基元反应进行了分析,得出了各自对应的反应速率方程,并对得到的两种结果进行了对比,通过非线性回归进行了检验。证明式(11)~式(13)所代表的机理比式(7)~式(10)代表的机理更好地与实验数据和预测结果吻合。
目前对于甲醇水蒸气重整反应机理仍没有公认的结论,但式(7) ~ 式(10)所示的反应机理得到越来越多的理论和实验证实。目前已有的甲醇水蒸气重整反应机理如图1所示[21]。图中A代表吸收氢气的活性基团,B代表吸收其他反应中间产物的活性基团。
1.2 甲醇重整制氢反应动力学
由于甲醇重整反应比较复杂,不是简单的一级反应或二级反应。许多学者对甲醇重整化学反应动力学进行了详尽的研究。由于催化剂种类和成分不同,得到的反应动力学速率方程也有所不同。代表性的研究有如下几种。
Jiang等[22]较早采用了Cu/ZnO/Al2O3催化剂,在443~533 K的温度范围内对甲醇重整反应动力学模型进行了实验研究,得出以下结论:产物中CO2的浓度对甲醇重整反应动力学没有影响,CO的浓度对它的影响可以忽略。Jiang以上述式(7)~式(10)为基础,对基元反应进行了深入的分析,提出了Langmuir–Hinselwood型动力学方程。甲醇重整反应的速率表达式见式(14)。
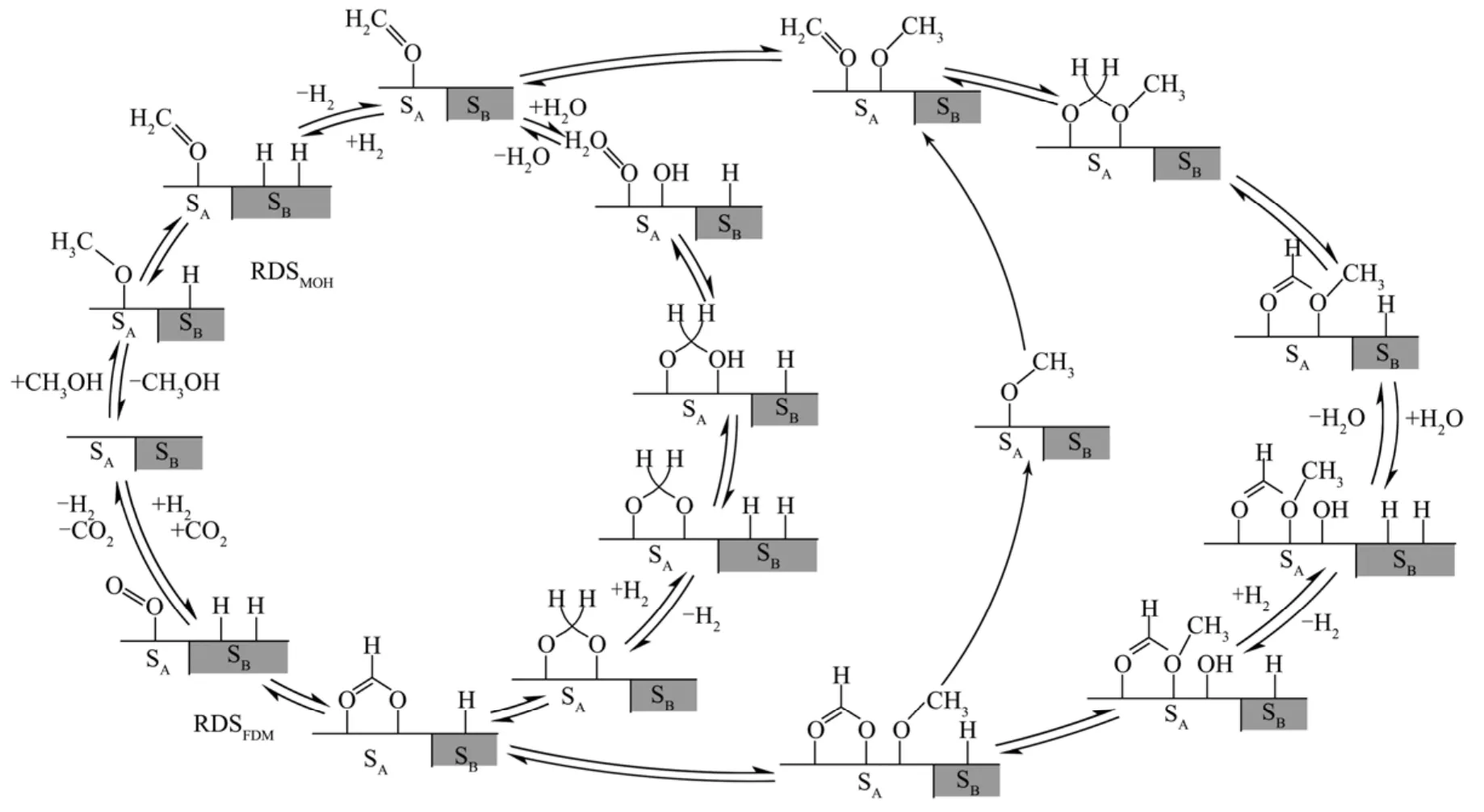
图1 甲醇水蒸气重整的催化剂循环[21]

式中,rSR、k0、R、T、PMeOH、PH2O、PH2分别代表重整反应的速率、反应速率常数、气体常数、反应温度、甲醇的分压、水的分压、氢气的分压。
Peppley等[24-25]也进行了开创性的研究,在一个固定反应床微型反应器中进行了实验,得到了不同反应条件下的实验数据,并运用非线性最小二乘回归理论对数据进行了分析,得出了甲醇重整反应、水汽变换反应和甲醇分解反应的反应速率表达式。
Agrell等[26]采用 Jiang方程进行数据拟合得到了新的指数反应速率方程,活化能为100 kJ/mol。Jin 等[27]研究认为甲醇重整反应依赖于甲醇与氢气在混合气中的分压,而与CO2与水的分压关系不大。Samms等[28]认为CO在反应产物中的量比较少,在反应动力学研究中,可不考虑CO对反应速率的影响。
2 甲醇水蒸气重整反应的催化剂
甲醇重整制氢技术的关键在于反应使用的催化剂。催化剂的活性、选择性和稳定性是表征催化剂性能的重要参数。低温高活性、高选择性和良好稳定性的催化剂一直是该领域的研究重点。对该反应催化剂的研究在学术和工业界广泛开展。
2.1 常用催化剂的分类及特征

表1 甲醇水蒸气重整制氢的催化剂分类
常用的甲醇水蒸气重整催化剂,按照活性组分可分为3类:Cu系、Cr-Zn系、贵金属(如Pd、Pt),其部分相关特征见表1。
目前,开发研究中涉及较多的是改性铜系(CuO质量分数40%~50%)催化剂。工业上大量使用的催化剂是高铜含量(CuO质量分数50%左右)的 Cu/ZnO/A l2O3催化剂,采用共沉淀法生产。典型的商用催化剂是BASF公司的Cu/ZnO/A l2O3系列,Synetix 33-5催化剂是该系列的一种,其成分如表2所示。

表2 Synetix 33-5催化剂组分
2.2 催化剂研究进展
制备阶段和反应阶段的诸多因素都会影响催化剂的性能。大量的研究揭示了催化剂特性随这些因素的变化规律。
2.2.1 催化剂制备过程中影响性能的因素
催化剂制备过程中催化剂的组分(如催化剂的元素构成、负载金属、助剂、载体的类型),制备条件(如pH值、焙烧温度、前还原温度)及制备得到的催化剂的形态(如颗粒的尺寸、形状)等因素都会影响催化剂的性能。
(1)催化剂的元素构成对催化性能的影响催化剂的元素种类和配比影响它的性能。黄冬等[29]制备了Cu∶Zn∶A l∶Zr 物质的量比为1∶1∶5.6∶0.2的Cu1Zn1A l5.6Zr0.2催化剂,其中CuO质量含量为16.87%。实验验证了低Cu催化剂的良好催化效果。李永峰等[30]在固定主活性组分Cu的质量含量为60%的基础上,以助剂Zr、Ce和A l 3种金属元素的质量含量为变量,得出CuZn(Zr、Ce)A lO类铜系催化剂在甲醇重整反应中的最佳组分含量,其中Cu、Zr、Ce、A l、Zn质量分数依次为60%、10%、0、5%和25%。余立挺等[31]研究了在不同n(Cu)∶n(Zn)的Cu/Zn/A 1/Zr催化剂上的甲醇自热重整制氢催化性能,在固定床流动反应器中于200~300 ℃进行催化剂评价。实验表明,n(Cu)∶n(Zn)=7∶3的CuZnA1Zr催化剂表现出最优的催化性能(在200 ℃时,甲醇转化率达82.6%,氢选择性为99.7%,一氧化碳体积分数仅为0.08%)。Matter等[32]研究了催化剂组成对Cu/Zn/Zr催化剂性能的影响。实验得出元素组成n(Cu)∶n(Zn):n(Zr)=4∶3∶3时,催化剂有较高的活性。潘相敏等[33]研究了不同Pt负载量的Pt/A l2O3催化剂性能的差异。结构分析表明,Pt的负载量不同,催化剂表面Pt金属分散度不同,催化剂的活性也不同。Chang等[34]研究了CuO/ZnO/CeO2/ZrO2/ A l2O3中不同的组分比例对催化剂性能的影响,并将这些规律在催化剂重整反应中进行了验证。
(2)添加助剂对催化剂催化性能的影响 催化剂中的助剂本身无活性,但是可以起到提高活性组分性能的作用。Ma等[35]研究发现在skeletal Cu中加入少量的Cr (约0.15%) 能使Cu活性增大。蔡迎春等[36]研究了掺La对CuO / ZnO / A l2O3的影响,掺La使催化剂的活性和稳定性提高,选择性有轻微的下降。李永峰等[30]以甲醇转化率和产氢率为指标研究了CeO2的加入对Cu、Zn、Al、O 4种元素组成的催化剂性能的影响。结果表明,CeO2的加入使其分别提高了6%和8%,并且改善了H2和CO2的选择性。张菊香等[37]研究了添加Mn元素对Cu/ZnO/Al2O3催化剂性能的影响。指出该催化剂中,A l和Mn之间的协同促进效应,使得催化剂表面生成高度分散的细小铜颗粒,阻止了反应过程中铜颗粒的团聚、烧结,有效地改善了催化剂的表面特性和结构。另外Mn在催化剂中部分以正三价存在,可以接受或失去电子,保证了催化剂中CuO活性中心的稳定存在,从而使催化剂的活性和稳定性得到提高。但是Mn含量存在适宜值,添加的Mn过量时,催化剂的活性反而下降。实验获得了组分为Cu、Zn、A l、Mn 的催化剂,固定Cu、Zn的摩尔分数均为45%时,催化活性最优时,Mn的摩尔分数为5%。张新荣等[38]以碳纳米管为助剂,制备得到新型高效Cu/ZnO/A l2O3催化剂,与传统Cu/ZnO/Al2O3催化剂进行了性能比较。实验证明添加适量碳纳米管可以大幅度提高产氢速率,有效降低重整产气中CO的含量。
(3)优化载体对催化剂性能的提升 载体能够增大催化剂的比表面积,使催化剂具有合适形状与粒度,从而起到提高催化剂的活性,延长催化剂使用寿命的作用。因此载体的特性能够影响催化剂的活性。常用的载体包括A l2O3、TiO2、CeO2、MnO2、ZrO2等。
Kobayashi等[39-40]发现Cu 中加入其它金属氧化物,如Mn、Zn、Si、Sn、Co、Ni 等元素的氧化物,都可使活化能下降,但选择性有所不同。彭必先等[41]的研究表明在Cu/ZnO/A l2O3催化剂中载体A l2O3有助于甲醇脱水形成(CH3)2O,从而促进反应的进行。为增强反应中的热交换,Catillon等[42]以泡沫Cu为载体,原位制备负载于泡沫Cu上的Cu/ZnO/A l2O3催化剂,验证了它的良好性能。该新型催化剂可使反应温度降低30 ℃左右,显示出3倍于商业催化剂的活性。刘娟等[43]以膨润土为载体,采用浸渍法制备了低铜含量负载型CuO/膨润土催化剂,运用XRD和TPR技术对甲醇裂解制氢反应中催化剂性能进行了研究。在铜含量为13.8%时,甲醇的转化率为84.7%,一氧化碳的选择性为92.5%。该催化剂与目前工业上使用的采用共沉淀法生产的高铜含量(CuO 质量分数约50%)Cu/ZnO/A l2O3催化剂相比,有效地避免了Cu含量高所带来的催化剂的烧结问题,对甲醇重整制氢反应有借鉴意义。
(4)制备方式对催化性能的影响 不同的制备方式使得催化剂具有不同的体相结构。制备方式的主要表征是催化剂制备过程中的焙烧温度、预还原温度等条件。Günter等[44]的研究证明了催化剂的体相结构能够影响其活性。而体相结构主要取决于制备条件,因此制备条件也成为影响催化剂性能的一个重要因素。
Matter等[32]研究了预处理阶段煅烧温度对Cu/Zn/Zr催化剂性能的影响。当催化剂组成为n(Cu)∶n(Zn)∶n(Zr)=4∶3∶3时,350 ℃煅烧后,不论是否用氢气预还原,催化剂都具有较高的活性;而 550℃煅烧后,则需用氢气还原才能获得较高的催化活性,氢气还原能够除去催化剂表面的氢氧化物和碳酸盐。张新荣等[45]也考察了焙烧温度对催化剂性能的影响。在用共沉淀法制备的Cu/ A l2O3催化剂上,运用 XRD和TPR方法研究了催化剂性能的变化,分析表明焙烧温度不同,CuO分散形式不同,催化剂中存在的物种也不同。高温焙烧时,CuO和A l2O3相互作用,形成尖晶石结构,这一结构影响催化剂的还原活化,降低了催化性能。低温焙烧则避免了这一问题。文献还得出用于实验的催化剂在500 ℃焙烧时,活性最佳。Iwasa等[46]用浸渍法制备了Pd/ZnO催化剂,研究表明提高预还原温度可以大大改善该催化剂的性能。Calverley等[47]对制备条件和催化剂活性的关系进行了数理统计,得到了具有指导意义的数据。
(5)催化剂的形态对其性能的影响 催化剂的形态如颗粒的大小、形状、晶体结构对其性能也有重要影响。
Purnamaa等[48]则用模板法制备了纳米结构CuO/ZrO2催化剂,在固定床流动反应器中用氧对催化剂进行活化后,在250~300 ℃、常压下进行甲醇水蒸气重整实验。与商业CuO/ZnO/A12O3催化剂相比,该纳米结构CuO/ZrO2催化剂的活性更高、稳定性更好(反应250 h甲醇转化率保持在50%以上,而商业催化剂的甲醇转化率250 h后由30%降至22%左右)。毕迎普等[49]研究了担载纳米尺度(1~100 nm)Pt颗粒的催化剂的性能,实验过程中催化剂表现出很强的尺度依赖特性。钠米Pt的粒径大小不但影响甲醇重整反应的活性, 同时也影响反应的选择性。Fukahori等[50]研究了纸质结构的催化剂的性能,通过相关的软件模拟了它的热力学和流体力学性质,模拟结果显示该形态的催化剂性能优于同等制备和反应条件下的丸状和粉末状催化剂。Ngoc等[51]通过X射线衍射、扫描电子显微镜检查等方法研究了A l59Cu25.5Fe12.4B3和 A l71Cu9.7Fe8.7Cr10.6(下角标表示质量分数)两种晶体衍生合金催化剂的性能。结果表明,晶体衍生催化剂独特的晶体结构,使它表现出比常用Cu/ZnO/A l2O3催化剂更高的催化活性。
2.2.2 反应条件对催化剂性能的影响
反应条件对催化剂的性能存在影响,反应条件主要包括温度、压力、水醇比、液体空速等因素。
张菊香等[37]以甲醇的转化率和产气中CO的含量来表征催化剂的活性和选择性。研究了反应条件对Mn改性Cu/ZnO/Al2O3催化剂性能的影响,得到了以下规律。
(1)反应温度的影响 实验数据表明在180~280 ℃变化范围内随着温度升高,氢气产率和甲醇的转化率明显增加,当反应温度上升到260 ℃时,甲醇基本上完全转化。重整产气中CO含量随着温度的升高也表现出与甲醇转化率相似的性质,实验条件下甲醇水蒸气重整制氢反应的适宜温度为220~240 ℃。
(2)水醇比的影响 反应温度为240 ℃,液体空速为3.0 h-1的条件下,在Cu45Zn45A l5Mn5(下角标表示质量分数)催化剂上考察了水醇比对甲醇水蒸气重整反应过程的影响。提高水量有利于甲醇的转化,有利于反应向生成氢气的方向进行,而且适当过量的水促进了水汽变换反应,使氢气产率和选择性得以提高。实验得出,随着水醇比增加,甲醇转化率和氢气产率都明显增大, 分析表明甲醇水蒸气重整反应中的水醇比控制在1.0~1.2的范围内比较适宜。
(3)液体空速的影响 液体空速对甲醇转化率、氢气产率和重整产气中CO含量都有很大影响。在Cu45Zn45A l5Mn5催化剂上研究了液体空速对甲醇水蒸气重整反应过程的影响,实验条件及反应结果如图2、图3所示。
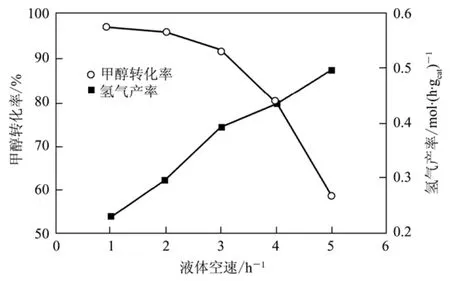
图2 进料速度对甲醇转化率和氢气产率的影响

图3 进料速度对CO含量的影响
3 甲醇重整制氢技术应用进展
虽然甲醇水蒸气重整制氢过程由于高效、易行、环保等优点而受到重视,但该过程的应用仍存在以下技术难点:①甲醇水蒸气重整制氢反应是一个强吸热过程(反应物为气态时,ΔH0298=50.7 kJ/mol),需要大量的外部供热和水蒸汽供应;②受热质传输的限制,该反应的动态响应比较慢。
针对这些问题,有以下创新性的发展趋势出现。
3.1 中低温太阳热驱动的化学反应制氢系统的提出
金红光等[52]提出了太阳能中低温热驱动的化学反应制氢方法,并研发了相关的槽式太阳能反应装置。该方法是利用聚焦型太阳能集热器(见图4)将太阳能聚集起来产生高温,推动由水和甲醇为原料的热化学反应来制取氢气。这一方案解决了甲醇水蒸气和太阳能热利用中的以下技术问题。

图4 槽式太阳热能驱动的甲醇重整制氢集热器
首先,用太阳能来提供制氢反应的所需的大量外部供热,节约了化石能源,减少环境污染。
其次,该方法也克服了太阳能利用过程中能量密度低,时空分布不恒定所造成的储能难题。
解决能流密度低的问题,主要途径是利用聚光装置(如塔式、槽式、碟式等)将太阳能转化为热能,但是太阳能集聚的温度越高,相应的成本也越高,集热效率也越低。此装置运行时的集热温度约为 150~300 ℃,为低温集热区间,节约成本,集热效率较高。
为了克服时空分布不恒定的难点,通常采用蓄热的方法进行能量收集,但是蓄热过程一般造成较多的热损失。利用太阳能驱动吸热的化学反应,将太阳能转化为反应产物的化学能成功的解决了这一问题,并且 150~300 ℃的集热温度与重整反应所需要的温度匹配[53-54],实现了能量利用中“温度对口”,减少了利用过程中的热损失。
图5为150~300℃中低温太阳能和甲醇重整结合的太阳能热化学制氢系统示意图[55]。
甲醇与水分别在换热器1内加热至过热状态,混合后进入太阳能热化学反应器。在太阳能反应器(操作温度150~300℃、常压)中,在催化剂作用下进行甲醇水蒸气重整反应。通过这一反应,将化学反应吸收的太阳热能转化为化学能,贮存到氢燃料中。
重整反应主要产物为H2与CO2,还有未反应的CH3OH、H2O及微量的CO等。混合气体进入换热器2,换热器2另一侧通冷却水用于冷凝分离产物。在冷却水的作用下,未反应的甲醇、水被冷凝,从混合气中分离,进入下一个循环被再次利用。
为了从产物中得到纯净的 H2,采用变压吸附(PSA)对H2进行分离。换热器2出来的产物气体被压缩升压。为了将产物温度降低到常温,采用换热器 3,进一步冷却混合气体。冷却后具有一定压力的混合气被引入吸附塔(吸附塔内为预定的吸附压力),混合气在预定的吸附压力下进入吸附床,进行吸附操作,PSA吸附压力一般在1.5~3.0 MPa。由此,可得到高纯度的氢气,经过进一步压缩,储存到氢气罐内,以备利用。
刘启斌等[55]在中低温热驱动的槽式太阳能化学反应制氢装置上对甲醇水蒸气重整制氢过程进行了实验研究,定义热化学效率这一参数来衡量装置运行的性能;提出了相应的热力学模型,分析了制氢过程中环境参数(如光照强度)、运行参数(反应物的入口温度、质量流量、水醇比)等对太阳能集热装置运行的影响,如图6、图7。实验结果表明,该结构的装置运行时的最高热化学效率可达50%;在太阳辐照强度为1000 W/m2,太阳光入射角为0°,集热镜场面积为600 m2,反应物的入口温度为423 K时,吸收/反应器能够获得最大氢气产率为54 kmol/ h。这些数据为高效利用中低温太阳热能,实现低能耗、低成本制氢提供了理论依据。

图5 中温太阳热能驱动的甲醇重整制氢方法示意图
3.2 适用于燃料电池的重整微通道反应器的开发研究
氢燃料电池是甲醇重整制氢反应的一个重要应用领域。由于车载燃料电池受到越来越多的重视,开发高性能、系统寿命好、紧凑型的甲醇蒸汽重整器一直是该领域的主要任务。
由于减小反应通道尺寸可以减小热质传输距离,强化传输效果,提高反应效率,甲醇重整制氢微通道反应器[60-65]的开发逐渐受到国内外学者的重视。与传统化学反应器相比,微通道反应器的表面积与体积比高,不但可以起到强化传热还可以起到强化反应的作用。
微通道反应器一般是指流体通道当量直径小于500 μm的三维结构单元,它是运用固体基质,借助特殊微加工技术生产的。在这种狭窄的流体通道大幅度缩短。微通道内的化学反应能够利用快速表面反应动力学的特性,通过微通道表面形成高活性催化剂,达到加快内部反应的目的。
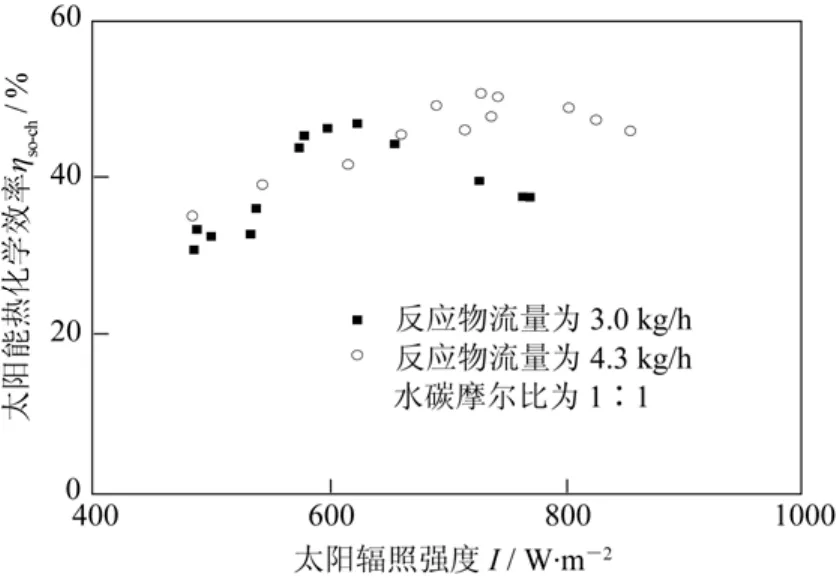
图6 太阳能热化学效率随太阳辐照及反应物流量的变化
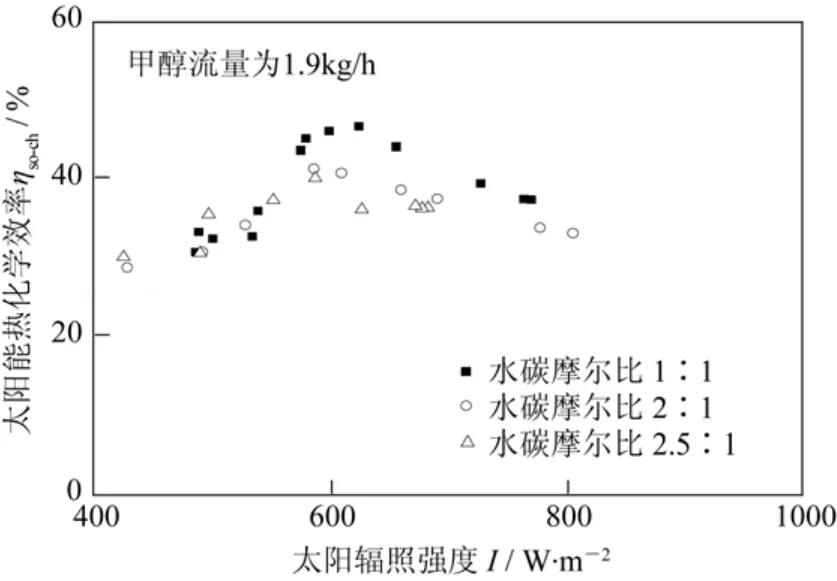
图7 太阳能热化学效率随太阳辐照及水碳摩尔比变化
尽管微通道反应器有诸多优势,但作为一种新技术,仍然有很多问题需要解决。在理论基础研究方面,许多宏观规律在微尺度下已经不再适用,微观尺度下的完整理论体系尚待建立。Rei等[66]在一个圆柱形微尺度重整反应器中,通过实验和模拟的方法,研究了热源和反应环境之间的热容对重整反应其性能的影响。Jeong等[67]对比了内部和外部加热的重整微型反应器的不同性能,以甲醇的转化率和氢气的生成率为指标,研究了内部热流率等因素对重整反应器内部反应的影响。
4 结 语
甲醇水蒸气重整制氢技术因为原料来源广泛、反应条件容易达到等突出的优点而得到广泛应用,对反应过程中的催化剂的研究表明,制备和反应过程中的多方面因素都会影响催化剂的性能。重整制氢的方式存在外部热量供应需求量大、反应动态响应慢等问题, 中低温太阳能驱动的热化学反应制氢技术的研究和对燃料电池相关的微型反应器的研究有利于解决这些难题,促进重整制氢技术的进一步推广。
[1] Agus H,Sandun F,Naveen M,et a1. Current status of hydrogen production techniques by steam reform ing of ethanol:A review[J].Energy & Fuels,2005,19:2098-2106.
[2] Agarwal V,Patel S,Pant K K. H2production by steam reform ing of methanol over Cu/ZnO/Al2O3catalysts:Transient deactivation kinetics modeling[J].Applied Catalysis A:General,2005,279(1-2):155-164.
[3] Basile A,Parmaliana A,Tosti S,et al. Hydrogen production by methanol steam reform ing carried out in membrane reactor on Cu/Zn/Mg based catalyst[J].Catalysis Today,2008,137:17–22.
[4] Gao L,Sun G,Kawi S. A study on methanol steam reforming to CO2and H2over the La2CuO4nanofiber catalyst[J] .Journal of Solid State Chemistry,2008,181:7–13.
[5] Agrell J,Birgersson H,Boutonnet M. Steam reform ing of methanol over a Cu/ZnO/Al2O3catalyst:A kinetic analysis and strategies for suppression of CO formation[J].Journal of Power Sources,2002,106:249–257.
[6] Lee J K,Ko J B,Kim D H. Methanol steam reforming over Cu/ZnO/A l2O3catalyst:Kinetics and effectiveness factor[J].Applied Catalysis A:General,2004,278:25–35.
[7] Patel S,Pant K K. Experimental study and mechanistic kinetic modeling for selective production of hydrogenviacatalytic steam reform ing of methanol[J].Chemical Engineering Science,2007,62:5425–5435.
[8] Sa S,Silva H,Brandãoa L,et al. Catalyst for methanol steam reform ing-A review[J].Applied Catalysis B:Environmental,2010,99(1-2):43-57.
[9] 李言浩,马沛生,马旭,等.铜系催化剂上甲醇蒸气转化制氢过程的原位红外研究[J].催化学报,2003,24(2):93-96.
[10] Lee J K,Ko J B,Kim D H. Methanol steam reform ing over Cu/ZnO/Al2O3catalyst:Kinetics and effectiveness factor[J].Applied Catalysis A:General,2004,278:25–35.
[11] Barton J,Pour V. Kinetics of catalytic conversion of methanol at higher pressures[J].Collection of Czechoslovak ChemicalCommunications,1980,45:3402-3407.
[12] Santacesaria E,Carra S. Kinetics of catalytic steam reform ing of methanol in a CSTR reactor [J].Applied Catalysis,1983,5 (3):345-348.
[13] Tesser R,Di Serio M,Santacesaria E. Methanol steam reforming:A comparison of different kinetics in the simulation of a packed bed reactor[J] .Chemical Engineering Journal,2009,154:69–75.
[14] Amphelett J,C,Evans,M,Mann J,et a1.Hydrogen production by the catalytic steam reform ing of methanol:Part 2:Kinetics of methanol decomposition using girdler G66B catalyst[J].Canadian Journal of Chemical Engineering,1985,63:605-611.
[15] Takahashi,K,Takezawa N,Kobayashi H.The mechanism of steam reform ing of methanol over a copper-silica[J].Applied Catalysis,1982,6 (2):363-366.
[16] Jiang C J,Trimm D L,Wainw right M S,eta1.Kinetic study of steam reform ing of methanol over copper-based catalysts[J].Applied Catalysis A:General,1993,97 (2):245-255.
[17] Purnama H,Ressler T,Jentoft R E,et a1. CO formation/selectivity for steam reforming of methanol w ith a commercial CuO/ZnO/Al2O3catalyst[J].Applied Catalysis A:General,2003,259(1):83-94.
[18] Takezawa N,Iwasa N. Steam reform ing and dehydrogenation of methanol:Difference in the catalystic function of copper and groupⅤⅢ metals[J].Catalysis Today,1997,36(1):45–56.
[19] Breen J P,Ross J R H. Methanol reform ing for fuel-cell applications:Development of zirconia-containing Cu-Zn-Al catalysts [J].Catalysis Today,1999,51(3-4):521–533.
[20] Sanjay Patel,Pant K K. Experimental study and mechanistic kinetic modeling for selective production of hydrogenviacatalytic steam reforming of methanol[J].Chemical Engineering Science,2007,62:5425-5435.
[21] Frank B,Jentoft F C,Soerijanto H,et a1. Steam reform ing of methanol over copper-containing catalysts:Influence of support material on m icrokinetics[J].Journal of Catalysis,2007,246:177–192.
[22] Jiang C J,Trimm D L,Wainw right M S,et a1. Kinetic mechanism for the reaction between methanol and water over a Cu/ZnO/Al2O3catalyst[J].Applied Catalysis A:General,1993,97:145-148.
[23] Jiang C J,Trimm D L,Wainw right M S,et a1. Kinetic study of steam reform ing of methanol over copper-based catalysts[J].Applied Catalysis A:General,1993,93:245-255.
[24] Peppley B A,Amphlett J C,Kearns L M,et a1.Methanol steam reform ing on Cu/ZnO/A l2O3,Part 2:The reaction net work. [J] .Applied Catalysis A:General,1999,179:21-29.
[25] Peppley B A,Amphlett J C,Kearns L M.,et a1.Methanol-steam reform ing on Cu/ZnO/A l2O3,Part 2:A comprehensive kinetic model[J].Applied Catalysis A:General,1999,179:31-49.
[26] Agrell J,Birgersson H,Boutonnet M. Steam reform ing of methanol over a Cu/ZnO/A l2O3catalyst:A kinetic analysis and strategies for suppression of CO formation[J].Applied Catalysis A:General,2002,106:249-257.
[27] Jin K L,Jung B K,Dong H K. Methanol steam reform ing over Cu/ZnO/Al2O3catalysts:Kinetics and effectiveness factor[J].Applied Catalysis A:General,2004,278:25-35.
[28] Samms S R,Savinell R F. Kinetics of methanol-steam reform ing in an internal reform ing fuel cell[J].Journal of Power Sources,2002,112:13-29.
[29] 黄冬,张志勇,崔群,等. 甲醇水蒸汽制氢低铜催化剂制备及其性能[J]. 化学反应工程与工艺,2008,24(1):29-34.
[30] 李永峰,董新法,林维明.甲醇水蒸气重整制氢催化剂最佳组成的确定[J].煤炭转化,2004,27(1):85-88.
[31] 余立挺,马建新.CuZnA1Zr催化剂上甲醇氧化重整制氢的研究[J].复旦大学学报:自然科学版,2003,42(3):369-375.
[32] Matter P H,Ozkan U S. Effect of pretreatment conditions on Cu/Zn/Zr based catalysts for the steam reform ing of methanol to H2[J].Journal of Catalysis,2005,234(2):463-475.
[33] 潘相敏,余瀛,严菁,等.甲醇制氢系统中燃烧催化剂的研究[J].太阳能学报,2006,27(8):841-845.
[34] Chang C C,Chang C T,Chiang S J,et al. Oxidative steam reform ing of methanol over CuO/ZnO/CeO2/ZrO2/A l2O3catalysts[J].International Journal of Hydrogen Energy,2010,35 :7675-7683.
[35] Ma L,Gong B,Tran T,et al.Cr2O3promoted skeletal Cu catalysts for the reactions of methanol steam reform ing and water gas shift [J].Cataysis Today,2000,63(2-4):499 -505.
[36] 蔡迎春,刘淑文,徐贤伦,等. La助剂对甲醇水蒸气转化制氢CuO/ZnO/A l2O3催化剂性能的影响[J].石油化工,2001 ,30(6) :429-432.
[37] 张菊香,史鹏飞,刘春涛,等.Mn改性Cu/ ZnO/ Al2O3催化剂上甲醇水蒸气重整制氢研究[J].天然气化工,2004,29(4):11-14.
[38] 张新荣,姚成漳,王路存,等.甲醇水蒸气重整制氢的高效碳纳米管改性 Cu/ZnO/A12O3催化剂[J].化学学报,2004,62(21):2191-2194.
[39] Kobayashi H,Takezawa N,M inochi C. Methanol reform ing reaction over copper-containing catalysts——The effects of anions and copper loading in the preparation of the catalysts by kneading method[J].Journal of Catalysis,1981,2(69):487-494 .
[40] Kobayashi H,Takezawa N,Minochi C. Methanol reforming reaction over copper containing mixed oxides[J].Chemistry Letters,1976,12:1347-1350.
[41] 彭必先,甘昌胜,闫天堂.甲醇水蒸汽催化重整过程的研究进展[J].化学进展,2004,16 (3):414-421.
[42] Carillon S,Louis C,Rouget R. Development of New Cu0-ZnⅡ/ A l2O3Catalyst supported on copper metallic foam for the production of hydrogen by methanol steam reform ing[J] .Topics in Catalysis,2004,30-31(1),463-467.
[43] 刘娟,陈书芳,钟丁通,等.膨润土负载型低铜含量甲醇制氢催化剂的制备及其性能[J].化学工程与装备,2011(6):12-14.
[44] Günter M M,Ressler T,Jentoft R E,et al. Redox behavior of copper oxide/zinc oxide catalysts in the steam Reform ing of methanol studied byin situX-ray diffraction and absorption spectroscopy[J].Journal of Catalysis,2001,203(1):133-149.
[45] 张新荣,史鹏飞,刘春涛.甲醇水蒸气重整制氢催化剂性能的研究[J].化工进展,2002,21(7):487-489.
[46] Iwasa N,Masuda S,Ogawa N,et al. Steam reform ing of methanol over Pd/ZnO:Effect of the formation of PdZn alloys upon the reaction[J].Applied Catalysis A:General,1995,125(1) :145-157.
[47] Calverley E M,Sm ith K J. The direct source of carbon in the enthanol formation over promoted copper catalysts[J].Studies in Surface Science and Catalysis,1992,73:111-118.
[48] Pulllamaa H,Girgsdies F,Ressler T,et a1.Activity and selectivity of a nanostructured CuO/ZrO2catalyst in the steam reforming of methanol[J].Catalysis Letters,2004,94(1-2):6l-68.
[49] 毕迎普,,吕功煊,耿东生,等. 甲醇重整反应中Pt/γ-Al2O3催化剂纳米Pt粒径与催化性能关系研究[J]. 化学学报,2005,63(9):802-808.
[50] Fukahori S,Koga H,Kitaoka T,et al. Steam reform ing behavior of methanol using paper-structured catalysts:Experimental and computational fluid dynam ic analysis[J].International Journal of Hydrogen Energy,2008(33):1661 – 1670.
[51] Phung Ngoc B,Geantet C,Aouine M,et al. Quasicrystal derived catalyst for steam reforming of methanol[J].International Journal of Hydrogen Energy,2008(33) :1000-1007.
[52] 金红光,洪慧,隋军,等.太阳能中低温热驱动的热化学反应制氢系统及方法:中国,101289164A [P].2008-10-22.
[53] Hong,H,Liu Q,Jin H. Solar hydrogen production integrating low-grade solar thermal energy and methanol steam reform ing[J].Transactions of the ASME J.Energy Resources Technology,2009,131:012601-1-012601-10.
[54] Jin H,Hong H,Sui J,et al.Fundamental study on novel m iddle-and-low temperature solar thermochem ical energy conversion.[J].Science in China Series E,2009,52(5):1135-1152.
[55] 刘启斌. 中低温太阳能热化学制氢与工程热物理某些问题的代数显式解析解[D].北京:中国科学院,2008.
[56] Liu Q,Hong H,Yuan J,et al. Experimental investigation of hydrogen production integration methanol steam reforming with middle-temperature solar thermal energy[J].Applied Energy,2009,86:155-162.
[57] Liu Q,Jin H,HongH,et al. Performance analysis of m id-and-low temperature solar receiver/reactor for hydrogen production w ith methanol steam reform ing[J].International Journal of Energy Research,2011,35:52-60.
[58] Sui J,Liu Q,Dang J,et al. Experimental investigation of solar fuels production integrating methanol decomposition and m id-and-low temperature solar thermal energy[J].International Journal of Energy Research,2011,35(1):61-67.
[59] Hong H,Liu Q,Jin H. Operational performance of the development of a 15 kW parabolic trough m id-temperature solar receiver/reactor for hydrogen production[J].Applied Energy,2012(90):137–141.
[60] 王桂芝,曲家波,魏军风,等.国外甲醇制氢微通道反应器现状[J].化学工业,2011,29(6):21-26.
[61] 穆昕,潘立卫,郏景省,等.微型平板式反应器中甲醇水蒸气重整制氢的研究[J]. 燃料化学学报,2008,36(3):338-342.
[62] Sandra S,Sousa J M,Mendes A l. Steam reforming of methanol over a CuO/ZnO/Al2O3catalyst part Ⅱ:A carbon membrane reactor[J].Chemical Engineering Science,2011,66:5523–5530.
[63] 李吉刚,孙杰,程玉龙,等.微反应器在重整制氢系统中的应用与进展[J].现代化工,2010,30(9):22-27.
[64] 刘冠颖,郭辉进,方玉诚,等.微反应器发展概况[J].当代化工,2010,39(3:)315-318.
[65] Kundu A,Park J M,Ahn J E,et al. M icro-channel reactor for steam reform ing of methanol[J].Fuel,2007,86:1331-1336.
[66] Chein R Y,Chen Y C,Chung J N. Thermal resistance effect on methanol-steam reform ing performance in m icro-scale reformers[J].International Journal of Hydrogen Energy,2011,1-13 (in press).
[67] Suh J S.,Lee M T,Greif Ralph,et al. Transport phenomena in a steam-methanol reforming microreactor with internal heating[J].International Journal of Hydrogen Energy,2009,34:314-322.
Research progress of hydrogen production w ith methanol steam reforming
YAN Yuejun1,2,LIU Qibin1,SUI Jun1,JIN Hongguang1
(1Institute of Engineering Thermophysics,Chinese Academy of Sciences,Beijing 100190,China;2Graduate School of Chinese Academy of Science,Beijing 100149,China)
Current research progress of methanol steam reform ing w ith catalysts was reviewed. Different viewpoints on reaction mechanism and kinetics were summarized. Common catalysts used in the reaction were classified. Factors that influence the performance of the catalysts in the preparation and reaction stage were discussed. Several existing problems of the reaction were pointed out and two corresponding innovative trends were presented. One was methanol steam reform ing technology driven by solar energy and the other was development of m icro channel reactor for methanol steam reforming.
hydrogen production; methanol steam reform ing; catalyst; solar hydrogen production; micro channel reactor
O 643
A
1000–6613(2012)07–1468–09
2011-12-01;修改稿日期:2012-03-22。
国家自然科学基金重点项目(50836005)及国家自然科学基金面上和青年项目(50976119, 50906086)。
闫月君(1989—),女,硕士研究生。联系人:刘启斌,博士,副研究员,主要从事太阳能热化学、太阳能热发电、分布式供能等方面的研究。E-mail qibinliu@mail.etp.ac.cn。

