长期耐力训练抑制慢性心力衰竭大鼠HIF1α-PPARγ信号途径并改善心肌脂质代谢紊乱的研究
常 颖,周义义,马延超
心力衰竭(heart failure,HF)是各种原因造成的心脏疾患(高血压、瓣膜病、心肌梗塞等)的终末阶段,主要表现为心功能进行性下降。HF时心肌能量代谢异常是导致心功能下降的重要原因,即脂肪酸(fatty acids,FA)利用减少[25],甘油三酯(triglyceride,TG)合成加速,脂质在心脏蓄积,造成心肌细胞脂性凋亡和脂毒性心脏异常[38]。低氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptorγ,PPARγ)分别是调控低氧适应[27]和脂质合成[9]的关键转录因子。最近的研究发现,两者在HF时均过度表达[11,16]。基因序列分析发现[24],HIF1可 作 用 于 PPARγ 基因的启动子序列并上调其表达,两者构成 HIF1α-PPARγ信号通路,共同参与对心肌能量代谢转换的调节。转基因与基因敲除实验证实[24],HF时 HIF1α-PPARγ信号途径持续激活是心肌脂质代谢紊乱并造成脂毒性心脏异常的重要原因。
Meta-分析[40]及临床实践[48]均显示,耐力(有氧)训练可有效改善HF患者生活质量,降低住院率与死亡率,已成为HF防治的重要康复手段之一,运动的良性效应与改善HF后心肌能量代谢紊乱密切相关[45],但具体机制未明。耐力训练能否下调HF时HIF1α过表达以及抑制HIF1α-PPARγ信号通路并改善心肌脂质代谢紊乱,至今未见报道。本实验采用结扎腹主动脉建立大鼠慢性HF模型,观察10周跑台运动后心脏HIF1α、PPARγ、3-磷酸甘油脱氢酶(glycerol-3-phosphate dehydrogenase,GPDH)、磷酸甘油酰基转移酶(glycerol phosphate acyltransferase,GPAT)基因表达、心脏脂质代谢、心功能和运动能力的变化,初步探讨运动改善HF后心肌脂质代谢异常的可能机制。
1 材料和方法
1.1 实验动物
雄性SD大鼠50只,2月龄,体质量140~150g,购自军事医学科学院实验动物中心,分笼饲养,自由进食水。
1.2 HF模型建立、分组及心功能检测
随机选取30只大鼠,参照文献[1]建立腹主动脉缩窄-压力超负荷HF模型:大鼠经0.4%戊巴比妥钠(40mg/kg)腹腔麻醉后,仰卧固定,打开腹腔,分离肾动脉上方的腹主动脉,在双肾动脉上方0.5cm处用7号(23G)针头紧贴腹主动脉平行放置,将两者一起结扎,然后抽出7号针头,即形成腹主动脉部分狭窄。建模成功后将动物随机分为 HF对照组(HF组,n=15)和 HF运动组(HF+E组,n=15)。另外20只随机分为假手术组(Sham组,n=10)和假手术运动组(Sham+E组,n=10),Sham组与Sham+E组仅分离腹主动脉,不结扎。所有大鼠休息4周后行超声
心动图检测(方法见1.4),左心室射血分数(left ventricularejection fraction,LVEF)≤45%为HF模型成功标志。随后开始正式实验,即Sham+E组和HF+E组进行10周跑台运动,Sham组和HF组则保持安静状态。
1.3 运动能力测定及运动方案制定
各组先进行3天适应性跑台运动,每天15min,速度为5m/s,坡度为0°。第4天测定大鼠最大有氧速度(maximal aerobic velocity,MAV),参照本课题组已建立的方案[4]:HF组和 HF+E组先进行15min热身(5m/min,坡度为0°)后休息3min,再进行递增负荷测试,起始负荷为7 m/min,每3min递增5m/min,坡度为0°,直到力竭,记录MAV和力竭时间(exhaustive time,ET)。Sham组和Sham+E组除起始负荷定为10m/min外,其他步骤同上。
Sham+E组HF+E组进行为期10周的跑台运动,跑速:前2周50%MAV,后8周60%MAV;时间:第1天30 min,以后每天递增10min,直到60min/天;频率:5天/周。Sham组和HF组保持安静状态。实验结束后再进行一次递增负荷力竭实验,记录MAV和ET。
1.4 心功能检测
实验结束后两天,利用HP SONOS 5500型超声仪(美国)检测各组大鼠心功能。2%戊巴比妥钠腹腔麻醉,胸部备皮,仰卧固定。探头置于胸前,探头频率12MHz,图像深度2cm。取胸骨旁左心室短轴切面进行测量,测量参数包括心率(heart rate,HR)、左心室舒张末内径(left ventricular end-diastolic diameter,LVEDD)、左心室壁厚度(left ventricular wall thickness,LVWT)、缩短分数(fractional shortening,FS)和LVEF。
1.5 心脏取材
大鼠称体重(body weight,BW)后断头处死后取心脏,用生理盐水冲洗,滤纸沾干,分离左右心室,分别称量左室重量(left ventricular weight,LVW)和 右 室 重 量 (right ventricular weight,RVW),计 算 左 室 质 量 指 数 (left ventricular mass index,LVMI)。心脏称重后迅速将组织置于液氮中并转移至-80℃冰箱冻存待测。
1.6 心肌 TG、FA含量
心肌TG、FA含量测定:取心肌60~80mg,加入组织裂解液,电动匀浆后,离心10min(3500rpm),取上清,采用酶比色法测定各组吸光度(722型紫外分光光度计,上海),以标准品为对照,测定心肌TG和FA含量。试剂盒购自南京建成生物工程研究所,严格按照操作说明进行。心肌TG和FA含量单位为:mg/g湿重。
1.7 心肌FAβ-氧化速率(FAβ-oxidation rate,FOR)测定
采用同位素法测定大鼠心肌中14C-软脂酸氧化速率。取100mg心肌剪碎后,用PBS洗涤1遍,加入到含有1.0 ml Krebs-Henseleit bicarbonate buffer和2%BSA的代谢瓶中,用100%O2冲洗2~3min,加入75μmol l-14C]-软脂酸(0.5μCi/ml,美国Sigma公司),pH=7.4。代谢瓶用用石蜡封口膜封紧,中央留一张 Whatman滤纸(用200μl苯乙胺打湿,作为孵育过程中生成的CO2的吸收剂),37℃孵育30min。注入H2SO4释放CO2并继续孵育30min以确保CO2完全被收集。将吸收14CO2的Whatman滤纸迅速转移至20ml闪烁瓶中,加入10ml闪烁液,于LS-6500多功能液体闪烁仪(美国Beckman公司)上测定放射性。以[l-14C]软脂酸转化成的14CO2量来代表FOR,单位:μmmol CO2/h/g湿重。
1.8 实时荧光定量PCR检测心肌mRNA水平
利用Trizol法提取心肌匀浆液中的总RNA,用722型紫外分光光度计(上海)测定RNA浓度并测定A260/A280比值(1.8~2.0为高纯度)。逆转录反应合成cDNA。使用日本 TOYOBO公司SYBR○RGreen PCR Master-Mix试剂盒。实时荧光定量PCR(7300型荧光定量PCR仪,美国 Applied Biosystems公司)测定 HIF1α、PPARγ、GPDH、GPAT mRNA含量,引物序列见表1。反应条件:95℃/60s,1循环;95℃/15s,60℃/15s,72℃/45s,40循环。内参照为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),以各组与Sham组的比值作为相对表达量。

表1 本研究引物序列一览表Table 1 Primer Sequence
1.9 免疫印迹(Western blotting)检测心肌蛋白水平
提取匀浆组织总蛋白后用考马斯亮蓝测定各组蛋白质含量。灌制SDS-聚丙烯酰胺凝胶(10%分离胶,5%浓缩胶)。上样后进行SDS-聚丙烯酰胺凝胶电泳,电泳和转膜成功后,室温下封闭过夜。0.01mol/L PBST洗膜后加入一抗,室温下孵育3~4h。洗膜后加入辣根过氧化酶标记的二抗,室温下孵育1~2h。洗膜并置于3,3’-二胺基联苯胺(DAB)中反应1~3min后,凝胶成像,并计算光密度值(内参为GAPDH),以各组与Sham组的比值作为相对表达量。
1.10 统计学分析
2 结果
2.1 样本量
由于Sham+E组拒跑大鼠1只,HF组和HF+E组术后各死亡1只,HF+E组在训练期间死亡3只,拒跑1只。剔除上述大鼠后,最终样本量为43只,Sham组(n=10),Sham+E组(n=9),HF组(n=14),HF+E组(n=10)。
2.2 各组大鼠运动能力(MAV和ET)的变化
与Sham组比较,Sham+E组 MAV和ET升高(均为P<0.01),HF组均降低(均为P<0.01);与 HF组比较,HF+E组 MAV和ET均升高(均为P<0.01),但仍低于Sham组(均为P<0.01,表2)。
2.3 各组大鼠心脏结构与功能的变化
与Sham组比较,Sham+E组BW和HR降低(均为P<0.05),LVW(P<0.01)、LVMI(P<0.01)、LVEDD(P<0.01)、FS(P<0.01)和LVEF(P<0.05)升高,HF组BW、LVEDD、FS和LVEF降低(均为 P<0.01),LVW、LVMI、HR和LVWT升高(均为P<0.01);与 HF组比较,HF+E组 HR 降 低(P<0.05),LVW、LVMI、LVEDD、FS和LVEF升高(均为P<0.01,表3)。
2.4 心肌脂质代谢的变化
与Sham组比较,Sham+E组心肌FA、TG含量无显著性差异(均为P>0.05),FOR升高(P<0.01),HF组FA、TG含量升高,FOR降低(均为P<0.01);与 HF组比较,HF+E组FA、TG含量降低,FOR升高(均为P<0.01,表4)。

表2 本研究各组大鼠MAV和ET比较一览表Table 2 Comparison of MAV and ET between Each Group

表3 本研究各组大鼠心脏结构与功能变化一览表Table 3 Changes of Cardiac Structure and Function between Each Group

表4 本研究各组大鼠心肌脂质代谢的变化一览表Table 4 Cardiac Lipid Metabolism between Each Group
2.5 心肌基因表达的变化
与Sham组比较,Sham+E组各基因表达无显著性变化(HIF1αmRNA:0.94±0.09vs 0.98±0.08,P>0.05;HIF1α蛋 白:0.96±0.11vs 1.01±0.09,P>0.05;PPARγmRNA:1.03±0.08vs 1.02±0.09,P>0.05;PPARγ蛋白:0.97±0.11vs 1.00±0.10,P>0.05;GPDH mRNA:1.12±0.18vs 1.01±0.10,P>0.05;GPDH蛋白:1.16±0.13vs 0.97±0.06,P>0.05;GPAT mRNA:1.23±0.18vs 1.01±0.07,P>0.05;GPAT 蛋白:1.17±0.12vs 0.98±0.11,P>0.05);HF组 HIF1αmRNA降低(0.56±0.07vs 0.98±0.08,P<0.01)而蛋白水平升高(1.59±0.12vs 1.01±0.09,P<0.01),PPARγ、GPDH、GPAT mRNA和蛋白水平均升高(PPARγmRNA:1.46±0.17vs 1.02±0.09,P<0.01;PPARγ蛋白:1.79±0.22vs 1.00±0.10,P<0.01;GPDH mRNA:1.55±0.18vs 1.01±0.10,P<0.01;GPDH 蛋 白:1.49±0.14 vs 0.97±0.06,P<0.01;GPAT mRNA:1.57±0.16vs 1.01±0.07,P<0.01;GPAT 蛋白:1.69±0.20vs 0.98±0.11,P<0.01);与 HF组比较,HF+E组 HIF1αmRNA升高(1.15±0.11vs 0.56±0.07,P<0.01)而蛋白水平降低(1.20±0.10vs 1.59±0.12,P<0.01);PPARγ、GPDH、GPAT mRNA和蛋白水平均降低(PPARγmRNA:1.23±0.15vs 1.46±0.17,P<0.01;PPARγ蛋白:1.36±0.19vs 1.79±0.22,P<0.01;GPDH mRNA:1.21±0.11 vs 1.55±0.18,P<0.01;GPDH 蛋 白:1.26±0.10vs 1.49±0.14,P<0.01;GPAT mRNA:1.35±0.19vs 1.57±0.16,P<0.01;GPAT 蛋 白:1.31±0.25vs 1.69±0.20,P<0.01;图1~图5)。

图1 心肌HIF1α基因表达(mRNA和蛋白水平)变化示意图Figure 1.Change of Myocardial Gene Expression(mRNA and protein)in HIF1α

图2 心肌PPARγ基因表达(mRNA和蛋白水平)变化示意图Figure 2.Change of Myocardial Gene Expression(mRNA and protein)in PPARγ

图3 心肌GPDH基因表达(mRNA和蛋白水平)变化示意图Figure 3.Change of Myocardial Gene Expression(mRNA and protein)in GPDH
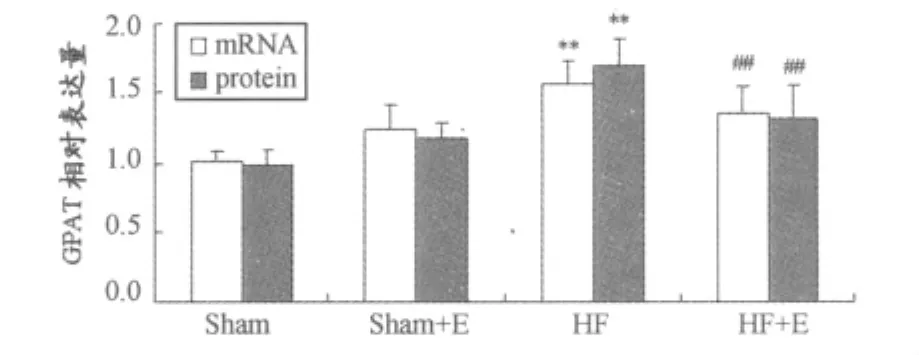
图4 心肌GPAT基因表达(mRNA和蛋白水平)变化示意图Figure 4.Change of Myocardial Gene Expression(mRNA and protein)in GPAT

图5 各蛋白表达电泳图Figure 5.Western Blotting Figure of Each Protein Expression
3 讨论
本研究发现,大鼠 HF时 HIF1α蛋白过表达,HIF1α-PPARγ信号通路持续活化,激活了下游调节脂质合成代谢的靶基因(GPDH和GPAT),心肌细胞TG沉积,FA氧化利用减少,心功能降低,运动耐力下降;而长期耐力训练则下调HIF1α表达,抑制HIF1α-PPARγ信号通路,减少心肌脂质积聚,FA氧化利用增加,心功能得到改善,运动耐力提高。
3.1 HF后心肌发生脂质代谢紊乱
FA是正常心肌的主要能量底物(占总能量供应的60%~70%)。低氧作为 HF的“初始触发事件”(initial trigger)[13],导致 HIF1α经泛素-蛋白酶体降解途径受阻,HIF1α在胞浆积聚并进入核内与组成性表达的HIF1β结合成完整的异二聚体HIF1而发挥生物学效应[27],其中,α为氧敏感的催化亚基,代表HIF1的生物活性。研究证实,HIF1是低氧反应与适应过程中的关键转录因子,调控数以百计低氧反应基因的转录[27]。最近在病理性心脏肥大模型中发现,HIF1可作用于PPARγ基因的启动子序列并上调其表达[24],而PPARγ又是调节TG合成代谢关键基因(GPDH和GPAT)的特异转录因子[9],两者在 HF时均过度 表 达[11,16]。糖 酵 解 中 间 产 物——磷 酸 二 羟 丙 酮 在GPDH作用下形成3-磷酸甘油,后者在GPAT催化下从头合成TG[14]。因此,HIF1α-PPARγ信号途径对于促进心肌组织摄取FA、加速TG合成具有重要调节作用。
本研究成功建立压力过负荷HF模型并证实了前人的结论,HF后14周心肌发生脂质代谢紊乱,即与Sham组比较,HF组 HIF1α、PPARγ、GPDH 和 GPAT 蛋白表达上调,FOR降低,心肌TG、FA堆积。FA利用减少在一定程度上降低缺血缺氧状态下心肌的耗氧量(产生相同的ATP,FA耗氧量高于葡萄糖),在HF初期,对心功能的维持起代偿作用;但在HF发展过程中,这一代偿性能量代谢方式转变可造成心肌进一步供能不足(1mmol FFA产生130ATP,1mmol葡萄糖产生38ATP)并加重HF。转基因动物实验表明,心脏PPARγ基因过表达鼠FA摄取增加、TG在心脏蓄积并出现扩张型心肌病和进行性 HF[36],提示PPARγ过度表达可造成心脏异常。临床研究发现,HF患者心肌 HIF1α[16]和 PPARγ[11]表 达 升 高 并 出 现 明 显的脂质沉积[28],而且心肌细胞间脂质沉积与收缩功能失调及心功能衰竭有关[28]。最新的研究显示,小鼠心脏HIF1α过表达可对早期急性心肌缺血起保护效应,但HIF1α长期激活却可导致小鼠在压力过负荷下更易发生心肌肥大和进行性 HF[16]。结合本研究的结果,我们认为,HF后HIF1α过表达导致HIF1α-PPARγ信号通路持续活化并诱导下游脂质合成代谢酶(GPDH和GPAT)基因表达上调,TG合成增加,心脏脂质蓄积,同时,FA利用减少,心肌能量不足。心肌能量代谢紊乱直接诱导心脏结构和功能的变化[17],因此,本研究中,HF组大鼠心脏出现结构性重塑,即“向心性心脏肥大”(与Sham组比较,HF组LVEDD下降,LVW、LVMI和LVWT升高)与收缩功能障碍(与Sham组比较,HF组FS和LVEF降低),运动耐力下降(与Sham组比较,HF组MAV和ET减少)。
3.2 长期耐力训练改善HF后心肌脂质代谢紊乱
Meta-分析[40]及临床实践[48]均证实,规律的耐力训练可有效改善HF患者心功能,提高运动能力和生活质量,降低住院率与死亡率,已成为防治HF的重要康复手段之一。诸多证据均提示,长期耐力训练的良性效应与改善HF后心肌能量代谢紊乱密切相关[45]。研究显示,一次运动可提高正常心肌对FA的吸收和利用[33];而本研究证实,长期规律训练可造成运动性心脏肥大(与Sham组比较,Sham+E组LVW、LVMI和LVEDD升高),其特点是心肌FA氧化供能增加同时伴心功能增强(与Sham组比较,Sham+E组FOR、FS和LVEF升高),这与病理性心脏肥大和HF导致心肌FA利用减少及心功能下降有明显不同[7]。Burelle等[8]发现,经过10周训练的正常大鼠在缺血-再灌注(ischemia-reperfusion,I-R)前后,FOR均显著高于对照组,因此,减轻了I-R诱导的心肌损伤,提示运动能够促进正常心肌细胞FA氧化利用并具有心脏保护效应。
有关长期运动对HF后心肌脂质代谢的影响报道较少,Chen等[10]以心梗家兔为 HF动物模型,发现4周有氧运动可显著上调心肌型脂肪酸结合蛋白(heart-type fatty acid binding protein,h-FABP)的表达水平,因此,提高了心肌对FA的利用;Kinney等[22]让自发性高血压大鼠运动16周后发现,心肌肉碱棕榈酰转移酶(carnitine palmitoyltransferase,CPT1,催化脂肪酸转运至线粒体基质进行β-氧化的限速酶)活性增加并由此认为FA利用增加。从FA代谢途径中某个酶/蛋白基因表达的角度间接推断,FA代谢的变化可能存在片面性(特别是在病理条件下、机体调节功能发生紊乱时),此法与直接测定FOR得出的结论并不完全一致,有时甚至是相悖的[8],这是由于运动对代谢酶/蛋白的表达具有“选 择 性 调 控”(selective regulation)[22],运 动方式和运动强度依赖性以及组织特异性等特点[15],而且这种网络式调控往往是错综复杂的,加之FA代谢是由其摄取、转运和氧化利用共同决定的,因此,直接测定法更为准确[15]。本研究采用直接法并发现,10周耐力训练后,与HF组比较,HF+E组心肌FA、TG含量下降,FOR升高,说明耐力训练可促进TG分解和FA氧化,逆转了HF后心肌脂质代谢紊乱的进程。而在Kinney等[22]的研究中,自发性高血压大鼠经16周随意运动(voluntary wheel ruuning)后,心肌FA利用增加,但心肌TG含量却无明显变化,可能与不同的动物模型与运动方案有关。
总之,长期运动使HF后心肌能量代谢紊乱向着正常心肌“代谢谱”转变,同时,心脏结构发生了相应的变化:与HF组比较,HF+E组左心室重量(LVW、LVMI)增加、心腔内径(LVEDD)增大,而室壁厚度(LVWT)无显著性差异,这是由于有氧运动增加了心脏的前负荷(容量负荷),心脏出现“离心性肥大”,但此时心功能增强(与HF组比较,HF+E组FS和LVEF增加),运动耐力提高(与HF组比较,HF+E组MAV和ET增加),提示这种形态学的变化是对长期运动的一种生理性适应。同时也说明,生理性心脏肥大与病理性心脏肥大在HF运动康复过程中同时存在并相互抗衡,最终,前者的良性效应逐渐逆转了后者的负面作用,表现为心脏结构由病理性肥大向生理性肥大转变(向心性肥大转变为离心性肥大),这一结论在Garciarena等[12]的研究中也得到进一步证实,提示 HF患者在运动康复疗法过程中,即使在原有心脏病理肥大(如高血压造成的心脏向心性肥大)的基础上出现离心性肥大,其坚持有氧运动的收益可能远远大于风险,但这一观点尚未在人体试验中得到证实。结合本研究的结果,我们认为,长期耐力训练改善HF后脂质代谢紊乱是心脏结构性重塑发生逆转、心功能和运动耐力得以提高的重要原因。
3.3 长期耐力训练改善HF后心肌脂质代谢紊乱的机制探讨
长期耐力训练对心脏保护作用的机制未明,由于HF时HIF1α-PPARγ信号途径激活是心肌能量代谢紊乱和心功能下降的重要原因[24],因此我们假设,长期耐力训练改善心肌脂质代谢异常可能与抑制HIF1α-PPARγ信号途径有关联。关于运动对HIF1α、PPARγ基因表达影响的研究主 要集 中 在 心 外 组 织 (骨 骼 肌[6,20,26,37]、白 色 脂 肪 组 织[34]、白细胞[31,41]等),本研究对 HF大鼠长期耐力训练后心肌HIF1α和PPARγ表达的变化进行了初步探讨,并证实了上述假设:HIF1α、PPARγ、GPDH和 GPAT 蛋白水平均低于HF组,说明长期耐力训练下调心脏HIF1α过表达,抑制了HIF1α-PPARγ信号途径持续激活对TG合成的促进作用并减少心脏脂质沉积。
虽然一次急性运动可造成局部组织缺氧并可暂时性上调 HIF1α表达[21,26],但长期耐力训练则可下调 HF大鼠心肌HIF1α高表达,其原因与运动通过增加血管内血流剪切应力并诱导血管内皮细胞释放一氧化氮(nitric oxide,NO)有关[47],NO具有血管舒张效应并可增加心肌收缩力[47];此外,运动还可增加血管内皮生长因子(vascular endothelial growth factor,VEGF)表达并促进新生血管生成[30],上调过氧化物酶体增殖物受体γ共激活因子-l(peroxisome proliferator-activated receptorγcoactivator l,PGC-1)表达从而促进线粒体生物合成[2]。因此,心脏对一次急性运动应激的反应主要体现在基因表达水平的变化,但不能产生结构改变和功能性适应,而长期耐力训练是多次急性运动积累的效果,通过调节血管张力,降低外周阻力,改善冠脉灌注,提高有氧代谢能力等作用最终改善了心肌细胞缺氧状态[46],HIF1α随之降低。由于HF时氧化应激造成的活性氧(reactive oxygen species,ROS)增多可上调HIF1α[35],因此,长期运动通过下调 ROS水平[43]间接参与了HF+E组 HIF1α表达下降。而且在本研究中,HIF1α下调的同时,大鼠运动耐力提高,说明长期耐力训练诱导的HIF1α下调提高了机体抵抗运动应激的能力,这一结果在Lundby等[26]的研究中得到佐证,即受试者一次急性运动后骨骼肌HIF1α显著上调,进行4周训练后再进行一次相同强度的急性运动,HIF1α表达量则较4周前显著下降。本研究中,HF组和HF+E组HIF 1αmRNA与蛋白水平并不同步,这可能是由于HIF1α主要受翻译后水平调控所致,也可能与HIF1α天然反义转录物(natural antisense transcripts of HIF1α,αHIF)的表达有关[44]。研究证实[32],aHIF是HIF1的靶基因,HIF1α蛋白过量表达时aHIF产生增多,aHIF通过降解HIF1αmRNA参与对HIF1的负反馈调节。
运动对HF后心肌PPARγ表达的影响未见报道。运动对心外组织PPARγ的表达结论不一,例如,一次运动和长期运动均可上调正常和高血压大鼠骨骼肌PPARγ水平[6,20,37];14周中等强度跑台运动通过降低去势大鼠腰椎骨髓细胞PPARγ表达抑制骨髓脂质沉积[3];4周低强度运动可上调健康男性外周血单核细胞PPARγ表达并促进胆固醇逆向转运[41];运动通过上调白色脂肪组织PPARγ表达而抑制脂肪前体细胞向脂肪细胞分化[34]。而本研究则发现,长期运动下调HF后心肌PPARγ表达水平并减轻脂质过度沉积。心外组织和心肌组织PPARγ对运动适应的差异性表达说明,运动对PPARγ表达的影响具有组织特异性,而且不同组织即使存在相同的信号通路,其作用方式也可能不同。例如,Sakurai等[34]的研究证实,白色脂肪组织存在HIF1α抑制PPARγ表达的信号途径,运动则通过提高HIF1α蛋白水平而下调PPARγ表达。最近一项关于病理性心肌脂质沉积的机制研究证实[28],固醇调节原件结合蛋白(sterol-regulatory element binding protein,SREBP)1c也是PPARγ的转录因子并可上调其表达,提示运动下调PPARγ尚存在不依赖于HIF1α的信号途径,但此信号途径在长期耐力训练后的变化规律及具体机制尚待进一步研究。
本研究还发现,Sham+E组各基因表达水平与Sham组无显著性差异,但FOR增加,提示运动促进正常心肌对FA利用与 HIF1α-PPARγ信号途径无关,同时也说明,运动诱导的基因表达不仅具有组织特异性,还与该组织的生理病理状态有关。其机制在于,长期运动适应后,心脏安静时冠脉灌注增加,运动诱导心脏生理性肥大的同时并不伴有心肌缺血缺氧,因此,不能诱导 HIF1α表达上调[23],而病理性心脏肥大始终伴随心肌缺氧,HIF1α激活介导的低氧信号转导途径贯穿始终[23]。运动性心脏肥大伴心肌FA氧化利用增加可能与儿茶酚胺升高造成外周组织脂解作用增强[42],活化 AMP激活的蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)促进 FA 摄 取[19],过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptorα,PPARα)表达上调增加FA代谢酶的活性和/或表达量[5]等因素有关。
最后需要强调的是,HF后心肌能量代谢的变化以及运动干预的效果与机制主要来自于实验动物模型,是否可应用于人类疾病仍处于探索阶段,其中诸多问题尚未解决。首先,人类疾病与动物疾病模型的生物学基础存在差异,如HF时有关心脏能量代谢的某些基因的表达和调控在人类和动物存在显著差异[18],而且临床上HF患者心肌能量代谢的特点是FA利用增加而葡萄糖利用减少[39],与动物模型恰好相反;其次,人类疾病还受到共存疾病(comorbidity)或并发症(complication)以及环境因素(饮食、药物、体力活动等)的影响。因此,本研究所探讨的长期耐力训练对HF大鼠脂质代谢的影响及其机制只适用于此动物模型,而从动物研究应用到人类疾病的治疗则需要一个漫长的过程,今后的研究应以HF患者为研究对象,结合新的微创甚至无创检测技术(如心脏磁共振、PET-CT等[29]),继续探索耐力运动对心肌能量代谢的影响与机理,为HF患者运动康复提供最直接的研究证据。
4 结论
1.HF时HIF1α-PPARγ信号通路持续激活,其下游调节脂质合成代谢的靶基因如GPDH和GPAT表达上调,导致心肌细胞脂质沉积,同时,伴FA氧化利用减少,心功能和运动耐力下降;
2.长期耐力运动促进正常心肌对FA氧化利用,其机制与HIF1α-PPARγ信号途径无关;
3.长期耐力训练抑制慢性 HF大鼠心脏 HIF1α-PPARγ信号通路并下调其下游靶基因的表达,促进FA氧化利用,减少心肌脂质沉积,从而改善心功能并提高运动耐力。
[1]侯剑辉,叶博然,刘钰君,等.大鼠慢性充血性心力衰竭模型的建立与评价[J].现代医院,2012,12(4):26-28.
[2]刘涛,张敏,徐栋,等.运动促进慢性心衰大鼠心肌线粒体生物合成与心肌重构[J].中国运动医学杂志,2011,30(3):250-256.
[3]卜淑敏,王颖捷,张雪琳,等.中等强度跑台运动对去卵巢大鼠腰椎甘油三酯水平和PPARγ蛋白表达的影响[J].中国运动医学杂志,2011,30(4):350-353.
[4]周义义,李晓霞.运动对慢性心力衰竭大鼠心脏交感神经功能的调节——去甲肾上腺素转运蛋白的作用[J].体育科学,2012,32(3):67-73.
[5]ABEL E D,DOENST T.Mitochondrial adaptations to physiological vs.pathological cardiac hypertrophy[J].Cardiovasc Res,2011,90(2):234-242.
[6]BENTON C R,KOONEN D P,CALLES-ESCANDON J,et al.Differential effects of contraction and PPAR agonists on the expression of fatty acid transporters in rat skeletal muscle[J].J Physiol,2006,573(Pt 1):199-210.
[7]BERNARDO B C,WEEKS K L,PRETORIUS L,et al.Molecular distinction between physiological and pathological cardiac hypertrophy:experimental findings and therapeutic strategies[J].Pharmacol Ther,2010,128(1):191-227.
[8]BURELLE Y,WAMBOLT RB,GRIST M,et al.Regular exercise is associated with a protective metabolic phenotype in the rat heart[J].Am J Physiol Heart Circ Physiol,2004,287(3):H1055-1063.
[9]CAO J,LI JL,LI D,et al.Molecular identification of microsomal acyl-CoA:glycerol-3-phosphate acyltransferase,a key enzyme in de novo triacylglycerol synthesis[J].Proc Natl Acad Sci U S A,2006,103(52):19695-19700.
[10]CHEN C Y,HSU H C,LEE B C,et al.Exercise training improves cardiac function in infarcted rabbits:involvement of au-tophagic function and fatty acid utilization[J].Eur J Heart Fail,2010,12(4):323-330.
[11]DJOUADI F,LECARPENTIER Y,HEBERT J L,et al.A potential link between peroxisome proliferator-activated receptor signalling and the pathogenesis of arrhythmogenic right ventricular cardiomyopathy[J].Cardiovasc Res,2009,84(1):83-90.
[12]GARCIARENA C D,PINILLA O A,NOLLY M B,et al.Endurance training in the spontaneously hypertensive rat:conversion of pathological into physiological cardiac hypertrophy[J].Hypertension,2009,53(4):708-714.
[13]GIORDANO F J.Oxygen,oxidative stress,hypoxia,and heart failure[J].J Clin Invest,2005,115(3):500-508.
[14]GONZALEZ-BARO M R,LEWIN T M,Coleman R A.Regulation of Triglyceride Metabolism.II.Function of mitochondrial GPAT1in the regulation of triacylglycerol biosynthesis and insulin action[J].Am J Physiol Gastrointest Liver Physiol,2007,292(5):G1195-1199.
[15]HAFSTAD A D,BOARDMAN N T,LUND J,et al.High intensity interval training alters substrate utilization and reduces oxygen consumption in the heart[J].J Appl Physiol,2011,111(5):1235-1241.
[16]HOLSCHER M,SCHAFER K,KRULL S,et al.Unfavourable consequences of chronic cardiac HIF-1alpha stabilization[J].Cardiovasc Res,2012,94(1):77-86.
[17]INGWALL J S.Energy metabolism in heart failure and remodelling[J].Cardiovasc Res,2009,81(3):412-419.
[18]IOZZO P.Metabolic toxicity of the heart:insights from molecular imaging[J].Nutr Metab Cardiovasc Dis,2010,20(3):147-156.
[19]JEPPESEN J,ALBERS P H,ROSE A J,et al.Contraction-induced skeletal muscle FAT/CD36trafficking and FA uptake is AMPK independent[J].J Lipid Res,2011,52(4):699-711.
[20]KAWAMURA T,YOSHIDA K,SUGAWARA A,et al.Regulation of skeletal muscle peroxisome proliferator-activated receptor gamma expression by exercise and angiotensin-converting enzyme inhibition in fructose-fed hypertensive rats[J].Hypertens Res,2004,27(1):61-70.
[21]KIM C H,CHO Y S,CHUN Y S,et al.Early expression of myocardial HIF-1alpha in response to mechanical stresses:regulation by stretch-activated channels and the phosphatidylinositol 3-kinase signaling pathway[J].Circ Res,2002,90(2):E25-33.
[22]KINNEY LTL,RODNICK K J.Effects of aerobic exercise on energy metabolism in the hypertensive rat heart[J].Phys T-her,2001,81(4):1006-1017.
[23]KONG S W,BODYAK N,YUE P,et al.Genetic expression profiles during physiological and pathological cardiac hypertrophy and heart failure in rats[J].Physiol Genomics,2005,21(1):34-42.
[24]KRISHNAN J,SUTER M,WINDAK R,et al.Activation of a HIF1alpha-PPARgamma axis underlies the integration of glycolytic and lipid anabolic pathways in pathologic cardiac hypertrophy[J].Cell Metab,2009,9(6):512-524.
[25]LIONETTI V,STANLEY W C,RECCHIA F A.Modulating fatty acid oxidation in heart failure[J].Cardiovasc Res,2011,90(2):202-209.
[26]LUNDBY C,GASSMANN M,PILEGAARD H.Regular endurance training reduces the exercise induced HIF-1alpha and HIF-2alpha mRNA expression in human skeletal muscle in normoxic conditions[J].Eur J Appl Physiol,2006,96(4):363-369.
[27]MAJMUNDAR AJ,WONG WJ,SIMON MC.Hypoxia-inducible factors and the response to hypoxic stress[J].Mol Cell,2010,40(2):294-309.
[28]MARFELLA R,DI FC,PORTOGHESE M,et al.Myocardial lipid accumulation in patients with pressure-overloaded heart and metabolic syndrome[J].J Lipid Res,2009,50(11):2314-2323.
[29]MITOFF PR,BEAUCHESNE L,DICK AJ,et al.Imaging the failing right ventricle[J].Curr Opin Cardiol,2012,27(2):148-153.
[30]MIYACHI M,YAZAWA H,FURUKAWA M,et al.Exercise training alters left ventricular geometry and attenuates heart failure in dahl salt-sensitive hypertensive rats[J].Hypertension,2009,53(4):701-707.
[31]MOUNIER R,PIALOUX V,CAYRE A,et al.Leukocyte's Hif-1expression and training-induced erythropoietic response in swimmers[J].Med Sci Sports Exe,2006,38(8):1410-1417.
[32]ROSSIGNOL F,DE LAPLANCHE E,MOUNIER R,et al.Natural antisense transcripts of HIF-1alpha are conserved in rodents[J].Gene,2004,339(15):121-130.
[33]ROTTMAN JN,BRACY D,MALABANAN C,et al.Contrasting effects of exercise and NOS inhibition on tissue-specific fatty acid and glucose uptake in mice[J].Am J Physiol Endocrinol Metab,2002,283(1):E116-123.
[34]SAKURAI T,ENDO S,HATANO D,et al.Effects of exercise training on adipogenesis of stromal-vascular fraction cells in rat epididymal white adipose tissue[J].Acta Physiol(Oxf),2010,200(4):325-338.
[35]SEMENZA GL.Oxygen homeostasis[J].Wiley Interdiscip Rev Syst Biol Med,2010,2(3):336-361.
[36]SON NH,PARK TS,YAMASHITA H,et al.Cardiomyocyte expression of PPARgamma leads to cardiac dysfunction in mice[J].J Clin Invest,2007,117(10):2791-2801.
[37]SPANGENBURG EE,BROWN DA,JOHNSON MS,et al.Al-terations in peroxisome proliferator-activated receptor mRNA expression in skeletal muscle after acute and repeated bouts of exercise[J].Mol Cell Biochem,2009,332(1-2):225-231.
[38]STANLEY WC,RECCHIA FA.Lipotoxicity and the development of heart failure:moving from mouse to man[J].Cell Metab,2010,12(6):555-556.
[39]TAYLOR M,WALLHAUS TR,DEGRADO TR,et al.An evaluation of myocardial fatty acid and glucose uptake using PET with[18F]fluoro-6-thia-heptadecanoic acid and[18F]FDG in patients with congestive heart failure[J].J Nucl Med,2001,42(1):55-62.
[40]TAYLOR RS,DAVIES EJ,DALAL HM,et al.Effects of exercise training for heart failure with preserved ejection fraction:A systematic review and meta-analysis of comparative studies[J].Int J Cardiol,2012,162(1):6-13.
[41]THOMAS AW,DAVIES NA,MOIR H,et al.Exercise-associated generation of PPARgamma ligands activates PPARgamma signaling events and upregulates genes related to lipid metabolism[J].J Appl Physiol,2012,112(5):806-815.
[42]THOMPSON D,KARPE F,LAFONTAN M,et al.Physical activity and exercise in the regulation of human adipose tissue physiology[J].Physiol Rev,2012,92(1):157-191.
[43]TSAROUHAS K,TSITSIMPIKOU C,HALIASSOS A,et al.Study of insulin resistance,TNF-alpha,total antioxidant capacity and lipid profile in patients with chronic heart failure under exercise[J].In Vivo,2011,25(6):1031-1037.
[44]UCHIDA T,ROSSIGNOL F,MATTHAY MA,et al.Prolonged hypoxia differentially regulates hypoxia-inducible factor(HIF)-1alpha and HIF-2alpha expression in lung epithelial cells:implication of natural antisense HIF-1alpha[J].J Biol Chem,2004,279(15):14871-14878.
[45]VENTURA-CLAPIER R.Exercise training,energy metabolism,and heart failure[J].Appl Physiol Nutr Metab,2009,34(3):336-339.
[46]VENTURA-CLAPIER R,METTAUER B,BIGARD X.Beneficial effects of endurance training on cardiac and skeletal muscle energy metabolism in heart failure[J].Cardiovasc Res,2007,73(1):10-18.
[47]WANG J,YI GH,KNECHT M,et al.Physical training alters the pathogenesis of pacing-induced heart failure through endothelium-mediated mechanisms in awake dogs[J].Circulation,1997,96(8):2683-2692.
[48]WISE FM,PATRICK JM.Cardiac rehabilitation outcomes in women with chronic heart failure:mood,fitness,and exercise safety[J].J Cardiopulm Rehabil Prev,2012,32(2):78-84.

