长期递增负荷运动对调控骨髓B细胞发育分化的E2A、EBF、PAX5的影响
耿青青
运动免疫学研究已证实,运动员长期从事大强度的运动训练,会发生强烈的运动性免疫失衡现象。现有研究多从外周免疫细胞的失衡、失调入手探讨机理,本研究结合课题组前期研究成果[1-6],推断虽然这些现象出现在血液,但根源可能在淋巴细胞的发生源头骨髓,即运动应激通过影响骨髓造血微环境中各种调控因子进而影响了淋巴细胞的发育异常。
B细胞发育过程中有许多特征性的基因表达,这些特定基因的表达是由众多的转录因子调节的。转录因子启动不同谱系特异基因的表达,保证发育分化过程中向某一谱系分化时失去向其他谱系分化的潜能。影响B细胞早期发育的转录因子主要调节着2个关卡,即共同淋巴样祖细胞向B细胞谱系发育和祖B细胞向前B细胞发育。目前已知PU.1和Ikaros在第一个关卡起作用,而E2A、EBF和BSAP/PAX5可能在第二个关卡起作用,这些转录因子的等级性调节可能是获取B细胞前体B系特异性的关键。
研究者前期实验研究证明,6周递增运动过程中,机体根据运动需要,通过改变凋亡率,进而改变早期发育中B细胞的数量百分比,以求尽可能维持免疫稳态;“运动性免疫抑制”最初是针对T细胞发育分化调节而言的,经过前期工作总结后,研究者认为,针对B细胞、T细胞等免疫细胞的发育分化调节而言,称为“运动性免疫失衡”会更准确、全面[1-6]。那么,在6周递增运动过程中,对于早期B细胞发育起着关键调控作用的因子,如转录因子,细胞因子和趋化因子等,在6周递增负荷运动中产生了怎样的适应性及应答性变化?它们之间以及与Pro B细胞、Pre B细胞又有着怎样的等级性调节?
基于此,在前期长期递增负荷对早期B细胞在骨髓中发育影响的基础上,根据B细胞发育第二关卡理论,分析6周递增负荷运动对转录因子的影响及其与Pro B细胞、Pre B细胞的相关关系,探讨长期运动对骨髓早期B细胞发育的调节机制。
1 材料与方法
1.1 实验对象
雄性SD大鼠128只,8周龄,体重130~150g[许可证号:SCXK(粤)2008-0020;NO:0043379,粤 监 证 字F2008A002]。随机分为实验组和对照组(表1),实验组(96只)进行6周递增强度训练;绝对安静组(对照组,32只)正常喂养,不进行运动干预,分别于第0、2、4、6周末采样,用于判别大鼠生长对测试指标的影响(实验组实际参与运动的大鼠是106只,以备补充建模中意外死亡大鼠,本次建模因意外死亡大鼠2只)。

表1 本研究实验对象分组情况一览表 (只)Table 1 Grouping of Animals
1.2 运动模型设计、取材时间及建模测试指标
参照Bedfor d(1979)根据大鼠体重/耗氧量回归方程所建立的递增负荷(跑台坡度),课题组前期研究建立了运动性免疫失衡发生、发展的动物模型[7-12,15,16]:模拟 运动训练安排,长时间、高密度、大强度且负荷递增,进行持续6周的递增负荷运动,每次运动30min;适应性运动训练1周后,起始负荷定为20m/min,每周递增负荷5m/min,至第6周达40m/min,到达大鼠最大强度负荷(表2)。
取材时间:第0周末,即运动训练前,完成1个定量运动负荷(10m/min),分别在运动前安静状态、运动后即刻和运动后3h取材。第2、4、6周末训练完成后,休息1天,次日(大鼠运动后恢复48h)完成同周相同定量运动负荷,分别在运动前安静状态、运动后即刻和运动后3h取材。对照组正常喂养,不运动,分别于第0、2、4、6周末处死,测试相同指标,用于判别大鼠生长对这些指标的影响。
无菌取得大鼠(股骨)骨髓和股骨(含骨髓)。大鼠骨髓直接用锡纸包好放在液氮中,用于mRNA和蛋白表达的研究;股骨则放入10%中性甲醛固定液内固定,用于股骨脱钙石蜡免疫组织化学检测。
前期课题组成员已分别测试血液、T细胞活性、巨噬细胞吞噬能力、神经递质等指标,并监测大鼠体重、皮毛亮度等指标,通过比较对照组与训练组的差异,验证大鼠6周递增负荷跑台运动性免疫失衡发生、发展的运动模型的建 立 是 成 功 的[7-12,15,16]。

表2 本研究运动训练负荷方案一览表Table 2 Protocol of Training in Rats (m/min)
1.3 要试剂、仪器及实验步骤
1.3.1 股骨脱钙免疫组织化学技术
1)室温固定24h后,股骨放入EDTANa2液中脱钙,换液每3天1次,约2月后,针刺无阻即为脱钙完成;2)取股骨骨干和股骨头的结合部做成蜡块,股骨组织做4μm连续切片;3)常规脱腊至水;4)高压抗原修复,PBS洗;5)3%H2O2室温孵育15min,PBS洗;6)加 PAX5抗体(Sata cruz,sc-1974,1∶10稀释),4℃过夜,PBS洗;7)滴加二抗,37℃孵育20min,PBS洗;8)DAB显色剂镜下观察显色;9)苏木素复染核;10)脱水,透明,封片,其中,用PBS代替一抗作为空白对照。
1.3.2 Real time RT-PCR
采 用 SYBR Green I检 测 法。RNAiso Plus、SYBR○RPremix Ex TaqTMⅡ、PrimeScriptTMRT reagent Kit均购自宝生物工程(大连)有限公司(产品货号分别是:D9108B、DRR081A、DRR037A)。
具体步骤:引物设计、样本采集、总RNA的抽提(RNA的沉淀、清洗、溶解、贮存等)、总RNA样品浓度分析及纯度测定、反转录反应、Real Time PCR反应、样品目的基因的相对表达量的获取。
引物由TAKARA宝生物工程(大连)有限公司合成(表3),用无菌去离子水稀释为10μM浓度的工作液,分装贮存于-20℃备用。
1.3.3 Western Blot
E2A购自 Abcam(货号:ab69999,1∶800稀释)、EBF购自Sata cruz(货号:sc-137065,1∶400稀释)。主要步骤:SDS-PAGE电泳、转膜、膜的封闭、抗体杂交、显色(ECM)、结果检测。

表3 本研究E2A、EBF、PAX5的引物情况一览表Table 3 Gene-specific Primers of E2A,EBF,PAX5
1.4 数据处理
2 研究结果
2.1 6周递增负荷运动中骨髓转录因子E2A、EBF(WB)及PAX5(IHC)蛋白表达的变化
本研究6周递增负荷运动中各组骨髓转录因子E2A、EBF(WB)蛋白表达见图1,各组骨髓PAX5蛋白表达见图2。对照组(绝对安静组)各指标各周之间没有显著性差异(P>0.05),表明6周生长对这些指标没有显著影响,下同。6周递增负荷运动过程中,E2A、EBF及PAX5蛋白表达的变化特征(表4~表6):第0周,各组间E2A、EBF、PAX5蛋白表达均无显著性差异(P>0.05)。第2周,与A组相比,J组E2A、EBF蛋白表达均显著性下降(P<0.05),3H组E2A、EBF蛋白表达组不具显著性差异(P>0.05),但PAX5呈显著性上升(P<0.05);与J组相比,3H组E2A、EBF均不具显著性差异(P>0.05),PAX5显著性上升(P<0.05)。第4周,与A组相比,EBF蛋白表达在J组有非常显著性下降(P<0.01),3H组有显著性上升(P<0.05),而 E2A、PAX5在J组、3H 组均无显著性差异(P>0.05);与J组相比,3H 组EBF、PAX5均有显著性上升(P<0.05)。第6周,与A组相比,J组E2A、EBF蛋白表达均不具显著性差异(P>0.05),PAX5在3H组有显著性上升(P<0.05);与J组相比,3H 组E2A、PAX5均呈显著性上升(P<0.05)。
2.2 6周递增负荷运动过程中E2A、EBF及PAX5基因表达的变化
表7~表9显示:第0周,各组间E2A、PAX5基因表达均无显著性差异(P>0.05);与A组相比,J组EBF基因表达呈现显著性下降(P<0.05),3H有上升趋势,但无显著性差异(P>0.05)。第2周,与A组相比,J组E2A、EBF、PAX5基因表达均显著性下降(P<0.05),3H 组仅EBF具显著性低下(P<0.05);与J相比,3H 组 E2A、PAX5均具显著性上升(P<0.05),EBF不具显著性差异(P>0.05)。第4周,与 A组相比,EBF、PAX5基因表达在J组有显著性下降(P<0.05),3H组无显著性变化(P>0.05),而 E2A 在J组、3H组均无显著性差异(P>0.05);与J组相比,3H 组PAX5有显著性上升(P<0.05)。第6周,与A组相比,J组E2A、EBF、PAX5基因表达均显著性下降(P<0.05),3H 组E2A、EBF均无显著性变化(P>0.05),仅PAX5有显著性下降(P<0.05);与J组相比,3H 组E2A、EBF、PAX5均无显著性差异(P>0.05)。注:*、**表示同周与AC组比较时P<0.05、P<0.01;﹟、﹟﹟表示同周A组比较时P<0.05、P<0.01;▲、▲▲表示同周与J组比较时P<0.05、P<0.01,下同。

图1 本研究6周各组大鼠骨髓转录因子EBF、E2A蛋白表达示意图Figure 1.Protein Expression of E2A,EBF(WB)in Bone Marrow for Six Weeks

图2 本研究6周各组大鼠骨髓PAX5蛋白表达示意图(石蜡组化切片,×400)Figure 2.Protein Expression of PAX5(IHC)in Bone Marrow for Six Weeks

表4 本研究骨髓转录因子E2A蛋白表达一览表(Western Blot)Table 4 Changes of E2Ain Bone Marrow(Western Blot)

表5 本研究骨髓转录因子EBF蛋白表达一览表(Western Blot)Table 5 Changes of EBF in Bone Marrow(Western Blot)

表6 本研究骨髓转录因子PAX5蛋白表达一览表(免疫组化IOD值,×104)Table 6 Changes of IOD of PAX5in Bone Marrow(IHC,×104)

表7 本研究骨髓转录因子E2AmRNA表达一览表Table 7 Changes of E2AmRNA in Bone Marrow

表8 本研究骨髓转录因子EBF mRNA表达一览表Table 8 Changes of EBF mRNA in Bone Marrow
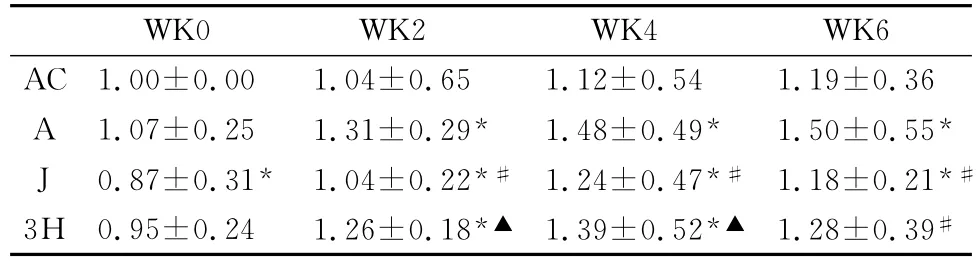
表9 本研究骨髓转录因子PAX5mRNA表达一览表Table 9 Changes of PAX5mRNA in Bone Marrow
2.3 转录因子蛋白表达与骨髓B系发育各阶段细胞群的相关性
表10显示,E2A蛋白表达与Pro B、Pre B的相关性分别为0.76、0.67;EBF蛋白表达与 Pro B、Pre B的相关性分别为0.82、0.89;PAX5蛋白表达与Pro B、Pre B的相关性分别为0.81、0.87。

表10 本研究E2A、EBF、PAX5蛋白表达与Pro B、Pre B细胞群的多元线性回归分析一览表Table10 E2A,EBF,PAX5Protein Expression in Multiple Linear Regression Analysis with Pro B,Pre B populations(r)
2.4 转录因子基因表达与骨髓B系发育各阶段细胞群的相关性
表11显示,EBFmRNA与Pro B、Pre B的相关性分别为0.89、0.92;E2AmRNA与Pro B、Pre B的相关性分别为0.65、0.56;PAX5mRNA 与 Pro B、Pre B的相关性分别为0.76、0.84。

表11 本研究E2A、EBF、PAX5基因表达与Pro B、Pre B细胞群的多元线性回归分析一览表Table 11 E2AmRNA,EBF mRNA,PAX5mRNA in Multiple Linear Regression Analysis with Pro B,Pre B Cell Populations(r)
3 讨论
机体具有连续生成新生血细胞以补充已分化成熟的衰老血细胞的维持造血动态平衡的能力,这就需要对血细胞的生成进行精密的调节控制。骨髓中的B淋巴细胞由造血干细胞接受分化信号后定向分化形成。
3.1 EBF、PAX5对发育中Pro B、Pre B细胞数量起主导调控作用
转录因子,如E2A,EBF和PAX5专一性地在B细胞谱系中进行调节。在缺失E2A基因的小鼠中,只影响B细胞发育,而包括T淋巴细胞在内的其他造血细胞和非造血细胞系却没有明显异常,此类小鼠体内RAG-1、mbl、CD19、λ5和PAX-5转录消失,Ig重链V(D)J重排完全阻止,细胞发育停止在原B细胞[17]。E2A和EBF的协同作用对启动B细胞的分化是必需的,通过调节B细胞的特异基因,如RAG-1,RAG-2(重组过程与以上基因的表达相关)、替代性轻链(λ5/VPre-B)、CD19、Igα(mb-1,CD79a)和Igβ(B29,CD79b)的表达而实现[18]。骨髓原 B细胞分化阶段,PAX5能抑制T细胞定型关键基因Notchl的表达,抑制T细胞发育程序,PAX5高表达以促进B细胞发育,从而保证B细胞的特异性[19]。
Pro B细胞、Pre B细胞是淋巴样干细胞中的一部分,在骨髓内继续分化成B细胞需经历的非抗原依赖阶段的2个亚群,在整个B细胞发育过程中Pro B细胞、Pre B细胞有许多特征性的基因表达。
Pro B细胞是B细胞发育过程中重轻链基因尚未发生重排的胚系状态,在骨髓基质信号诱导刺激下,细胞表达RAG-1,RAG-2,以及编码替代性轻链λ5和Vpre-B。
μ链在B细胞发育中起重要作用,因为μ链缺陷小鼠其B细胞发育阻滞在Pre B细胞阶段。Pre-BCR由μ链、替代轻链 Vpre-B/λ5、Igα/β组成,虽然 Pre B细胞识别的配体尚不清楚,但此阶段是B细胞发育中一个重要的关卡点。
EBF以同源二聚体的形式结合DNA,调节在B细胞发育中起重要作用的基因的表达,如λ5,VpreB和mb-1(Igα)。剔除EBF的小鼠体内,完全缺失成熟B细胞,B细胞的发育中断在免疫球蛋白DH-JH重排前的Pro B细胞[23]。在 EBF-/-Pro B细胞中,PU.1和E2A基因表达,但检测不到PAX5的转录,提示EBF受E2A的调控,先于PAX5在B细胞发育早期发挥作用。
在Pro B细胞向Pre B细胞分化过程中,EBF和E47(E2A)能协同诱导Pro B、Pre B细胞免疫球蛋白替代轻链λ5和Vpre-B的表达,通过调节RAG-1,RAG-2来控制V(D)J重组。
由此可见,6周递增负荷运动过程中,E2A受运动的影响波动幅度较小,而EBF、PAX5则波动幅度较大。EBF、PAX5蛋白与骨髓Pro B、Pre B细胞数[1,2]有较高的相关系数,再次提示转录因子EBF、PAX5对发育中Pro B、Pre B细胞数量起主导调控作用。
3.2 EBFmRNA对早期B细胞发育的主导调控作用更加关键
在6周递增负荷运动过程中,仅特异转录因子的EBF蛋白表达水平与EBF基因表达有较相似的趋势,E2A、PAX5基因转录与蛋白表达不同步,推测其可能原因是:基因表达对蛋白质合成只是具有指导性合成的作用,影响蛋白质表达除了此因素,还与合成酶的活性、合成底物的充足与否等多种因素有关。此外,还可能涉及基因转录后调控机制,有待进一步研究证实。
研究结果显示,EBFmRNA在一次性运动后即有显著的应答反应,即EBF基因的转录对运动刺激更为敏感,短时间的运动即可以诱导其表达。EBFmRNA与Pro B、Pre B有更高的相关系数(表11),再次提示EBFmRNA对B细胞发育的主导调控作用更关键。
有研究[20-22]认为,E2A主要调控EBF的表达,E2A与EBF再进一步调控PAX5的表达。本研究中结果显示,在运动的影响下,对早期B细胞发育的起特异转录调控作用的因子中,EBF比上级调控因子E2A和下游调控因子PAX5作用更为突出。
前期研究显示,PU.1、E2A、EBF、PAX5在B细胞的分化中有等级性调节关系。如PU.1正性调节EBF的表达,而在造血前体细胞,加强的EBF表达能够恢复在PU.1缺失时受损B细胞的发育。PAX5是EBF的靶基因,但异位的PAX5并不能恢复在PU.1缺失时B细胞的发育。此外,EBF在抑制非B系细胞如T细胞和髓样细胞中起了重要作用。
EBF表达的调节,对B细胞发育的早期阶段,如共同淋巴样前体(CLP)和Pre-pro B(前祖B细胞)细胞阶段,起到了关键的系谱特异定型的作用,即导向性的指引未定型的多能淋巴系干细胞前体向B细胞系谱分化。研究表明,EBF在无PAX5存在时,可以限制淋巴系干细胞向B系细胞的分化并促进B系细胞定型[21]。
Seet CS等[22]发现,在阻止E2A的表达并伴随IL-7的低刺激的条件下,EBF也能够起到促进B细胞增殖的关键作用。他们发现缺失E2A基因小鼠,被阻断的B细胞增殖可以因EBF的表达而非PAX5的表达而得到修复,通过促成绝大多数B细胞系谱基因的表达而实现,提示在早期B系细胞的发育中,EBF是E2A不可缺少的靶基因。
也有研究[20]进一步发现,由于E2A利于N-myc的表达,E2A蛋白对于依赖IL-7的细胞增殖也是必需的,因此,高浓度的E蛋白对于EBF和N-myc的激活是必须的;而低浓度的E蛋白,在其他B系转录因子如EBF的表达的协同下,也能够发挥促进大多数B系细胞基因表达的作用。
如图3所示,本课题研究希望进一步通过组织学观察、细胞水平、转录因子、细胞因子及其受体、趋化因子及其受体、Notch信号转导通路等的层面进一步探讨运动性免疫失衡的调控机制及干预措施。

图3 本研究实验各指标在第2周的变化及相互关联示意图Figure 3.The Response and Correlating of Laboratoy Indexes at WK2
4 结论与建议
1.6周递增负荷运动过程中,E2A受运动的影响波动幅度较小,而EBF、PAX5则波动幅度较大。EBF、PAX5蛋白与骨髓Pro B、Pre B细胞数的相关度,再次提示转录因子EBF、PAX5对发育中Pro B、Pre B细胞数量起主导调控作用。
2.E2A、PAX5的蛋白与基因表达不同步,提示基因表达对蛋白质只是具有指导性合成的作用,还可能涉及基因转录后调控机制,有待进一步研究证实。
3.EBFmRNA在WK0呈现波动,提示EBF基因的转录对运动刺激更为敏感,并发现EBF比上级调控因子E2A和下游调控因子PAX5对B细胞发育的主导调控作用更加关键,对研究运动性免疫调理、延缓疲劳的意义重大。
[1]耿青青.长期递增负荷运动对骨髓早期B淋巴细胞发育的影响[D].华南师范大学博士学位论文,2010.
[2]耿青青,郝选明.长期递增负荷跑台对大鼠骨髓Pro B细胞、Pre B细胞发育的影响[J].广州体育学院学报,2011,31(5):101-105.
[3]耿青青,郝选明.递增负荷运动中调控淋巴细胞发育分化的转录因子的动态变化[C].第九届全国体育科学大会,上海,2011.
[4]耿青青,郝选明.骨髓中IL-7、IL-7R及EBF表达与运动性免疫失衡[J].体育学刊,2011,18(1):139-144.
[5]耿青青,郝选明.免疫细胞、细胞因子与延迟性肌肉酸痛症[J].体育学刊,2009,16(12):107-112.
[6]李杰.大鼠脾淋巴细胞分泌IL-2和sIL-2R对长期递增负荷运动的应答和适应特征[D].华南师范大学硕士学位论文,2007.
[7]林玲.大鼠心肌HSP70、自由基代谢和Na+-K+-ATPase活性对有氧耐力运动的应答性和适应性变化[D].华南师范大学硕士学位论文,2003.
[8]刘刚.大鼠抗氧化能力对有氧耐力运动的应答和适应及纳米硒对其影响[D].华南师范大学硕士学位论文,2003.
[9]陆小香,张蕴琨,江年.力竭运动后大鼠海马CA1区自由基、下丘脑GABA及HPA轴的动态变化[J].中国运动医学杂志,2007,26(5):563-567.
[10]权德庆.体育统计学[M].北京:人民体育出版社,2011.
[11]唐亮.大鼠细胞免疫功能对六周递增负荷运动的应答性和适应性特征[D].华南师范大学硕士学位论文,2007.
[12]万发达.血细胞和血红蛋白对长期递增负荷运动的反应与适应特征[D].华南师范大学硕士学位论文,2005.
[13]FRASCA D,BLOMBERG B B.Aging impairs murine B cell differentiation and function in primary and secondary lymphoid tissues[J].Aging Dis,2011,2(5):361-373.
[14]FRETZ J A,NELSON T,XI Y,ADAMS D J,et al.Altered metabolism and lipodystrophy in the early B-cell factor 1-deficient mouse[J].Endocrinology,2010,151(4):1611-1621.
[15]GENG Q Q.Effects of Long-term Incremental Exercise on the Transcription Factor in Development of Early Precursor B Lymphocytes in Rats Bone[C].The International Convention on Science,Education and Medicine in Sport,2012.
[16]GENG Q Q,HAO X M.The effect of long-term incremental exercise on Glutamate Decarboxylase in the hippocampus of rats[C].The international convention on Science,Education and Medicine in Sport,2008.
[17]GOSTISSA M,RANGANATH S,BIANCO J M,et al.Chromosomal location targets different MYC family gene members for oncogenic translocations[J].Proc Natl Acad Sci U S A,2009,106(7):2265-2270.
[18]HAO X M,LI J,HUANG Z G.Response and adaptation of IL-2and sIL-2Rsecreted from lymphocytes during long-term exercise in rats[C].The International Convention on Science,Education and Medicine in Sport,2008.
[19]HAO X M,ZENG Z G,HUANG Z G.The response and adaptation of neurtransmitters(Ach.DA.NA.AD)in the hypothalamic arcuate nucleus during long-term exercise[C].The International Convention on Science,Education and Medicine in Sport,2008.
[20]HUGHES D J,DICKERSON C A,SHANER M S,et al.Trans-Repression of protein expression dependent on the Epstein-Barr virus promoter Wp during latency[J].J Virol,2011,85(21):11435-11447.
[21]PONGUBALA J M,NORTHRUP D L,LANCKI D W,et al.Transcription factor EBF restricts alternative lineage options and promotes B cell fate commitment independently of Pax5[J].Nat Immunol,2008,9(2):203-215.
[22]SEET C S,BRUMBAUGH R L,KEE B L.Early B cell factor promotes B lymphopoiesis with reduced interleukin 7responsiveness in the absence of E2A[J].J Exp Med,2004,199(12):1689-1700.
[23]YABUKI M,ORDINARIO E C,CUMMINGS W J,et al.E2A acts in cis in G1phase of cell cycle to promote Ig gene diversification[J].J Immunol,2009,182(1):408-415.

