鉴定海参的斑点杂交法及其应用*
律迎春,段高飞,左 涛,徐 洁,李 晋,郑 荣,唐庆娟,薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛266003)
海 参 (sea cucumber,Phylum Echinodermata:Holothuroidea)是海洋中重要的食物和药物资源,全球现存海参1 200多种,分属于6目25科,其中具有经济价值的有40余种[1]。我国分布有140种海参,其中20余种具有食用价值[2]。海参具有提高机体免疫力、抗肿瘤、促进造血功能、抗凝血和降血脂等生理功效[3]。其丰富的营养价值备受人们的青睐,近几年国内市场上出现了即食海参、海参胶囊、海参酒等多种海参产品。在商业利益的驱动下,海参市场上出现一些以假乱真、以次充好的现象,如何快速鉴定海参种类成为目前亟待解决的问题。
传统的海参鉴定方法主要是基于海参的外部形态和解剖特征[4]。市场上销售的干海参种类繁多,经过一系列加工后形态破坏严重,因此依靠海参外部形态鉴定难度较大,准确度得不到保证。解剖特征主要指海参骨片的形态和呼吸树的有无,海参含有的骨片种类较多,需要结合各类骨片的相对比例和同一类型骨片的形态学特征进行鉴定[5]。廖玉麟[6]等曾对我国的134种海参进行形态学的分类,并对国内50多种海参骨片的组成特征进行了观察,认为海参骨片是重要的分类依据。但是利用骨片进行鉴定需要对每只海参的骨片类型和比例进行辨认和统计,技术要求比较高,需要专业人员鉴定,消费者难以采用。并且该过程工作量非常大,耗时也比较长,不能作为一种快速准确的海参种类鉴定的方法。
分子生物学方法是近几年逐渐发展起来的一种物种鉴定手段,在种类鉴定领域发挥越来越重要的作用。核酸斑点杂交检测方法通过特异性探针与目的核酸进行杂交,从而检测特定核酸序列,该方法已经在疾病诊断等领域中得到广泛应用[7]。DNA条形码技术(DNA barcoding)是通过对一个标准目的基因的DNA序列进行分析从而进行物种鉴定的技术。2003年,Herbert[8]最早提出在动物界中COⅠ基因是合适的DNA条形码标准基因,可以有效的用于动物物种的鉴定。律迎春等[9]前期构建了海参的DNA条形码,并初步验证了斑点杂交方法在海参种类鉴定中应用的可行性。本研究在前期工作的基础上,针对不同种类的海参,分别设计了种属特异性探针进行杂交实验,深入探讨该方法的实际应用情况。
1 材料与方法
1.1 材料
北大西洋瓜参 (Cucumaria frondosa),仿刺参(Apostichopus japonicus),加 州 红 参 (Parastichopus californicus),梅花参(Thelenota ananas)均购自青岛海产品市场。海参样品采用廖玉麟和Massion的方法进行形态学鉴定确定海参种类[4,10]。
1.2 海参DNA的提取
干海参用无菌水泡发,取100mg肌肉柱,冲洗干净,用滤纸吸干,切碎。采用CTAB法[11]提取4种海参的总DNA,无菌水溶解,4℃备用。
1.3 海参线粒体COⅠ基因的扩增
采用PCR技术对线粒体COⅠ基因序列片段进行快速扩增。引物序列[6]为:
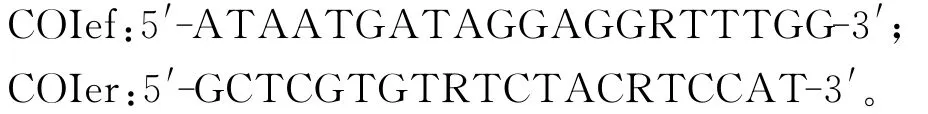
扩增长度约为690bp。
反应体系(50μL)为:MgCl2(25mmol/L)3μL,dNTPs(10mmol/L)1μL,2种引物各1μL(终浓度0.2μmol),TaqDNA聚合酶(宝生物工程有限公司,5U/μL)1μL,10×PCR Buffer 5μL以及模板 DNA 1μL,加水补足至50μL。
PCR反应循环参数:94℃预变性5min;后经过30个循环,每个循环包括:94℃50s,46℃1min,72℃1min;最后72℃延伸10min;PCR产物4℃保存备用。取5μL PCR产物进行1%琼脂糖凝胶电泳,紫外光下观察并记录实验结果。
1.4 斑点杂交鉴定海参种类
1.4.1 四种海参特异性探针的设计 PCR产物经上海生工生物工程有限公司测序,对测序结果进行人工核对、校正。测序结果在GenBank中进行比对,进一步验证海参种类。采用 DNAMAN 6.0、DNAstar 6.1和MEGA 4.1软件对4种海参的序列进行比对分析,采用Primer premier 5.0设计探针,5'端进行生物素标记。由上海生工生物工程有限公司合成。
1.4.2 斑点杂交 膜前处理:用铅笔在硝酸纤维素膜(nitrocellulose membrane;NC membrane)上划分(1×1)cm2的小格,UV照射30min,在2×SSC中浸泡10min,自然晾干;PCR产物于95℃热处理10min后迅速冰浴冷却,取3μLPCR产物点于小格中央,晾干后110℃烘烤45min。
杂交:50℃预杂交1h(杂交液:50%甲酰胺,0.5%BSA,1%SDS,0.5%polyvinylpyrrolidone,5×SSC)。加入含探针的杂交液中,55℃杂交2h。
洗涤、封阻、显色:用2×SSC-0.1%SDS和0.5×SSC-0.1%SDS分别洗膜2次,最后PBS洗膜1次。洗涤后于37℃下封阻1h(3%BSA)。然后将膜转入含1μg streptavidin-AP(VECTOR,USA)的PBS溶液中37℃处理1h后,用PBS反复冲洗,晾干。最后将膜转入显色液(BCIP/NBT的磷酸盐溶液)中37℃避光显色。洗涤,晾干并照相记录实验结果。
1.4.3 斑点杂交特异性 以4种海参DNA为模板,经PCR扩增,紫外分光光度计检测,确定浓度,并调整到相同浓度。分别点样于硝酸纤维素膜上,与4种探针杂交,检验探针的特异性。
1.4.4 斑点杂交灵敏度 4种海参DNA经PCR扩增后,产物经紫外分光光度计测定浓度,并调整到10 ng/3μL,倍 比 稀释至 1ng/3μL,100pg/3μL 和10pg/3μL,分别点样于硝酸纤维膜上,与特异性探针杂交,显色后记录实验结果,确定斑点杂交的灵敏度。
2 结果与分析
2.1 海参线粒体COⅠ基因的扩增
以海参DNA为模板进行PCR扩增COⅠ基因,琼脂糖凝胶电泳。结果显示,扩增得到了约为690bp的目的片段(见图1)。
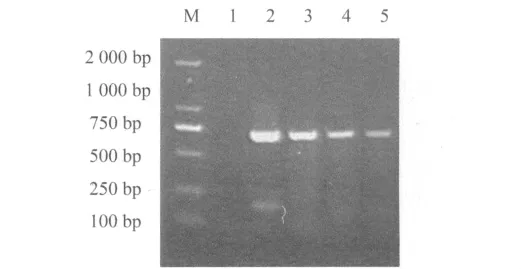
图1 4种海参PCR扩增产物电泳结果Fig.1 The amplification products of four sea cucumbers in agarose gel
2.2 探针的设计
为了保证实验过程中斑点杂交的杂交特异性和稳定性,实验设计的探针的退火温度(Tm)值应该接近。本实验中设计的4条探针Tm值均在(60±3)℃,探针信息见表1。
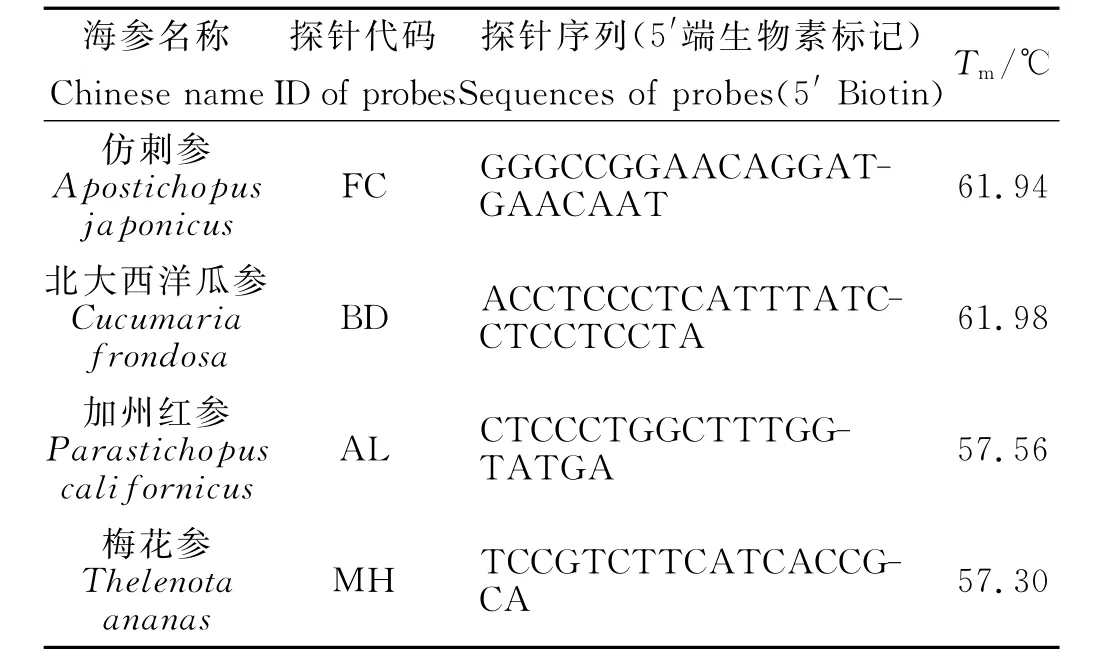
表1 探针序列及Tm值Table 1 Sequences and Tmof the probes
2.3 斑点杂交鉴定4种海参
2.3.1 斑点杂交特异性 以仿刺参、北大西洋瓜参、加州红参和梅花参的DNA为模版,PCR扩增COⅠ基因,紫外分光光度计测定并调整到相同浓度后,点样于NC膜上,分别与4种探针杂交(见图2)。结果显示,A膜与仿刺参探针杂交,只有仿刺参的点样位置出现明显斑点;说明仿刺参探针有较高的特异性;B、C、D膜分别与北大西洋瓜参探针、加州红参探针、梅花参探针杂交,也只有特异性的斑点出现。实验结果表明本研究设计的4条探针均具有高度的特异性。
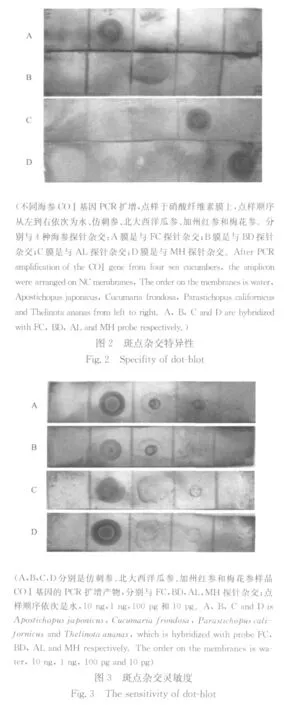
2.3.2 斑点杂交灵敏度 探针斑点杂交灵敏度检测结果见图3。实验结果显示4种海参点样10ng、1ng、100pg样品均出现明显的斑点,说明该本实验建立的斑点杂交方法灵敏度可以达到100pg。
3 讨论
DNA分子标记技术是根据DNA存在丰富的多态性而发展起来的,可直接反映生物个体在DNA水平上差异的一类新型的遗传标记技术,它是继形态标记、细胞标记、生化标记之后更为可靠的遗传标记技术,并且取得了快速的发展。本实验选择海参线粒体DNA的COⅠ基因作为DNA分子标记,线粒体DNA(mitochondrial DNA,mtDNA)具有分子结构简单[12]、严格的母系遗传[13]、无重组[14]、与核基因组无共同序列[15]、进化速率快[16]、多拷贝[15]等特点。线粒体细胞色素c氧化 酶 亚 基 Ⅰ (Mitochondrial cytochrome c oxidase subunitⅠ,COⅠ)是位于mtDNA的一段序列,由于存在显著的序列变异而能有效地对动物物种进行鉴定,被认为是一种合适的DNA分子标记[17]。梁君妮等[18]采用PCR对多种海参的线粒体COⅠ序列进行了扩增、测序及比对,发现COⅠ片段可以用于海参种类的鉴定。PCR测序法虽然具有较高的灵敏度,但需经过测序,周期长,不便于快速鉴定和大规模推广使用[19]。
核酸斑点杂交通过带有标记的特异性探针和核酸杂交后显色进行检测,结果直观,容易判断。虽然斑点杂交灵敏度低于PCR等方法,由于其具有成本低廉、操作简单、耗时短、通量高等优点,是目前分子生物学中应用最广泛的技术之一,已广泛应用于疾病诊断等领域[7]。王印庚等[20]利用地高辛标记的特异性探针检测刺参腐皮综合征的病原菌,检出限为6.25pg,具有较高灵敏度。本研究建立了斑点杂交方法用于鉴定4种海参的种类。实验中还选取了其它7种海参作为对照,检测该方法的特异性。结果表明,设计合成的4种探针具有很高的种属特异性,灵敏度达到100pg。本研究提供了一种快速、简便、成本较低的海参种类鉴定方法,为进一步建立以斑点杂交为基础的基因芯片进行海参种类鉴定奠定了理论基础。由于斑点杂交方法不需要完整海参个体,因此可以应用于海参的深加工产品(海参胶囊,海参粉剂,海参口服液等)的检测。本研究将为海参制品的质量监督、控制提供方法支撑,具有显著的社会和经济效益。
[1] McElroy S.Beche-de-mer species of commercial value-an update[J].Beche-de-mer Information Bulletin,1990,2:2-7.
[2] Chen J X.Overview of sea cucumber farming and sea ranching practices in China[J].Beche-de-mer Information Bulletin,2003,18:18-23.
[3] 王静凤,王奕,赵林,等.日本刺参的抗肿瘤及免疫调节作用研究[J].中国海洋大学学报:自然科学版,2007,37(1):93-96.
[4] 廖玉麟.中国动物志(棘皮动物门海参纲)[M].北京:科学出版社,1997:161-162.
[5] 李赟,费来华,陈家鑫.十五种海参骨片的形态学研究 [J].中国海洋大学学报:自然科学版,2008,38(2):211-216.
[6] Arndt A,Marquez C,Lambert P,et al.Molecular phylogeny of eastern Pacific sea cucumbers (Echinodermata:Holothuroidea)based on mitochondrial DNA sequence[J].Molecular Phylogenetics and Evolution,1996,6(3):425-437.
[7] Vivares C P,Guesdon J.Nucleic acid probes in aquatic bacteriology[J].Aquaculture,1992,107(2-3):147-154.
[8] Hebert P D N,Ratnasingham S,deWaard J R.Barcoding animal life:cytochrome c oxidase subunit 1divergences among closely related species[J].Proceedings of the Royal Society of London.Series B,2003,270:96-99.
[9] 律迎春,左涛,唐庆娟,等.海参DNA条形码的构建及应用 [J].中国水产科学,2011,18(4):782-789.
[10] Massin,C.Reef-dwelling Holothuroidea(Echinodermata)of the Spermonde Archipelago(South-West Sulawesi,Indonesia)[J].Zoologische Verhandelingen,1999,329:3-144.
[11] 单懿,薛长湖,李兆杰.干海参线粒体的提取与纯化研究 [J].食品科学,2005,26(10):111-112.
[12] Bibb M J,Van Etten R A,Wright C T,et al.Sequence and gene organization of mouse mitochondrial DNA [J].Cell,1981,26(2):167-180.
[13] Gyllensten U,Wharton D,Wilson A C.Maternal inheritance of mitochondrial DNA during backcrossing of two species of mice[J].The Journal of Heredity,1985,76(5):321-324.
[14] Cann R L,Stoneking M,Wilson A C.Mitochondrial DNA and human evolution[J].Nature,1987,325:31-36.
[15] Beale G H,Knowles J K C.Extranucleatr genetics[M].Beijing:Science Press,1984:9-55.
[16] Vawter L,Brown W M.Nuclear and mitochondrial DNA comparisons reveal extreme rate variation in the molecular clock[J].Science,1986,234:194-196.
[17] Hebert P D,Ratnasingham S,deWaard J R.Barcoding animal life:cytochrome c oxidase subunit 1divergences among closely related species[J].Proceedings of the Royal Society -Biological Sciences,2003,270:96-99
[18] 梁君妮,薛长湖,赵玉然,等.海参营养液DNA高效快速提取及种类鉴定方法 [J].食品科学,2008,29(5):269-272.
[19] 谢玮,闫冬春,牛余泽,等.核酸探针斑点杂交检测对虾传染性肌肉坏死病毒 [J].水产科学,2010,29(8):443-336.
[20] 王印庚,张凤萍,李胜忠,等.刺参腐皮综合征病原灿烂弧菌检测探针的制备及应用 [J].水产学报,2009,33(1):119-125.

