山东北部沿海四角蛤蜊性腺发育年周期研究*
柯巧珍,李 琪,闫红伟,孔令锋
(中国海洋大学海水养殖教育部重点实验室,山东 青岛266003)
四角蛤蜊(Mactra veneriformis Reeve 1854)广泛分布于中国、韩国、日本沿海,营埋栖生活,主要生活在潮间带的中、低潮区及浅海的泥沙滩[1-2]。在中国,沿海群众历有食用四角蛤蜊的习惯,但关于它的研究报道很少,其生态、生理和生物量方面的数据也有限[3-6]。近年来,对于四角蛤蜊的过渡采捕已导致其资源量日渐衰退。为了逆转这种日益减少的趋势,一方面,需要根据四角蛤蜊的繁殖特征制定禁渔期以保护野生资源,另一方面,开发人工养殖技术也变得至关重要。
Chung等[2]研究了韩国群山沿海四角蛤蜊的繁殖周期,发现该地区四角蛤蜊主要在温度高于22℃的7、8月间产卵。多项研究表明,温度和食物丰度的季节变化与双壳贝类生长和繁殖密切相关[7-8]。对于性腺发育周期的研究是双壳贝类人工育苗成功的基础[9-10]。国内一些学者对四角蛤蜊的人工育苗进行了初步研究[11-12],但仍未实现规模化生产。
本文结合采样海区环境因子的周年变化情况,对山东无棣县马山子海区四角蛤蜊的繁殖周期进行了研究,其主要目的在于:(1)描述配子发生周年变化的组织学特征;(2)确定该地区四角蛤蜊的配子发生期及产卵季节;(3)从定性和定量(条件指数、卵径)两方面探讨繁殖周期与环境因子间可能存在的关系。该研究的开展不仅为判断四角蛤蜊人工育苗的最适时机提供科学依据,也为其野生资源的管理和保护提供重要的基础资料。
1 材料与方法
1.1 采样海区
实验所用样品采自山东省无棣县马山子海区(38°09′N~38°13′N,117°58′E~118°12′E),地处黄河三角洲,濒临渤海,水生生物资源丰富。分别用水银温度计和便携式折射计现场测定取样海区海水的温度和盐度,同时采集采样地海水样品,避光保存,与贝类样品一同运回实验室,采用戴玉蓉等[13]的方法测定叶绿素a含量。
1.2 样品采集
2007-04~2008-03,每月采集1次,每次随机采集100个个体,将鲜活样品置于冰盒中运回实验室以备组织学分析。全年所采样品生物学测量的平均结果如下:壳长(3.31±0.35)cm,壳高(3.00±0.28)cm,软体部鲜质量(2.51±0.61)g。
1.3 条件指数
每月取5个四角蛤蜊个体,解剖,将软体部与壳分离,在105℃烘箱中烘干至恒重,分别称取软体部干重和壳干重,计算条件指数。
条件指数=(软体部干重/壳干重)×100[14]
1.4 组织学分析
1.4.1 组织学切片 每个月取40~50个四角蛤蜊个体做组织学切片,观察,以确定样品的性腺发育程度及性别。将样品解剖,观察并切取5mm厚的性腺-内脏团小块于Bouin's液中固定24h;然后转移到70%酒精中储存。制作切片时,将样品做以下处理:梯度酒精脱水;石蜡渗透,包埋;常规组织学切片(5~6μm);爱氏苏木精-曙红(H-E)染色;中性树脂封片。在光学显微镜下观察每张切片,辨别雌雄并判断各样品的性腺发育程度。
1.4.2 卵母细胞和卵子直径 将目微尺安装到Olympus显微镜目镜中,经台微尺(×400)校对后,测量组织学切片上卵子的直径。每个月随机选取5~8张雌性个体切片,每个个体至少测量100个清晰可见的卵子的直径(穿过核仁的最长轴)。根据Grant等[15]推荐的标准,未对卵子稀少和广泛处于吞噬作用的个体进行分析。
1.5 数据分析
数据统计分析采用SPSS16.0软件处理。用单因素方差分析(ANOVA,SNK)对条件指数月间差异进行显著性检验。卡方(χ2)检验用于分析性比。
2 结果
2.1 环境因子的季节变化
图1显示了采样海区海水的温度、盐度和叶绿素a含量的周年变化。如图所示,水温呈明显的季节变化,4月(14.5℃)后,随着夏季的到来,水温持续上升,8月呈现最高值(30.0℃),9月~次年2月,水温不断下降,2月份降至最低(2.0℃)。
盐度在31.0~34.1之间浮动,10月~次年1月,盐度均高于33,峰值出现在11月;夏季受雨季影响,6月和9月盐度明显降低,分别为31.0和31.4;冬季,盐度随着水温的下降而降低。
叶绿素a含量亦呈季节性的变化,春季逐渐上升,夏季高温期有所下降,9月达最高值(24.35μg/L),随后下降,冬季处于全年最低水平(低于3.10μg/L)。

图1 取样海区水温、盐度和叶绿素a含量的周年变化Fig.1 Monthly variations in water temperature,salinity and chlorophyll ain the survey area
2.2 条件指数
随着配子发育的进行,4~5月间,条件指数显著下降(见图2)。然后,维持相对稳定,直至大量成熟配子的排放,8~9月,条件指数明显降低,10月降至全年最低3.95。耗尽期和休止期(10月至次年1月)则逐渐上升,1月出现峰值11.95;2月,条件指数随配子发生的开始而减小。如图2所示,除9月与2月外,条件指数的变化趋势与软体干重大致相同,这与该月壳的加速生长有关。

图2 四角蛤蜊壳干重、软体干重及条件指数的周年变化fig.2 Monthly values of dry shell weight,dry flesh weight,and the condition index(CI)of the surf clam M.veneriformis
2.3 繁殖周期
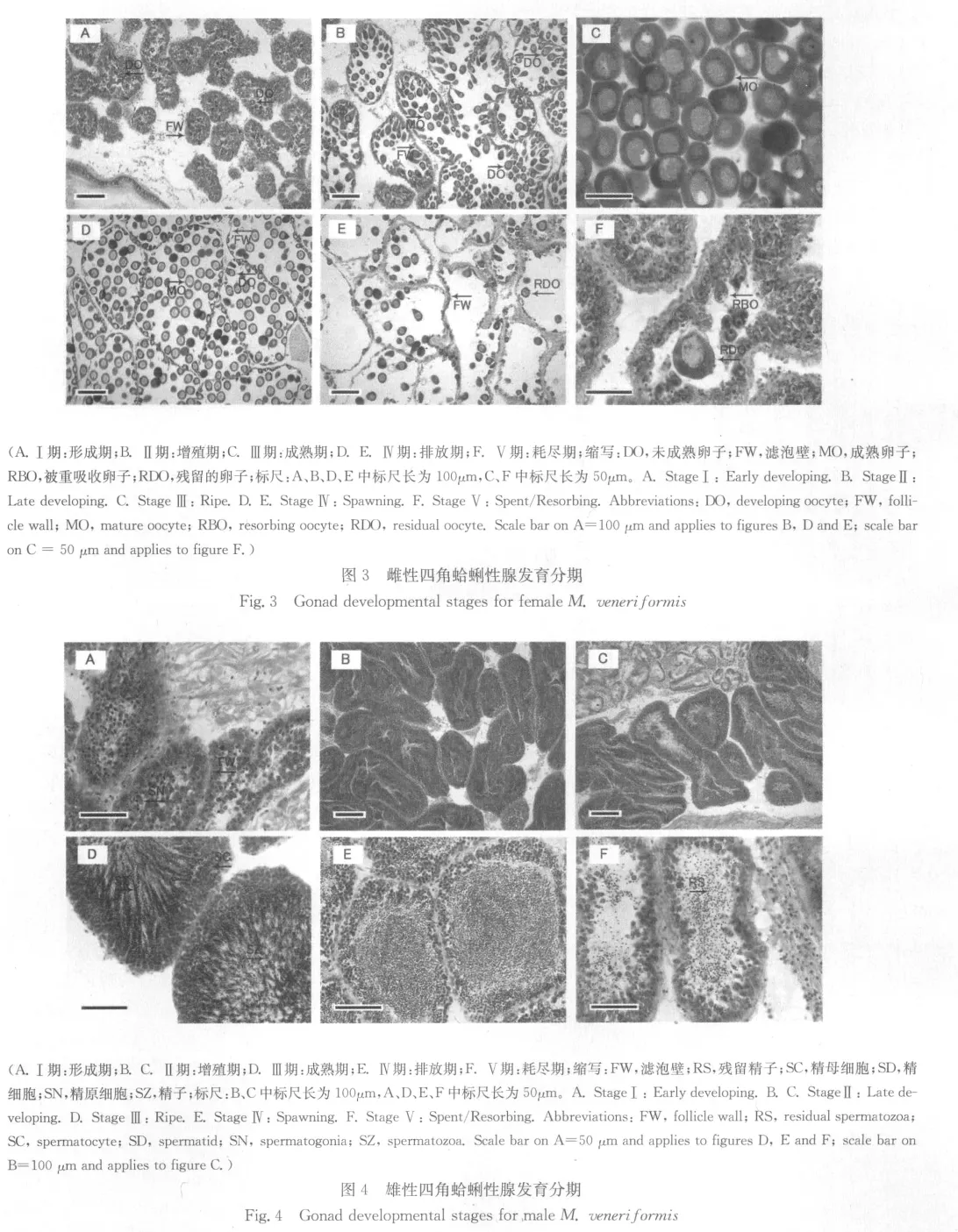
2.3.1 性腺发育周期 参考Drummond等[16]对性腺发育各期特点的描述,将四角蛤蜊性腺发育过程分为6期(见图3,4):0期 (休止期)性腺主要由结缔组织组成,雌雄不可辨别。
Ⅰ期 (形成期)性腺开始增殖;雌性滤泡壁上出现越来越多可辨别的卵,卵很小,滤泡腔中没有游离的卵(图3-A)。雄性滤泡壁上形成多层精原细胞,数量逐渐增加并且逐渐有精母细胞产生,无精细胞或精子(图4-A)。
Ⅱ期 (增殖期)雌性滤泡腔中出现成熟卵子,但数量少于全部卵的一半,多数具短柄附着于滤泡壁上(图3-B)。雄性滤泡中同时存在精原细胞、精母细胞、精细胞和精子;在发育较慢的个体,没有占主导地位的细胞类型(图4-B);进一步发育的个体,滤泡中则主要充满精细胞和精子(图4-C)。
Ⅲ期 (成熟期)性腺体积增大;雌性滤泡腔内充满大量成熟卵子,相互挤压,卵子呈多边形,滤泡壁薄(图3-C)。雄性滤泡主要由成熟精子组成,尾部指向滤泡腔中央,呈辐射带状;个体成熟度越高,精子辐射带状区域越接近滤泡壁(图4-D)。
Ⅳ期 (排放期)雌性滤泡内游离卵子的数量减少(图3-D),有些滤泡内的卵子全部排空,滤泡壁破裂(图3-E)。雄性滤泡中,螺旋状精子占了非常大的比例,一些滤泡由于成熟配子的排放而出现空腔(图4-E)。
Ⅴ期 (耗尽期)滤泡破裂、分散,相对较空,发生吞噬作用。雌性仅观察到一些残留卵子,大部分处于重吸收阶段(图3-F)。雄性残留少量精子,且处于重吸收阶段(图4-F)。
2.3.2 性腺发育分期 图5显示了雌雄四角蛤蜊各发育期所占比例的月变化。性腺发生开始于12月~次年1月间。前3个月的切片观察结果表明,4~6月大部分个体(雌:91.3%;雄:97.0%)处于Ⅱ期(增殖期),每个月均有少数个体发育成熟。成熟期主要出现在7月(雌:68.3%;雄:33.3%),同时,本月也分别有22.2 %和31.3%的雌雄个体处于排放期。7、8月雄性处于增殖期的比例明显高于雌性,12月雄性处于配子发生期的比例低于雌性,由此推测雄性的性腺发育可能略滞后于雌性。
2.3.3 性比 周年共采集1 161个四角蛤蜊1龄个体,其中49.0%为雌性,43.1%为雄性,7.9%因性腺未分化而分辨不出雌雄,未发现雌雄同体现象。如图6所示,雌雄不可分辨的样品主要出现在休止期(10~12月)。雌雄比例为1.138∶1,经χ2检验,该比例与期望比值(1雌∶1雄)间存在显著差异(χ2=4.454;df=1;P<0.05),雌性多于雄性。

2.3.4 卵径 随着配子发育,卵径不断增大(见图7),6、7月达最大,平均值分别为40.65和40.97μm。排放期(8、9月)则有所下降。10~12月大部分个体处于耗尽期和休止期,无法统计平均卵径。

图7 四角蛤蜊卵母细胞直径月平均值的周年变化Fig.7 Monthly fluctuation in mean oocyte diameter of M.veneriformis
3 讨论
为了有效保护贝类野生资源,并对其进行养殖开发,近年来,国内外诸多学者运用形态学和组织学方法研究了众多贝类,尤其是海洋经济贝类的繁殖生物学特点[9,17-18]。这些研究的开展对于揭示其生活史具有重要意义。繁殖期被确定,针对不同地区特定种类的禁渔期的设定也将有据可循[2,19]。
3.1 繁殖周期
贝类确切的产卵次数难以精确计算,往往只能界定一年中主要的产卵高峰期[20]。四角蛤蜊性腺发育的组织学周年观察结果以及卵径的月变化规律表明本实验所用四角蛤蜊全年只有1个产卵季节,发生在7~9月。这与Chung等[2]报道韩国群山沿海四角蛤蜊的产卵次数一致,其主要产卵季节发生在7~8月。但Iwatav[21]和 Oshima等[22]研究发现东京湾四角蛤蜊一年中有2个产卵期,分别为4~7月和9~10月上旬。本实验中,组织学观察表明,四角蛤蜊的卵巢和精巢基本同步发育成熟,两性配子同时排放,9月份大部分均已排尽。贝类生殖成功的重要基础是两性性腺的同步发育,精子和卵子同时排放会增加受精的可能性[23]。四角蛤蜊两性配子均在8月集中排放,这为四角蛤蜊人工育苗过程中人工授精的可操作性提供了理论依据。
在双壳贝类繁殖生物学研究中,条件指数常被用于判定贝类的成熟度。Kang等[24]和Drummond等[16]分别在长牡蛎(Crassostrea gigas)和菲律宾蛤子(Ruditapes philippinarum)中,发现条件指数与性腺发育密切相关,在性成熟过程中增大,排放期及排放后期减小。本实验中,条件指数在配子发生初期略有降低,性成熟过程中保持相对稳定,产卵后显著减小;耗尽期逐渐上升,显示出一个快速恢复期,1月达全年最高。同时,1月也正是性腺形成期,为性腺发育、成熟提供物质基础和能量来源。
本实验中,卵径的变化情况很好地反映了四角蛤蜊的配子发育周期。配子发育过程中,卵径逐渐增大,产卵前达到最大[20]。Lango-Reynoso等[25]和Joaquim等[9]分别用卵径来描述长牡蛎和坚固马珂蛤(Spisula solida)的性腺成熟度。本研究发现卵径的变化从形成期、增殖期到成熟期(1~7月)逐渐增大,进入成熟期相对稳定(标准差最小),随着大部分饱满、成熟的卵子的排放,卵径减小,耗尽期残留在滤泡中未排放的卵子逐渐溶解,被重吸收[26]。本实验测得四角蛤蜊成熟卵子的直径为36~45μm,排放中的卵子直径为40~50μm,略小于韩国群山地区四角蛤蜊的卵子直径,其值分别为50~65μm和65~70μm[2]。
四角蛤蜊是雌雄异体贝类,研究结果显示山东无棣县马山子海区雌雄四角蛤蜊在数量上存在显著差异,雌性多于雄性。这与Chung等[2]的研究结果有所不同,在韩国群山地区四角蛤蜊雌雄个体数量不存在显著差异(雌雄比为1.046∶1)。此种差别可能是由于地理位置和环境条件不同引起的,Lango-Reynoso等[25]研究表明温度和食物供给是长牡蛎性别变化过程中的决定性因素。
3.2 繁殖周期与环境因子的关系
双壳贝类的繁殖活动受外部因素(如温度、盐度、光照和食物的丰歉度等)和内部因素(内分泌调节等)综合作用的影响[27-28]。适宜的外部环境是贝类性成熟、配子排放和幼虫生长的前提条件。Mann[29]报道英国的长牡蛎,由于水温很少超过18℃,通常性腺能够发育成熟,但从不产卵,因此,他提出长牡蛎的产卵也需要最低温度,即性腺成熟的贝类需要在一定的温度条件下才能实现产卵。Park等[30]的研究结果表明环境中充足的食物和其他理化因子可控制菲律宾蛤仔的产卵节奏。本研究中,四角蛤蜊配子发生开始于水温最低的冬季,此时叶绿素含量也最低;成熟配子排放期间,水温与叶绿素a含量均为全年最高水平;9月大部分成熟精卵都已排放,此时水温为21℃,浮游植物含量最丰富,这样的环境条件有利于幼虫的存活和生长;随后,温度和食物量同时迅速下降,四角蛤蜊进入恢复期,为下一次繁殖活动准备物质和能量基础。由此可见,适宜的温度和充足的食物是四角蛤蜊进行繁殖活动必要条件。此外,本研究还发现了一些有趣的现象,叶绿素a含量在6和9月出现2个峰值,与之相对应的盐度则出现峰谷;同时,这2个月的水温十分接近,分别为22和21℃。6月有7.4%个体性腺已发育成熟,群体即将进入成熟期;9月则有58.0%个体处于耗尽期,群体即将结束排放期。
综上所述,山东无棣县马山子海区四角蛤蜊的繁殖周期分为2个明显的阶段:活跃期(4~9月)和相对静止期(10月~次年3月)。主要产卵期为7~9月,其繁殖活动与温度、食物丰歉度等环境因子密切相关。条件指数和卵母细胞直径可作为判断性腺成熟度的良好指标。本研究所获得的数据为黄河三角洲地区四角蛤蜊种群资源的管理保护和四角蛤蜊工厂化苗种生产条件的优化提供了理论基础。
[1] 王如才,王昭萍,李琪,等.海水贝类养殖学 [M].青岛:中国海洋大学出版社,2008:566-568.
[2] Chung E Y,Ryou D K.Gametogenesis and sexual maturation of the surf clam Mactra veneriformis on the west coast of Korea[J].Malacologia,2000,42:149-163.
[3] Kasai A,Horie H,Sakamoto W.Selection of food sources by Ruditapes philippinarumand Mactra veneriformis (Bivalva:Mollusca)determined from stable isotope analysis[J].Fisheries Sci,2004,70:11-20.
[4] Hiwatari T,Kohata K,Iijima A.Nitrogen budget of the bivalve Mactra veneriformis,and its significance in benthic—pelagic systems in the Sanbanse Area of Tokyo Bay[J].Estuar Coast Shellf S,2002,55:299-308.
[5] Lee J Y.Effects of silt and clay on the rates of respiration,filtration and nitrogen excretion in shellfish,Mactra veneriformis [J].Bull Korean Fish Soc,1994,27:59-68.
[6] Ryou D K,Kim Y H.Studies on the population dynamics of surf clam,Mactra veneriformis is Reeve(Bivalvia )in the coast of Kunsan,Korea.Production[J].Korean J Malacology,1997,13:193-201.
[7] Mann R.The effect of temperature on the growth,physiology and gametogenesis in the Manila clam Tapes philippinarum [J].J Exp Mar Biol Ecol,1979,38:121-133.
[8] Goulletquer P,Nedhif M,Heral M.Production de la palourde japonaise Ruditapes philippinarum en bassins semi-ferm s(claires):approches nerg tiques et relations trophiques[J].Aquaculture,1988,74:331-348.
[9] Joaquim S,Matias D,Lopes B,et al.The reproductive cycle of white clam Spisula solida (L.)(Mollusca:Bivalvia):Implications for aquaculture and wild stock management[J].Aquaculture,2008,281:43-48.
[10] Serdar S,Lok A.Gametogenic cycle and biochemical composition of the transplanted carpet shell clamTapes decussatus,Linnaeus 1758in Sufa(Homa)Lagoon,Izmir,Turkey[J].Aquaculture,2009,293:81-88.
[11] 崔广法,于业绍,于志华,等.四角蛤蜊育苗的初步研究[J].海洋科学,1985,9(3):36-40.
[12] 闫喜武,张跃环,左江鹏,等.北方沿海四角蛤蜊人工育苗技术的初步研究 [J].大连水产学院学报,2008,23(5):348-352.
[13] 戴玉蓉,卢敬让.养殖水体浮游植物叶绿素a的简易测定 [J].齐鲁渔业,1997,14:35-36.
[14] Walne P R.Experiments on the culture in the sea of the butterfish Venerupis decussate (Linnaeus,1758)[J].Aquaculture,1976(8):371-381.
[15] Grant A,Tyler P A.The analysis of data in studies of inverte-brate reproduction:I.Introduction and statistical analysis of gonad indices and maturity indices [J].Int J Invertebr Reprod,1983,6:259-269.
[16] Drummond L,Mulcahy M,Culloty S.The reproductive biology of the Manila clam,Ruditapes philippinarum,from the North-West of Ireland[J].Aquaculture,2006,254:326-340.
[17] Taylor A C,Venn T J.Seasonal variation in weight and biochemical composition of the tissues of the queen scallop Chlamys opercularis from the Clyde Sea Area [J].J Mar Biol Ass UK,1979,59:605-621.
[18] Li Q,Osada M,Suzuki T,et al.Changes in vitellin during oogenesis and effect of estradiol-17βon vitellogenesis in the Pacific oyster Crassostrea gigas[J].Invertebr Reprod Dev,1998,33:87-93.
[19] Avila-Poveda O H,Baqueiro-Cardenas E R.Reproductive cycle of Strombus gigas Linnaeus 1758 (Caenogastropoda:Strombidae)from Achipelago of San Andres,Procidencia and Santa Catalina,Colombia[J].Invertebr Reprod Dev,2009,53:1-12.
[20] Kim S K,Rosenthal H,Clemmesen C,et al.Various methods to determine the gonadal development and spawning season of the purplish Washington clam,Saxidomus purpuratus (Sowerby)[J].J Appl Ichthyol,2005,21:101-106.
[21] Iwata K S.Artificial discharge of reproductive substances by ksalts injection in Mactra veneriformis (Bivalve)[J].Bull Japanese Soc Sci Fisheries,1948,13:188-192.
[22] Oshima Y T,Sudo T,Hanaoka J,et al.Shallow sea aquaculture[M].Tokyo:Daisei Publishing Corporation,Limited,1965:252-253.
[23] O'Connor W A,Heasman M P.Spawning induction and fertilisa-tion in the doughboy scallop Chlamys(Mimachlamys)asperrima[J].Aquaculture,1995,136:117-129.
[24] Kang C K,Park M S,Lee P Y,et al.Seasonal variations in condition,reproductive activity,and biochemical composition of the pacific oyster,Crassostrea gigas (Thunberg),in suspended culture in two coastal bays of Korea[J].J Shellfish Res,2000,19:771-778.
[25] Lango-Reynoso F,Ch vez-Villaba J,Pennec M L.Reproduction patterns of the Pacific oyster Crassostrea gigas in France[J].Invertebr Reprod Dev,2006,49:41-50.
[26] Darriba S,Juan F S,Guerra A.Reproductive cycle of the razor clamEnsis arcuatus (Jeffreys,1865)in northwest Spain and its relation to environmental conditions [J].Exp Mar Biol Ecol,2004,311:101-115.
[27] Sastry A N.Pelecypoda(excluding Ostreidae).In:Giese AC,Pearse JS(Eds.),Reproduction of Marine Invertebrates,vol.5[M].New York:Academic Press,1979:113-292.
[28] Chávez-Villalba J,Pommier J,Andriamiseza J,et al.Broodstock conditioning of the oyster Crassostrea gigas:origin and temperature effect[J].Aquaculture,2002,214:115-130.
[29] Mann R.Some biochemical and physiological aspects of growth and gametogenesis in Crassostrea gigas and Ostrea edulis grown at sustained elevated temperature [J].J Mar Biol Assoc UK,1979,59:95-110.
[30] Park K I,Choi K S.Application of enzyme-linked immuno-sorbent assay for studying of reproduction in the Manila clamRuditapes philippinarum (Mollusca:Bivalvia):I.Quantifying eggs[J].Aquaculture,2004,241:667-687.

