不同压力作用形式对大鼠压疮缺血再灌注损伤的影响
梁燕,薛燕,侯冉,王海芳
(1.山西医科大学 护理学院,山西 太原 030001;2.山西医科大学第二医院 护理部,山西 太原 030001)
压疮又称压力性溃疡,是由于局部组织受压超过临界时间而引发的缺血、变形,缺血组织解除压力恢复血液灌流后又发生缺血再灌注损伤[1]。压疮发生的力学因素有:垂直压力、摩擦力和剪切力。压疮的发生给患者带来了极大的痛苦和经济负担,它是衡量医院护理水平的一个重要指标,也是困扰医疗护理人员的一个难题。对于压疮,关键在于风险评估。现今常用的压疮评分表较少纳入压疮发生的力学因素。本实验基于临床护理实际问题,利用远交群大鼠(sprague dawley,SD)建立压疮缺血再灌注模型,探讨不同压力的作用形式对压疮的影响,为其纳入压疮危险因素评估表并给予相应分值提供实验依据。
1 材料与方法
1.1 实验材料 SD大鼠32只由山西医科大学实验动物中心提供,雌雄不限,体质量(220±20)g。领回后于安静环境中分笼喂养1周,每笼8只,自由饮水、进食,每周更换垫料3次。室温(25.0±2.0)℃,湿度50%左右。
1.2 方法
1.2.1 实验方法 10%水合氯醛腹腔注射麻醉后,用8%硫化钠溶液将大鼠双后肢脱毛。之后,利用倒置的玻璃注射器加压装置对部分大鼠施加垂直压力。此加压装置用止血带将空心玻璃管与玻璃注射器的乳头端(注射器的乳头端横向折断)相连,注射器的空筒与活塞之间涂抹石蜡油,以减少两者的摩擦力。在装置内加水,并将大鼠仰卧于加压装置,由水柱产生的压力通过注射器的活塞便可作用于大鼠后肢膝关节骨隆突处皮肤组织。通过计算受压部位的面积和加压的重量(压力),使大鼠后肢膝关节骨隆突处皮肤组织受到9kPa的压强[1]。施压过程中根据大鼠的状态补加水合氯醛,且每2.5h腹腔注射葡萄糖盐水(2.5%葡萄糖注射液加0.45%氯化钠注射液)2~3ml以保证麻醉期间的正常水平[2]。将大鼠按随机数字表法分为4组:(1)A组(对照组,n=8):大鼠仰卧于平板上,未施加任何压力持续7.5h;(2)B组(垂直压力组,n=8):给予垂直压力2h、再放松0.5,即缺血2h、再灌注0.5h为1个循环,进行3个循环;(3)C组(摩擦力组,n=8):给予垂直压力2h(2h末用棉布在骨隆突处往返摩擦,摩擦距离为1cm)、再放松0.5,即缺血2h、再灌注0.5h为1个循环,进行3个循环;(4)D组(剪切力组,n=8):将胶布一端粘贴于骨隆突处,另一端留出,向肢体远端牵拉骨隆突处皮肤0.3~0.5cm,同时以垂直压力压迫此处皮肤2h、再放松0.5h,即缺血2h、再灌注0.5h为1个循环,进行3个循环。
1.2.2 观察指标 (1)大鼠受压部位皮肤完整性与颜色变化:3个循环结束时,肉眼观察大鼠受压部位皮肤完整性(有无破损、破损面积大小、深度等)和颜色变化。(2)生化指标测定:取腹主动脉血5ml放入不含抗凝剂的空试管中,4℃ 3600r/min离心10min,取上清液于-70℃冰箱中冻存待测。所收集的上清液用比色法测定血清中SOD(超氧化物歧化酶)、MDA(丙二醛)、NO(一氧化氮)的活性或含量。检测试剂盒均由南京建成生物工程研究所提供,具体检测方法严格按照说明书进行操作。(3)光镜观察受压纤维表皮及肌肉组织:光学显微镜下对受压部位的表皮及肌肉组织进行观察。大鼠脱颈椎处死。确认动物死亡后,将大鼠后肢膝关节放置于冰块上,并截取膝关节处上下3cm范围的后肢,然后再切取受压部位的皮肤组织。经4℃生理盐水洗净血液后,用滤纸吸干水分,立即浸入10%中性多聚甲醛溶液固定24~48h。经脱水、石蜡包埋、组织切片、苏木精-伊红(H-E)染色,在光学显微镜下对表皮、真皮及肌肉结构进行组织观察。
1.2.3 实验仪器 721可见分光光度仪,数显恒温水浴锅,低温离心机,冷藏冷冻箱及电子天平等。
1.3 统计学处理 采用SPSS 13.0统计软件对所有数据进行分析处理,计量数据以表示,组间比较采用单因素方差分析,各组两两比较用LSD检验,以P<0.05或P<0.01表示差异有统计学意义。
2 结果
2.1 大鼠受压部位皮肤完整性与颜色变化 A组大鼠皮肤完整,皮肤颜色与实验前比较无明显差别;B组大鼠皮肤也完整,但与实验前相比,皮肤出现紫红色;C组大鼠受摩擦处皮肤发红且有点状破损;D组大鼠皮肤颜色与实验前相比为暗红色。
2.2 生化指标测定 各组大鼠血清SOD活性、MDA和NO含量比较见表1。各压迫组与对照组比较:SOD活性、MDA和NO含量均有统计学意义,各压迫组之间比较也均有统计学意义。其中,摩擦力组与垂直压力组比较:SOD活性(P<0.05)、NO含量下降(P<0.01),MDA含量增加(P<0.05);剪切力组与垂直压力组比较:SOD活性和NO含量明显下降(P<0.01),MDA含量明显增加(P<0.01)。
表1 各组血清SOD、MDA、NO的变化()
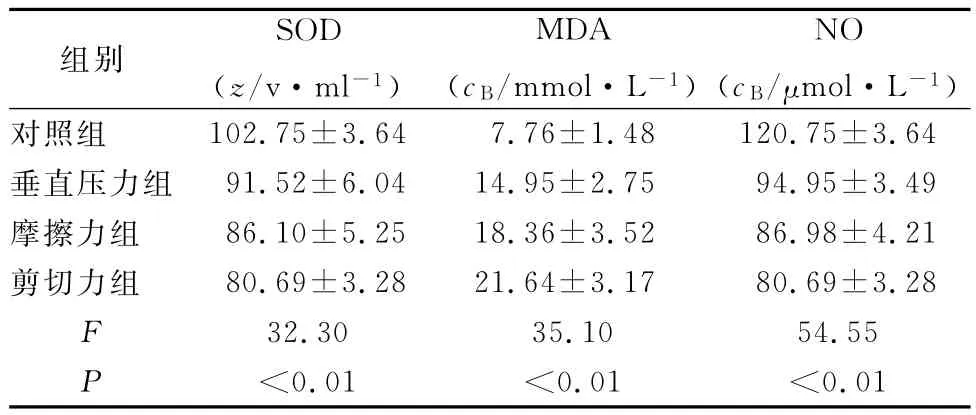
表1 各组血清SOD、MDA、NO的变化()
组别 SOD(z/v·ml-1)MDA(cB/mmol·L-1)NO(cB/μmol·L-1)对照组 102.75±3.64 7.76±1.48 120.75±3.64垂直压力组 91.52±6.0414.95±2.75 94.95±3.49摩擦力组 86.10±5.2518.36±3.52 86.98±4.21剪切力组 80.69±3.2821.64±3.17 80.69±3.28 F 32.30 35.10 54.55 P<0.01 <0.01 <0.01
2.3 光镜观察 A组:正常大鼠皮肤上皮组织结构清楚,为复层鳞状上皮,肌纤维排列有序,横纹清晰,呈编织状排列;B组:复层鳞状上皮相对于A组变薄,结构不清,细胞层次减少,肌纤维水肿明显,间质增宽,横纹模糊;C组:复层鳞状上皮较B组变薄,甚至角化,结构不清,肌纤维水肿明显,间质增宽,横纹断裂;D组:上皮组织较薄,结构不清,肌纤维较B组水肿明显,较疏松,横纹断裂较多,间质水肿增宽。
3 讨论
压疮一直是基础护理工作中的重中之重,是评价护理工作质量的重要指标,也是护理领域中的难题。在临床工作中,压疮的预防比治疗更重要。应用压疮危险因素评估量表是预防压疮关键性的一步,是有效护理干预的一部分[3]。现今常用的压疮危险因素评估表较少将引起压疮的力学因素纳入其中。作为压疮发生的力学因素能否纳入压疮危险因素评估表并给予相应分值呢?本实验在9kPa压力下,经过3个循环的缺血再灌注(缺血2h,再灌注0.5h)复制出大鼠压疮模型。通过对受压部位的病理学观察及相应指标的测定,为压疮发生的力学因素引入压疮危险因素评估表并给予相应分值提供理论依据。此造模过程没有对大鼠造成其他创伤,并模拟临床2h翻身1次,基本符合临床的实际情况。
在组织细胞的缺血再灌注损伤中,氧自由基起着重要作用,其含量水平决定着组织细胞衰变或损伤的程度,当其生成的数量超出机体的调控和保护能力时势必造成组织损伤。SOD水平是公认的可间接反映机体内自由基含量的重要指标之一,它与自由基含量呈负相关。其活性在一定程度上反应了机体清除氧自由基的能力[4]。MDA是氧自由基作用于生物膜多聚不饱和脂肪酸发生脂质过氧化反应的产物,其毒性最大且最具代表性,它的产生量与氧自由基的量相平衡。MDA含量可以反映组织含有氧自由基的水平和组织内脂质过氧化情况,并间接反映细胞损伤的程度[5]。在缺血再灌注期,组织内可爆发大量的超氧阴离子自由基,在水溶液中NO可以与超氧阴离子自由基反应生成过氧亚硝基阴离子,它是一种氧化性极强、毒性很大的物质,可以导致细胞膜脂质过氧化和细胞其他成分发生氧化损伤[6]。
本实验中,各压力组MDA含量较对照组均有明显升高,说明肢体受压后经不完全缺血再灌注产生了大量自由基,从而加重组织的损伤。剪切力组与垂直压力组相比,SOD活性和NO含量下降、MDA含量上升,提示剪切力组比垂直压力组产生了大量的氧自由基,细胞损伤的程度比垂直压力组重。剪切力比垂直方向的压力更具危害,进一步加重组织损伤。摩擦力组与垂直压力组相比,SOD活性和NO含量下降、MDA含量上升,提示摩擦力组比垂直压力组产生了大量的自由基,导致组织损伤加重而产生压疮。压疮的实质是皮肤软组织的缺血、缺氧、坏死,在压力作用下,各层组织同时均发生相应的退行性变,包括水肿、肌横纹溶解消失、透明性变及吞噬细胞浸润[7]。光学显微镜下,剪切力组相对于垂直压力组造成了肌纤维水肿、横纹断裂和间质增宽,提示剪切力较垂直压力造成了深部组织的损伤,肌肉比皮肤对压力更敏感。剪切力作用于深层,引起组织的相对移位,能切断较大区域的小血管部位,导致组织氧张力下降,因此,它比垂直压力更具危害。提示当患者受到剪切力时,可能皮肤表面未见明显受损但深部组织已发生了不可逆性的改变,此与Ribbe等[8]的结论相一致。所以,看似表面轻微受损,可能内部已发生不可逆性坏死。在患者病情允许的情况下,应增加翻身次数或减少剪切力的损害。并且在压疮评分过程中可以将剪切力纳入其中,给予相对于垂直压力较大的分值。摩擦力组相对于垂直压力组主要造成了复层鳞状上皮变薄,甚至角化、结构不清,提示摩擦力易损害皮肤的角质层,而增加对压疮的敏感性,更易产生压疮。此与Dinsdale[9]的结论相一致。摩擦可使局部皮肤温度增高,温度升高1℃,能加快组织代谢并增加氧的需要量10%,此时将更增加压疮的易发性,提示临床上应尽量减少摩擦力的产生。如保持床铺平整、干净,不可独自搬动危重患者,尽量采用提单式翻身。在压疮评分过程中可以纳入摩擦力,但其分值应介于剪切力和垂直压力的分值之间。
综上所述,剪切力作用于深层组织,对组织的损伤较大;摩擦力损害皮肤的角质层,更易产生压疮。压疮危险因素评估表可以纳入引起压疮的力学因素:垂直压力、摩擦力和剪切力,且分值依次递增。本实验基于压疮的缺血-再灌注机制,通过对大鼠受压部位的组织病理学观察及血液相应指标的检测,探讨压疮的病理生理变化,其结果有一定的指导意义。但本实验中造模较粗糙、样本量较少可能会影响实验结果的客观性和可重复性,加之国内不同压力的作用形式对压疮影响的研究较为少见,因此本实验还有待于进一步完善与探讨,而不同压力作用形式对压疮的影响及压疮评分表的完善还需进一步研究。
[1]Linder-Ganz E,Engelberg S,Scheinowitz M,et al.Pressure-time cell death threshold for albinorat skeletal muscles as related to pressure sore biomechanics[J].J Biomech,2006,39(14):2725-2732.
[2]Salcido R,Fisher S B,Donofrio J C,et al.An animal model and computer-controlled surface pressure delivery system for the production of pressure ulcers[J].J Rehabil Res Dev,1995,32(2):149-161.
[3]Bergstrom N,Braden B,Boynton P,et al.Using a research-based assessment scale in clinical practice[J].Nurs Clin North Am,1995,30(3):539-551.
[4]Bonder C S,Knight D,Hernandez-Saavedra D,et al.Chimeric SOD 2/3inhibits at the endothelial-neutrophil interface to limit vascular dysfunction in ischemia-reperfusion[J].Am J Physiol Gastrointest Liver Physiol,2004,287(3):676-684.
[5]Amemiya S,Kamiya T,Nito C,et al.Anti-apoptotic and neuroprotective effects of edaravone following transient focal ischemia in rats[J].Eur J Pharmacol,2005,516(2):125-130.
[6]Radi R,Beckman J S,Bush K M,et al.Peroynitrite-induced membrane lipid perosidation:The cytotoxic potential of peroside and nitric oxide[J].Arch Biochem Biophys,1991,288(2):481-487.
[7]谢小燕,刘雪琴.压疮的动物实验研究进展[J].解放军护理杂志,2004,21(8):52-53.
[8]Ribbe M W,Van Marum R J.Decubitus:Pathophysiology,clinical symptoms and susceptibity[J].Tissue Viability,1993,3(2):42-47.
[9]Dinsdale S M.Decubitus ulcers:Role of pressure and friction in causation[J].Arch Phys Med Rehabil,1974,55(4):147-152.

