热休克蛋白27增强A型流感病毒NS1对β干扰素的抑制作用
李铮,刘晓玲,赵振东,刘文军
1 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101
2 中国科学院研究生院,北京 100049
医学与免疫生物技术
热休克蛋白27增强A型流感病毒NS1对β干扰素的抑制作用
李铮1,2,刘晓玲1,赵振东1,2,刘文军1
1 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101
2 中国科学院研究生院,北京 100049
热休克蛋白27 (Heat shock protein 27,HSP27) 是一种具有多重功能的小热休克蛋白,它在一些病毒的生命周期中也发挥着重要作用。为研究HSP27对流感病毒感染的调节作用,首先在原核及真核细胞中克隆并表达了人源的HSP27蛋白,并验证了HSP27和A型流感病毒NS1蛋白能够相互结合。通过荧光素酶检测试验发现,HSP27可以抑制病毒感染细胞中β干扰素 (IFN-β) 的表达,但不依赖于其自身的磷酸化状态,而且HSP27与NS1共同对于IFN-β的表达具有叠加抑制效果。进一步的结果表明HSP27可能通过RIG-I样RNA解旋酶 (RLH) 途径中MDA5因子抑制IFN-β的表达。研究表明,HSP27在被感染细胞的天然免疫中发挥一定作用,有助于进一步阐明宿主因子对于流感病毒感染的调节机理。
热休克蛋白27,NS1蛋白,相互作用,β干扰素
Abstract:Heat shock protein 27 (HSP27) is a member of the small heat shock proteins (sHSP) and has multiple functions, it also plays an important role in the life cycle of some viruses. To investigate the regulatory effect of HSP27 during influenza virus infection, we cloned and expressed human HSP27 in both prokaryotic and eukaryotic cells, and demonstrated that HSP27 interacted with influenza A virus NS1 protein bothin vivoandin vitro. Luciferase assay showed that HSP27 inhibited the expression of interferon-β (IFN-β) in infected cells, and independent of its phosphorylation.Moreover, HSP27 enhanced the inhibitory effect of NS1 on the expression of IFN-β. Further analysis indicated that HSP27 exerted the inhibitory effect probably through influencing MDA5 of the RIG-I like helicase (RLH) pathway. The results suggested that HSP27 play a role in the innate immunity of infected cells, contributed to our understanding of the regulatory effect of host factors during influenza virus infection.
Keywords:heat shock protein 27, NS1 protein, interaction, interferon-β
流感病毒属于正黏液病毒科,是一种囊膜病毒。其中A型流感病毒是哺乳动物中传播的主要类型,其基因组包含8个单股负链RNA片段,编码12种蛋白,20世纪以来人类所经历的4次流感大流行全部由A型流感病毒引起,给人类带来严重危害[1-4]。流感病毒在其感染周期中,会利用多种宿主因子来辅助自身生命过程,因此,有关宿主蛋白对流感病毒感染的调节机理的研究具有十分重要的意义。
NS1蛋白是A型流感病毒NS基因编码的一种非结构蛋白,它仅在病毒感染细胞中表达。NS1蛋白在病毒感染过程中发挥多重作用,包括抑制细胞pre-mRNA的剪切和mRNA的出核[5-8],增强病毒mRNA的翻译[9-10]等;其中,NS1最重要的功能是拮抗流感病毒感染细胞的免疫反应,它通过两种机制抑制β干扰素 (IFN-β) 的表达[11]:在转录前水平,可与RLH通路中RIG-I结合,阻碍IPS-1、IRF3的激活,从而抑制IFN-β启动子的激活[12-13];在转录后水平,通过和 CPSF30及PABPⅡ结合,阻断细胞mRNA的出核,抑制IFN-β 的表达[6,14]。
热休克蛋白27 (HSP27) 是一种在细胞中广泛存在,不依赖于ATP的伴侣蛋白,属于小热休克蛋白家族的成员[15-16],它可促进受损伤或构象异常的蛋白进行重新折叠,维持细胞稳态[17]。除作为分子伴侣外,HSP27还可作为调控因子,调节细胞膜的稳定性、细胞骨架的形成、细胞增殖及凋亡、细胞周期的进行、信号转导等过程[16,18-20]。在应激条件下,HSP27的第15、78、82位丝氨酸常会发生磷酸化,且寡聚化状态发生改变,从而行使其生物学功能[16]。有研究发现,在流感病毒的病毒粒子中,可以检测到 HSP27蛋白的存在[21],而H9N2流感病毒感染后的人胃腺癌细胞AGS中,HSP27蛋白的表达上调[22],但对于 HSP27在病毒感染中所发挥的功能仍不清楚。
为了探讨 HSP27蛋白在流感病毒感染周期中的具体作用,我们分别在原核及真核细胞中克隆、表达了人源的 HSP27蛋白,验证了 HSP27和 NS1的相互作用,而且发现,HSP27可能通过RLH通路中MDA5因子,和NS1共同抑制被感染细胞中IFN-β的表达。
1 材料与方法
1.1 材料
1.1.1 载体及菌株
大肠杆菌DH5α、BL21由本实验室保存。载体 pET-28a、pGEX-4T-2、pCMV-Myc、pcDNA3-Flag,质粒 pCMV-β-gal、pIFN-β-luc、pEF-Flag-RIG-IN、pEF-Flag-mda-5H、pcDNA3.1/Zeo-MAVS、pcDNA3.1-Flag-TBK1、pIRES-hrGFP-IRF3/5D质粒由本实验室保存。
1.1.2 细胞株、病毒株
293T细胞系、流感病毒A/WSN/33、仙台病毒SeV由本实验室传代并保存。
1.1.3 主要试剂及引物
各种工具酶均购自TaKaRa公司;点突变试剂盒赠自北京诺派生物科技有限公司;DMEM培养基、胎牛血清购自Gibco公司;蛋白预染Marker购自Fermentas公司;Myc抗体购自Santa Cruz公司;Flag抗体、anti-FlAG-M2-agarose、DAPI、多聚甲醛、BSA购自 Sigma-Aldrich公司;sepharose 4B-glutathione购自GE公司;Trizol购自Invitrogen公司;β-actin抗体、FITC标记羊抗鼠IgG、TRITC标记羊抗兔IgG购自康为世纪公司;辣根过氧化物酶 (HRP) 标记羊抗鼠、羊抗兔IgG购自中杉金桥公司;HRP-DAB底物显色试剂盒购自天根生化科技有限公司;荧光素酶检测试剂盒、AMV逆转录酶购自Promega公司;邻硝基苯 β-D-半乳吡喃糖苷 (ONPG)、Triton X-100购自Amresco公司。引物由上海生工公司合成。
1.2 方法
1.2.1 HSP27表达载体的构建
取生长状态良好的 293T细胞,43 ℃热击20 min后,重新置于37 ℃培养箱中恢复培养4 h。Trizol法提取细胞总RNA。以总RNA为模板进行RT-PCR,获得cDNA。以cDNA为模板,P1、P2互为引物 (表1),PCR扩增人HSP27基因。PCR产物经EcoRⅠ、XhoⅠ双酶切,与酶切后的pCMV-Myc、pcDNA3-Flag、pGEX-4T-2载体连接,转化E. coliDH5α感受态细胞,挑取阳性克隆,经北京博迈德生物科技有限公司测序获得重组子质粒。
1.2.2 HSP27磷酸化突变体表达载体的构建
以 pcDNA3-Flag-HSP27质粒为模板,P3、P4互为引物,采用点突变试剂盒,构建获得第78、82位丝氨酸突变为丙氨酸的HSP27双突变体质粒。以该双突变体质粒为模板,P5、P6互为引物,构建获得第 15、78、82位丝氨酸突变为丙氨酸的HSP27磷酸化突变体。
1.2.3 NS1表达载体的构建
取流感病毒A/WSN/33毒株,Trizol法提取病毒RNA,以病毒RNA为模板进行RT-PCR获得病毒 cDNA。以 cDNA为模板,P7、P8互为引物 (表1),PCR扩增NS1基因。PCR产物经EcoRⅠ、XhoⅠ双酶切,与酶切后的pCMV-Myc、pcDNA3-Flag载体连接;以 P9、P10互为引物(表1) 同上述步骤酶切,与酶切后的pET28a载体连接。将连接产物转化E. coliDH5α感受态细胞,挑取阳性克隆,经北京博迈德生物科技有限公司测序获得重组子质粒。

表1 克隆HSP27、HSP27突变体以及NS1基因的引物Table 1 Primers for cloning of HSP27, HSP27-mutants and NS1
1.2.4 细胞培养与转染
293T细胞在含有 10%胎牛血清,10 000 U/mL青霉素和链霉素的 DMEM 培养基中贴壁生长,培养环境为37 ℃,5% CO2。将细胞接种于培养板中,待细胞密度为60%~80%后,进行转染。转染前1~2 h,为细胞更换新鲜培养基。采用PEI为转染试剂,根据实验要求,转染不同剂量的质粒于细胞中。转染后6~8 h更换培养基,培养约36 h后,使用细胞裂解液 (0.5%NP40,150 mmol NaCl,20 mmol Hepes pH 7.4,10%甘油,1 mmol EDTA,加入蛋白酶抑制剂cocktail) 裂解细胞并离心收集上清液,进行后续检测。
1.2.5 Western blotting检测
将收获的细胞上清液进行SDS-PAGE电泳,采用半干法将蛋白转移至 PVDF膜上。封闭液(5%脱脂奶粉、1% BSA) 室温封闭2 h。然后加入一定比例稀释的一抗,室温结合 1 h,TBST(20 mmol/L Tris-HCl,150 mmol/L NaCl,0.05%Tween20) 洗3遍;加入一定比例稀释的HRP标记二抗,室温结合45 min,TBST洗3遍。采用底物显色试剂盒进行X-ray曝光显影。
1.2.6 免疫共沉淀 (Co-IP)
接种293T细胞于10 cm细胞培养皿中,共转染 pCMV-Myc-HSP27与 pcDNA3-Flag-NS1,或pCMV-Myc-HSP27与pcDNA3-Flag于两皿细胞中,每种质粒3 μg。转染后36 h,使用1 mL细胞裂解液裂解细胞并收集上清液。加入anti-Flag-M2-agarose于上清液中,4 ℃孵育2 h,充分洗去杂蛋白,进行Western blotting检测。
1.2.7 GST-pull down
将分别转化 pET28a-NS1与 pGEX-4T-2-HSP27质粒的E. coliBL21培养至OD≈0.5~0.6,100 μg/mL IPTG诱导,16 ℃过夜培养。镍柱纯化His-NS1蛋白,sepharose 4B-glutathione纯化GST-HSP27蛋白。取 1 μg 结合于 sepharose 4B-glutathione上的GST-HSP27及GST蛋白,加入1 μg His-NS1蛋白,4 ℃孵育2 h,充分洗去杂蛋白,进行Western blotting检测。
1.2.8 免疫荧光检测HSP27和NS1的共定位
接种293T细胞于铺有玻片的24孔板中,将pcDNA3-Flag-HSP27与pCMV-Myc-NS1质粒各0.3 μg共同转染293T细胞。转染后约36 h,使用4%多聚甲醛室温固定细胞30 min,然后用含有4% BSA的TBST (PBS中加入0.5% Triton X-100) 室温封闭1 h。加入一定比例稀释的兔抗Myc、鼠抗Flag作为一抗,37 ℃结合1 h;PBST洗5次,每次10 min。然后加入一定比例稀释的荧光二抗,37 ℃结合1 h;PBST洗5次,每次10 min。加入DAPI室温染色5 min,PBST洗3次。然后在盖玻片上滴一滴封片液 (50%甘油,50% PBS),以指甲油封闭四周。激光共聚焦显微镜观察HSP27和NS1在细胞中的定位情况。
1.2.9 荧光素酶报告基因检测HSP27及NS1蛋白对于IFN-β表达的影响
接种 293T细胞于 24孔板中,每孔中转染pIFN-β-luc 0.25 μg、pCMV-β-gal 0.1 μg 及不同实验中所需质粒和对照质粒。转染后36 h,更换为无血清DMEM,并加入SeV刺激细胞,6 h后,裂解并收集细胞,以β-gal作为内参,检测细胞的luciferase活性。
1.2.10 荧光素酶报告基因检测 HSP27对于RLH通路中各因子的影响
接种 293T细胞于 24孔板中,共转染pIFN-β-luc 0.25 μg 、 pCMV-β-gal 0.1 μg 、pcDNA3-Flag-HSP27 或 pcDNA3-Flag 0.2 μg,RLH通路中各因子质粒 (pEF-Flag-RIG-IN、pEF-Flag-mda-5H、pcDNA3.1/Zeo-MAVS、pcDNA3.1-Flag-TBK1、pIRES-hrGFP-IRF3/5D)各0.2 μg。转染后36~48 h,裂解并收获细胞,以β-gal作为内参,检测细胞的luciferase活性。
2 结果
2.1 HSP27蛋白的原核及真核表达
将转化有pGEX-4T-2-HSP27的E. coliBL21培养并经 IPTG诱导后,离心并收集菌体,SDS-PAGE检测 GST-HSP27蛋白的表达。结果显示,在约53 kDa处有一条明显的蛋白条带,与GST-HSP27大小一致 (图2A)。将pCMV-Myc-HSP27与pcDNA3-Flag-HSP27转染293T细胞,36 h后收获细胞,Western blotting可检测到HSP27的表达 (图2B、2C)。
2.2 HSP27和NS1能够相互结合
将pCMV-Myc-HSP27与pcDNA3-Flag-NS1质粒转染293T细胞,采用anti-FLAG-M2-agarose结合Flag-NS1,免疫共沉淀检测HSP27和NS1蛋白的相互作用。如图 3A所示,在同时转染HSP27和 NS1的细胞裂解液中,能够检测到HSP27蛋白,说明HSP27和NS1在细胞内水平存在相互作用。
采用IPTG诱导E. coliBL21 pGEX-4T-2-HSP27、pET28a-NS1,表达并纯化 GST-HSP27及His-NS1蛋白,GST-pull down结果显示,在HSP27和 NS1蛋白同时存在的体系中,可检测到HSP27与NS1的相互作用,即二者在细胞外水平能够直接结合 (图3B)。
在293T细胞中共转染pcDNA3-Flag-HSP27与pCMV-Myc-NS1质粒后,免疫荧光检测HSP27和NS1的定位。激光共聚焦显微镜的观察结果显示,Flag-HSP27主要定位于细胞质中,Myc-NS1在细胞质与细胞核中都有分布,两者在细胞质中存在一定的共定位 (图3C)。
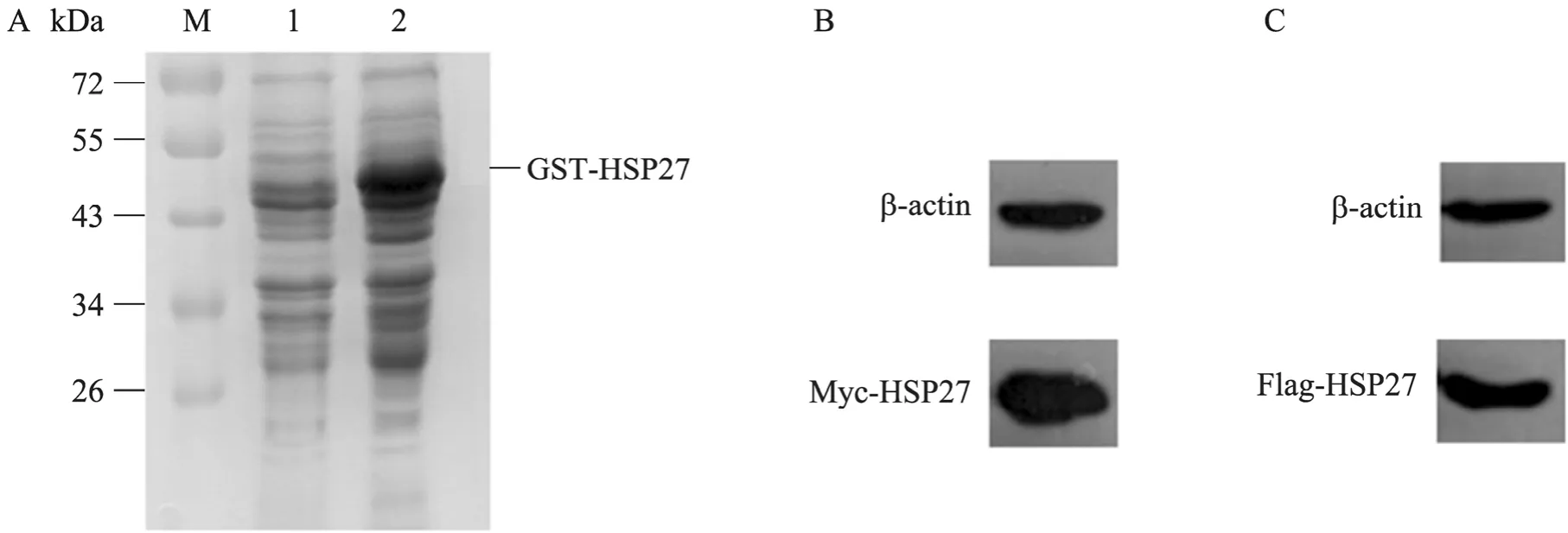
图2 HSP27蛋白在原核及真核细胞中的表达Fig.2 Expression of HSP27 in prokaryotic and eukaryotic cells. (A) Expression of GST-HSP27 inE. coliBL21. M:protein marker; 1:E. coliBL21 before induction: 2:E. coliBL21 after induction. (B, C) Expression of Myc-HSP27 and Flag-HSP27 in 293T cells.
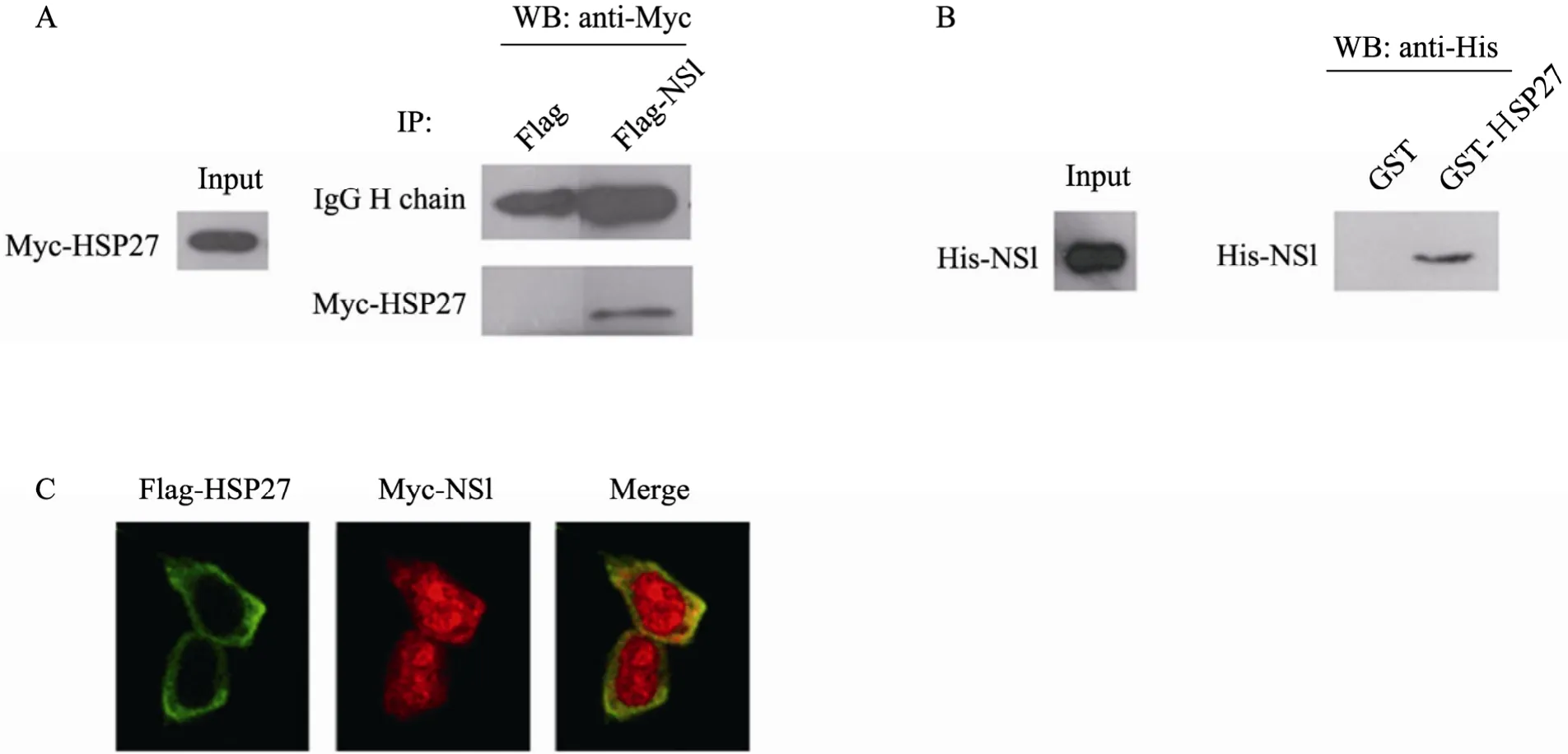
图3 HSP27和NS1的相互作用检测Fig.3 Interactions of HSP27 and NS1 bothin vivoandin vitro. (A) Co-immunoprecipitation of Myc-HSP27 and Flag-NS1 in 293T cells. (B) GST-pull down assay of GST-HSP27 and His-NS1. (C) The co-localization of Flag-HSP27 and Myc-NS1 in transfected 293T cells detected by immunofluorescence assay.
2.3 HSP27抑制细胞中IFN-β的表达
将质粒 pIFN-β-luc、pCMV-β-gal、pCMVMyc-HSP27 (0.05、0.1、0.2、0.4 μg) 同时转染293T细胞,36 h后采用SeV刺激,6 h后收获细胞,检测细胞的β-gal及luciferase活性。如图4A所示,和转染空质粒相比,在过表达 HSP27的细胞中,IFN-β的表达水平有所下降,且随着HSP27转染剂量的增加,下降程度逐渐增加。
HSP27具有15、78、82位3个丝氨酸磷酸化位点,细胞中 HSP27功能的发挥常与其磷酸化过程相关,但其3个丝氨酸磷酸化位点所各自具有的功能仍不清楚[16]。为了检测 HSP27磷酸化对 IFN-β的影响,将其第 15、78、82位丝氨酸同时突变为丙氨酸,构建 HSP27磷酸化突变体。然后将质粒 pIFN-β-luc、pCMV-β-gal、磷酸化突变体 pcDNA3-Flag-HSP27-mutant或野生型pcDNA3-Flag-HSP27同时转染293T细胞。如图4B所示,HSP27磷酸化突变体和野生型相比,对于IFN-β的抑制程度并没有显著差别,说明磷酸化并不影响HSP27对于IFN-β的抑制作用。
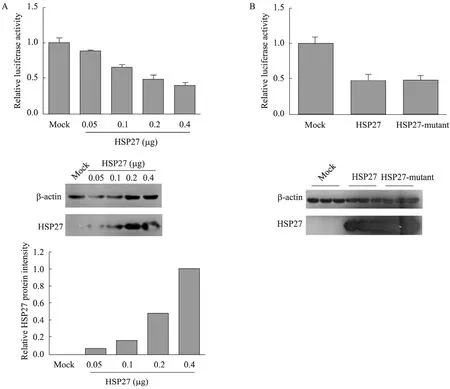
图4 HSP27及其磷酸化对于细胞中IFN-β表达的影响Fig.4 Effect of wild type HSP27 and mutant HSP27 on the expression of IFN-β. (A) Luciferase activities of 293T cells transfected with different doses of pCMV-myc-HSP27 were measured (A, upper). Both the expression and the relative protein levels of different doses of Myc-HSP27 were analyzed (A, middle and bottom). (B) Luciferase activities of 293T cells transfected with wild type and mutant HSP27 were measured (B, upper). The expression of both the wild type and mutant HSP27 were detected (B, bottom). The data of (A) and (B) is based on the results of three independent experiments, and error bars represent the standard deviation (n=3).
2.4 HSP27与NS1共同对于IFN-β的表达具有叠加抑制作用
将293T细胞分为6组,分别转染0、0.01、0.02、0.04、0.08、0.16 μg pCMV-Myc-NS1,同时转染 pIFN-β-luc、pCMV-β-gal,每组内又分为两小组,分别转染 pcDNA3-Flag-HSP27与pcDNA3-Flag。36 h后SeV感染,6 h后收获细胞,检测β-gal及luciferase活性。结果表明,随着转染剂量的增加,NS1对于IFN-β的抑制水平不断加大,在 HSP27存在的条件下,对 IFN-β具有更强的抑制效果,表明 HSP27和 NS1对IFN-β具有叠加抑制作用。在低剂量转染NS1时,该叠加效果较明显;在 NS1转染剂量较高时,HSP27发挥的叠加效果较弱 (图5)。
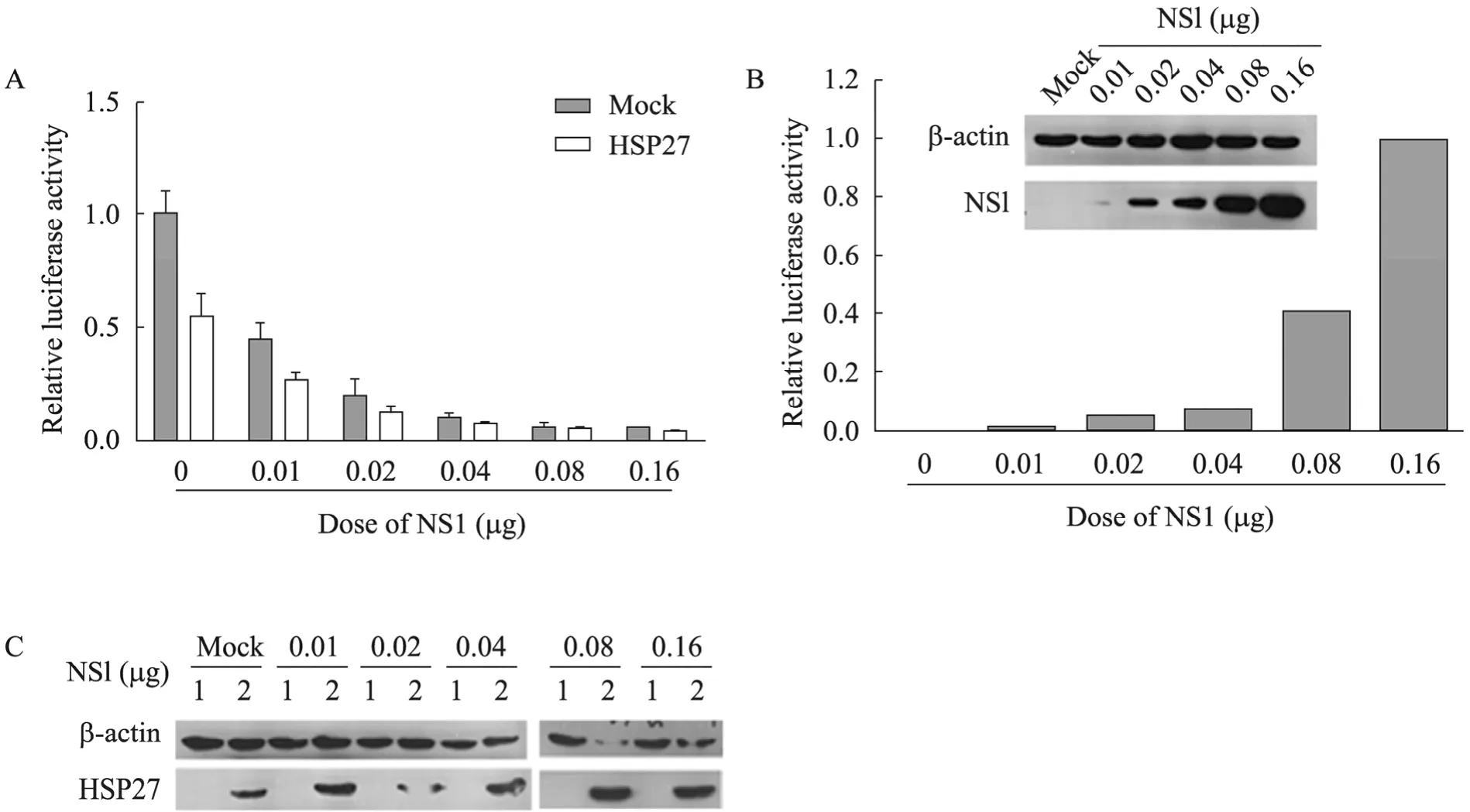
图5 HSP27与NS1共同对于IFN-β表达的影响Fig.5 The relationship of HSP27 and NS1 on the expression of IFN-β. (A) Luciferase activities of 293T cells transfected with different doses of NS1 together with HSP27. The data is based on the results of three independent experiments, and error bars represent the standard deviation (n=3). (B) Expression and relative protein levels of different doses of NS1 in transfected cells were analyzed. (C) Expression of HSP27 in transfected cells. 1: cells transfected with pcDNA3-FLAG; 2: cells transfected with pcDNA3-FLAG-HSP27. 1: cell transfected with pcDNA3-FLAG; 2: cell transfected with pcDNA3-FLAG-HSP27.
2.5 HSP27可能通过MDA5抑制IFN-β的表达
NS1可与RLH通路中RIG-I结合,抑制下游 IFN-β的表达。为了阐明 HSP27抑制 IFN-β的机理,将质粒 pEF-Flag-RIG-IN、pEF-Flagmda-5H、pcDNA3.1/Zeo-MAVS、pcDNA3.1-Flag-TBK1、pIRES-hrGFP-IRF3/5D 分别转染293T细胞,表达出RLH通路中RIG-I、MDA5、MAVS、TBK1、IRF3的活性蛋白,同时转染pIFN-β-luc、pCMV-β-gal、pcDNA3-Flag-HSP27或 pcDNA3-Flag,然后检测细胞中的 luciferase活性。结果显示,在转染RIG-I、MAVS、TBK1、IRF3的细胞中,同时过表达 HSP27对于细胞IFN-β的表达均没有显著影响;在转染MDA5的细胞中,HSP27对于IFN-β的表达水平具有显著抑制作用,说明HSP27可能通过MDA5而抑制IFN-β 的表达 (图 6A、6B)。
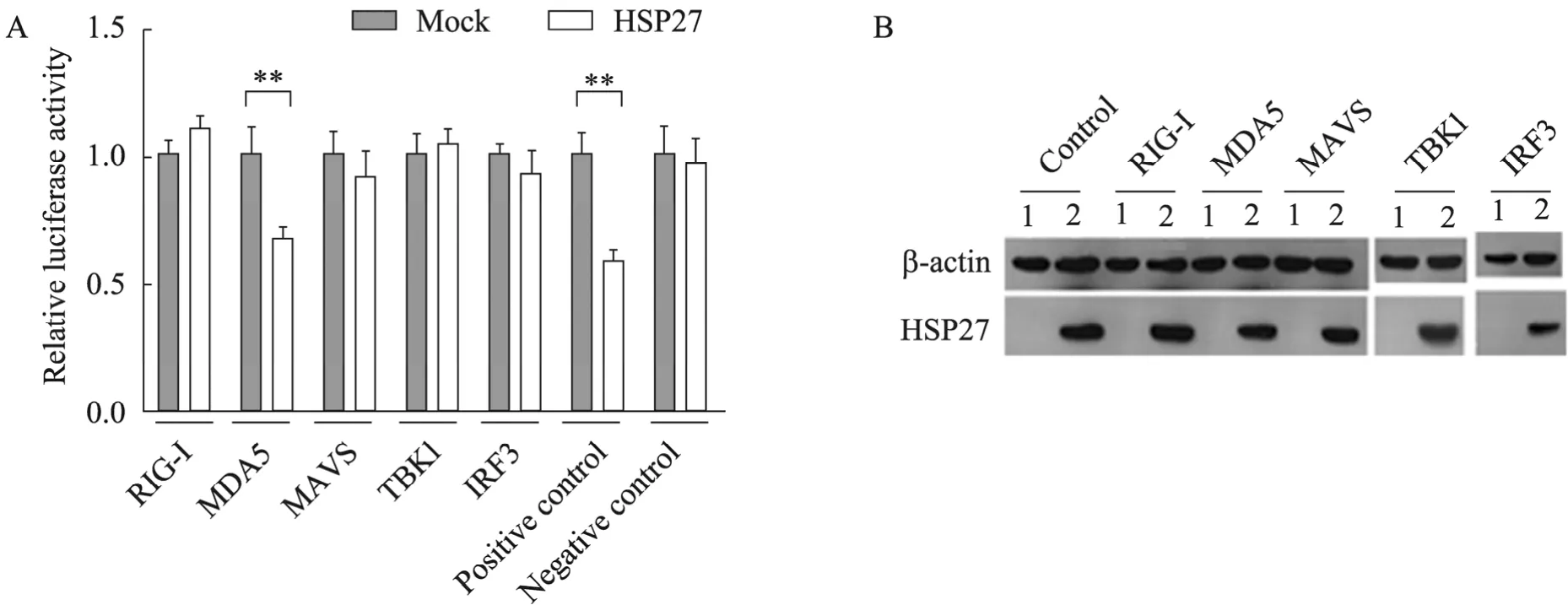
图6 HSP27对RLH通路中各因子的影响Fig.6 Analysis of target proteins of HSP27 in the RLH pathway. (A) 293T cells were transfected with different factors of RLH pathway, and luciferase activities were compared between HSP27 and mock of each factor. The data is based on the results of three independent experiments, and error bars represent the standard deviation (n=3). **P<0.01 byttest.(B) Detection of expression levels of HSP27.
3 讨论
HSP27作为一种具有多重功能的蛋白在多种病毒的感染周期中都发挥重要作用[16]。例如,HSP27的过表达及MK2/HSP27途径的激活可增强腺病毒粒子从胞质到细胞核的转运,促进腺病毒的感染[23];呼吸道合胞病毒RSV对于细胞的感染常伴随着 HSP27磷酸化水平的增加,且磷酸化的 HSP27可促进病毒的复制[24];在 HSV-1感染后,细胞中 HSP27可迅速磷酸化,改变细胞定位,并促进病毒复制[25]。虽然在流感病毒粒子中可检测到HSP27[21],但其在病毒生命周期中所起的作用尚不清楚。研究表明,HSP27可和流感病毒蛋白互作,并且通过功能试验,检测了HSP27在流感病毒感染中可能发挥的功能。
据报道,HSP27可拮抗HIV-1 Vpr蛋白的活性,抑制病毒复制[26]。流感病毒的 NS1蛋白和HIV-1 Vpr蛋白具有相似的细胞定位及功能,因此,本实验首先检测了HSP27和NS1的相互作用。通过Co-IP、GST-pull down、免疫荧光,我们证实,HSP27和 NS1在细胞内及细胞外水平都能够相互结合,而且在细胞质中存在共定位。
Ⅰ型干扰素的产生是抗病毒免疫反应的一个重要方面,细胞主要通过 Toll样受体 (TLR)途径及RIG-I样RNA解旋酶 (RLH) 途径来识别病毒[27]。而流感病毒NS1蛋白可在RLH途径中发挥作用,它可和 RIG-I结合,进而干扰下游MAVS、IRF3的激活,最终影响IFN-β启动子的激活,抑制IFN-β的产生[13]。由于HSP27和NS1存在相互作用,因此HSP27是否影响IFN-β的表达是我们需要探究的重要问题。
研究表明,HSP27以剂量依赖型式抑制病毒感染细胞中的IFN-β表达,而且不依赖于其磷酸化状态,即磷酸化并不影响 HSP27对于 IFN-β表达的抑制,因此推测这种抑制作用是由HSP27本身具有的性质来介导的,如分子伴侣活性,具体机制仍需进一步验证。由于NS1的一项重要功能即是抑制病毒感染细胞中的IFN-β表达,实验结果表明,HSP27可以和 NS1对于IFN-β的抑制作用叠加,更大程度抑制IFN-β的表达,但是由于NS1本身对于IFN-β的抑制作用非常明显,而且在病毒感染早期NS1蛋白大量表达,因此这种叠加效果比较有限,在NS1剂量较低时较为显著。另外,我们发现HSP27可能通过MDA5来发挥对于IFN-β的抑制作用,但这种抑制作用的具体机制,即HSP27可否通过影响MDA5上游对于病毒RNA的识别或下游对于MAVS等因子的招募而最终影响 IFN-β的表达仍需进一步的实验。
综上所述,研究结果表明 HSP27蛋白可参与流感病毒感染后细胞内的天然免疫过程,对于进一步了解宿主因子对于流感病毒的调节机制以及病毒感染细胞中天然免疫反应具有一定的指导意义。
REFERENCES
[1] Whittaker GR. Intracellular trafficking of influenza virus: clinical implications for molecular medicine.Expert Rev Mol Med, 2001, 2001: 1−13.
[2] Chen WS, Calvo PA, Malide D, et al. A novel influenza A virus mitochondrial protein that induces cell death. Nat Med, 2001, 7(12):1306−1312.
[3] Wise HM, Foeglein A, Sun JC, et al. A complicated message: identification of a novel PB1-related protein translated from influenza A virus segment 2 mRNA. J Virol, 2009, 83(16): 8021−8031.
[4] Fukuyama S, Kawaoka Y. The pathogenesis of influenza virus infections: the contributions of virus and host factors. Curr Opin Immunol, 2011, 23(4):481−486.
[5] Nemeroff ME, Barabino SML, Li YZ, et al.Influenza virus NS1 protein interacts with the cellular 30 kDa subunit of CPSF and inhibits 3'end formation of cellular pre-mRNAs. Mol Cell, 1998,1(7): 991−1000.
[6] Chen ZY, Li YZ, Krug RM. Influenza A virus NS1 protein targets poly(A)-binding protein II of the cellular 3'-end processing machinery. EMBO J,1999, 18(8): 2273−2283.
[7] Qiu Y, Krug RM. The influenza virus NS1 protein is a poly(A)-binding protein that inhibits nuclear export of mRNAs containing poly(A). J Virol,1994, 68(4): 2425−2432.
[8] Fortes P, Beloso A, Ortín J. Influenza virus NS1 protein inhibits pre-mRNA splicing and blocks mRNA nucleocytoplasmic transport. EMBO J,1994, 13(3): 704−712.
[9] de la Luna S, Fortes P, Beloso A, et al. Influenza virus NS1 protein enhances the rate of translation initiation of viral mRNAs. J Virol, 1995, 69(4):2427−2433.
[10] Burgui I, Aragón T, Ortín J, et al. PABP1 and eIF4GI associate with influenza virus NS1 protein in viral mRNA translation initiation complexes. J Gen Virol, 2003, 84(Pt 12): 3263−3274.
[11] Hale BG, Randall R E, Ortín J, et al. The multifunctional NS1 protein of influenza A viruses.J Gen Virol, 2008, 89(Pt 10): 2359−2376.
[12] Mibayashi M, Martínez-Sobrido L, Loo YM, et al.Inhibition of retinoic acid-inducible geneI-mediated induction of beta interferon by the NS1 protein of influenza A virus. J Virol, 2007, 81(2):514−524.
[13] Opitz B, Rejaibi A, Dauber B, et al. IFNβ induction by influenza A virus is mediated by RIG-I which is regulated by the viral NS1 protein. Cell Microbiol,2007, 9(4): 930−938.
[14] Kochs G, García-Sastre A, Martínez-Sobrido L.Multiple anti-interferon actions of the influenza A virus NS1 protein. J Virol, 2007, 81(13):7011−7021.
[15] Arrigo AP. The cellular "networking" of mammalian Hsp27 and its functions in the control of protein folding, redox state and apoptosis. Adv Exp Med Biol, 2007, 594: 14−26.
[16] Kostenko S, Moens U. Heat shock protein 27 phosphorylation: kinases, phosphatases, functions and pathology. Cell Mol Life Sci, 2009, 66(20):3289−3307.
[17] Welsh MJ, Gaestel M. Small heat-shock protein family: function in health and disease. Ann N Y Acad Sci, 1998, 851: 28−35.
[18] Kostenko S, Johannessen M, Moens U.PKA-induced F-actin rearrangement requires phosphorylation of Hsp27 by the MAPKAP kinase MK5. Cell Signal, 2009, 21(5): 712−718.
[19] Matsushima-Nishiwaki R, Takai S, Adachi S, et al.Phosphorylated heat shock protein 27 represses growth of hepatocellular carcinoma via inhibition of extracellular signal-regulated kinase. J Biol Chem, 2008, 283(27): 18852−18860.
[20] Wu R, Kausar H, Johnson P, et al. Hsp27 regulates Akt activation and polymorphonuclear leukocyte apoptosis by scaffolding MK2 to Akt signal complex. J Biol Chem, 2007, 282(30):21598−21608.
[21] Shaw ML, Stone KL, Colangelo CM, et al. Cellular proteins in influenza virus particles. PLoS Pathog,2008, 4(6): e1000085.
[22] Liu N, Song WJ, Wang P, et al. Proteomics analysis of differential expression of cellular proteins in response to avian H9N2 virus infection in human cells. Proteomics, 2008, 8(9):1851−1858.
[23] Suomalainen M, Nakano MY, Boucke K, et al.Adenovirus-activated PKA and p38/MAPK pathways boost microtubule-mediated nuclear targeting of virus. EMBO J, 2001, 20(6):1310−1319.
[24] Singh D, McCann K L, Imani F. MAPK and heat shock protein 27 activation are associated with respiratory syncytial virus induction of human bronchial epithelial monolayer disruption. Am J Physiol Lung Cell Mol Physiol, 2007, 293(2):L436−L445.
[25] Mathew S S, Della Selva M, Burch A D.Modification and reorganization of the cytoprotective cellular chaperone Hsp27 during herpes simplex virus type 1 infection. J Virol, 2009,83(18): 9304−9312.
[26] Liang D, Benko Z, Agbottah E, et al. Anti-vpr activities of heat shock protein 27. Mol Med, 2007,13(5/6): 229−239.
[27] Takeuchi O, Akira S. MDA5/RIG-I and virus recognition. Curr Opin Immunol, 2008, 20(1):17−22.
Heat shock protein 27 enhances the inhibitory effect of influenza A virus NS1 on the expression of interferon-β
Zheng Li1,2, Xiaoling Liu1, Zhendong Zhao1,2, and Wenjun Liu1
1CAS Key Laboratory of Pathogenic Microbiology and Immunology,Institute of Microbiology,Chinese Academy of Sciences,Beijing100101,China
2Graduated University of Chinese Academy of Sciences,Beijing100049,China
李铮, 刘晓玲, 赵振东, 等. 热休克蛋白27增强A型流感病毒NS1对β干扰素的抑制作用. 生物工程学报, 2012, 28(10):1205−1215.
Li Z, Liu XL, Zhao ZD, et al. Heat shock protein 27 enhances the inhibitory effect of influenza A virus NS1 on the expression of interferon-β. Chin J Biotech, 2012, 28(10): 1205−1215.
Received:April 9, 2012;Accepted:May 7, 2012
Supported by:National Natural Science Foundation of China (No. 81101253), National Basic Research Program of China (973 Program) (No.2012CB955501-06).
Corresponding author:Wenjun Liu. Tel: +86-10-64807497; Fax: +86-10-64807503; E-mail: liuwj@im.ac.cn
国家自然科学基金 (No. 81101253),国家重点基础研究发展计划 (973计划) (No. 2012CB955501-06) 资助。