高等植物葡萄糖-6-磷酸脱氢酶的研究进展
于定群,汤浩茹,张勇,罗娅,刘泽静
四川农业大学园艺学院,四川 雅安 625014
综 述
高等植物葡萄糖-6-磷酸脱氢酶的研究进展
于定群,汤浩茹,张勇,罗娅,刘泽静
四川农业大学园艺学院,四川 雅安 625014
葡萄糖-6-磷酸脱氢酶是植物戊糖磷酸途径中的一个关键性调控酶。其主要生理功能是产生供生物合成需要的 NADPH及一些中间产物;此外还参与各种生物和非生物胁迫的应答反应。文中主要从葡萄糖-6-磷酸脱氢酶同工酶与调节机制等方面探讨了其生物学功能,再从胁迫耐受、基因克隆、酶的缺失和替代等方面的研究进行综述, 并对已发表的高等植物中的G6PDH氨基酸序列进行聚类分析,为今后该酶的研究提供参考。
葡萄糖-6-磷酸脱氢酶,胁迫耐受,基因克隆,缺失替代,聚类分析
Abstract:Glucose-6-phosphate dehydrogenase (G6PDH) catalyzes the first and rate-limiting step of the oxidative pentose phosphate pathway, existing in both cytosolic and plastidic compartments of higher plants. Its main function is to provide reducing power (NADPH) and pentose phosphates for reductive biosynthesis and maintenance of the redox state of the cell. In addition, the expression of this enzyme is related to different biotic and abiotic stresses. In this review, we analyzed the isoenzyme, regulation and biological function of G6PDH. Meanwhile, we summarized the progress work of G6PDH involved in stress resistance, gene cloning, enzyme-deficiency and cluster analysis. Problems should be solved were also discussed.
Keywords:G6PDH, stress tolerance, gene cloning, enzyme-deficiency, cluster analysis
戊糖磷酸途径是植物体中糖代谢的重要途径,其主要生理功能是产生还原性的供生物合成需要的NADPH[1-2],以及可供核酸代谢的磷酸戊糖和氨基酸与脂肪酸合成的一些中间产物[3];同时在保持植物细胞的氧化还原平衡方面也起到非常重要的作用[4-6]。葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase,G6PDH,EC1.1.1.49) 催化戊糖磷酸途径的第一步不可逆氧化反应,是关键性调控酶[7](图 1)。动物体内G6PDH为X染色体连锁遗传,它的缺乏会导致红细胞代谢紊乱[8]、视网膜血管堵塞[9]、酮病[10]等,严重者会危及生命。而它的过表达会引起人体脂质代谢异常[11],却能增加果蝇的寿命[12]。在植物中,许多研究者从多种途径研究其与植物生长发育及各种环境胁迫的关系,以期更清楚地阐述戊糖磷酸途径及该酶可能的生理功能。文中就G6PDH的生物学特性、对各种逆境环境的响应机制、基因克隆、酶的缺失替代等方面的研究进行综述,并对已发表的高等植物中的G6PDH氨基酸序列进行聚类分析,为今后该酶的研究提供参考。

图1 G6PDH参与植物体内戊糖磷酸途径及抗氧化代谢示意图Fig.1 Role of G6PDH as rate-limiting step of the PPP for biosynthesis and anti-oxidant activity in higher plants.GS-SG: oxidized glutathione; GSH: reduced glutathione; Glc: glucose; Suc: sucrose; Hex: hexoses; G6P:glucose-6-phosphate; 6PG: 6-phosphogluconate; Ru5P: ribulose-5-phosphate; R5P: ribose-5-phosphate; E4P:erythrose-4-phosphate; SOD: superoxide dismutase; GR: glutathione reductase; GPx: glutathione peroxidase; CAT:catalase.
1 G6PDH的生物学特性研究
G6PDH是磷酸戊糖途径的限速酶,控制着这条途径的碳流和还原力NADPH的产生[13-14]。G6PDH催化产生的NADPH不仅为细胞内某些生物大分子的生物合成提供了还原力,而且是还原型谷胱甘肽 (Glutathione,GSH) 再生的唯一还原力[15],因此G6PDH在细胞抵抗氧化胁迫的过程中起着重要的作用。
1.1 植物G6PDH同功酶类
在所有植物的胞质和质体中几乎都能检测到高浓度的G6PDH同工酶[16]。质体G6PDH氨基酸序列比胞质G6PDH多一段约60个氨基酸左右的转运肽序列,该序列具有组织特异性,在不同的植物,即使同一植物体内同工酶间的这段序列差异也较大 (图 2)。目前,已在植物中发现了多种形式的G6PDH的同工酶类型,如在拟南芥中发现了6种G6PDH的同工酶类型,其中2种为胞质,4种为质体类型[17]。根据其氨酸序列的差异及蛋白免疫特性,又可将质体G6PDH分为两类:P1类型和P2类型。P1的主要特性是被还原失活;P2相对不易受到NADPH的反馈抑制。而且P2具有比P1更高的活性,P1仅在叶片等绿色组织中表达较高,P2在大多数组织中都有较高的表达,尤其在根中表达量最高[18]。
1.2 植物G6PDH的调控
植物同时存在胞质和质体氧化戊糖磷酸途径。虽然G6PDH在提供NADPH过程中扮演着重要的角色,但胞质中的G6PDH没有变构调节的性质,而可能受到其他复杂的调控。而质体类型的G6PDH除了受到NADPH的反馈抑制之外,还受到硫氧还原蛋白/铁氧还原蛋白系统的调节[19]。此外,其他环境因子,如:光照、氮同化、氧化胁迫、高盐、病原菌、糖等,也会在mRNA水平或酶活力水平调控 G6PDH酶活力。Hauschidl和von Schaewen[20]发现,胞质G6PDH活性不受渗透压变化、磷酸化及氧化胁迫的影响,而质体G6PDH的活性受磷酸化及光暗条件的影响。因为在光下,光合作用提供充足的NADPH,为了避免无效耗能,质体G6PDH往往钝化失活。除了这种反馈抑制外,Ben和Anderon[21]还发现,光照可以调节G6PDH从叶绿体类囊体中释放入基质,从而实现对该酶的调控。
近年来,基因组水平上的分析表明,G6PDH酶活力还受到细胞内氧化还原环境的调节。Wenderoth等[22]发现,如果将马铃薯质体G6PDH氨基酸中的Cysl49和Cysl57中的任何一个替换为Ser,该酶活性就不再受氧化还原调节,证明了这两个 Cys残基为氧化还原调节位点。为了查明质体G6PDH氧化还原位点的保守性,Wendt等[23]比较了来自马铃薯、烟草、菠菜等8种植物与红藻、绿藻共10个G6PDH氨基酸序列,发现质体G6PDH的辅酶结合区存在6个 Cys残基,其中 3个是非常保守的,包括Cysl49和Cysl57。说明,保守氨基酸序列中Cys的氧化还原修饰也是 G6PDH酶活力的调控方式之一。

图2 不同来源的G6PDH氨基酸序列比对Fig.2 Amino acid sequence alignment of G6PDHs from different kinds of organisms.Arabidopsis thaliana: AtCy,At3g27300.1; AtP, At5g35790.1; AtP2, At5g13110.1.Hordeum vulgare: HvP2, CAL44728.Populus trichocarpa: PtP2,estExt_Genewise1_v1.C_LG_I7789.Dunaliella bioculata: Db, AJ132346.Homo sapiens: HsCy, NP_001035810.1. Pentagram:cysteine residues.
2 G6PDH与植物生长发育及各种环境胁迫的关系
植物处于各种各样的环境之中,许多研究报道认为,G6PDH的活性涉及到植物细胞内许多生理生化过程以及对不同环境胁迫耐受的过程。
2.1 G6PDH与植物生长发育
在与植物生长发育的关系方面,研究较多的是G6PDH酶活力与种子发芽、休眠和一些次级代谢产物等的关系。赵永华等[24]发现,呼吸抑制剂NaN3可以增加西洋参种子萌发过程中G6PDH的活性,加速西洋参种子休眠的解除,且低温能促进NaN3的这种作用。Huang等[25]研究发现,水稻G6PDH基因在幼穗中的表达明显高于根、叶和胚,表明水稻G6PDH与穗发育密切相关,可能是水稻幼穗 PPP代谢活跃为其发育提供所需的磷酸戊糖和其他一些中间产物。徐一兰等[26]研究也发现,油菜开花后G6PDH活性逐渐增加,花后24~31 d达最高峰,并且与含油量也呈极显著正相关。陈超[27]还发现,G6PDH还具有抗氧化作用,能够延长红豆杉细胞活力,从而提高紫杉醇产量。
在植物生长发育过程中,戊糖磷酸途径是普遍存在的一条糖的分解代谢途径,但在不同的组织中所占的比重不同[28]。它除提供能量外,还为其他生物合成提供多种原料。G6PDH通过调控戊糖磷酸途径的代谢通量,从而为油料作物脂肪酸合成提供NADPH,促进含油量增加;为某些代谢活跃的组织中核苷酸的合成提供 5-磷酸核糖,为芳香族氨基酸合成提供4-磷酸赤藓糖。此外,此途径生成的核酮糖-5-磷酸可转化为核酮糖-1,5-二磷酸参与光合作用,增加糖类物质的积累。G6PDH正是通过促进这些物质生成,从而促进细胞生长,调控生长发育。
2.2 G6PDH参与植物生物胁迫的应答
G6PDH与其他防御反应指标酶类似,参与植物防御反应,因它能提供更多的还原力NADPH,所以能减轻过敏反应中的氧胁迫。叶建仁等[29]研究松树针叶组织G6PDH活性和抗松针褐斑病的关系,发现抗病针叶中的G6PDH活性明显高于感病针叶,并认为植物染病时,戊糖磷酸途径的中间产物可能与抗病过程中防卫反应有关。Sindelar和Sindelarova[30]用马铃薯花叶病毒侵染烟草后发现,随着侵染时间延长,胞质和质体G6PDH酶活力均呈线性增加。
植物受到病原微生物侵染后,机体内发生一系列的变化,主要表现在细胞死亡和活性氧产生。一方面细胞的死亡可以有效地阻止病原菌侵染和传播;另一方面机体内发生一系列的抗氧化代谢,产生活性氧。Scharte等[6]和 Asai等[31]研究发现,植物在病原菌侵染后,伴随着过敏性细胞死亡和活性氧产生,G6PDH酶活力增加。G6PDH催化产生的 NADPH可以直接通过质膜上的NADPH氧化酶的作用脱氢,清除活性氧;也可以通过细胞内一系列抗氧化酶的相互作用,清除活性氧,消除细胞危害 (图1)。
2.3 G6PDH参与植物非生物胁迫的应答
在低温胁迫方面,Sagisak[32]研究发现,在低温贮藏下杨树枝条内G6PDH活性明显增加,而这种酶的钝化或失活会导致枝条冻害的发生;Lin等[7]在杨树中发现,G6PDH可能参与超氧化物歧化酶 (Superoxide dismutase,SOD) 和过氧化物酶 (Peroxidase,POD) 活性的调节和抗冻性的低温诱导。在盐胁迫方面,王晓敏[15]发现不仅在盐胁迫而且在正常的生长环境下,G6PDH对维持细胞内的GSH水平都起着非常重要的作用;Valderrama和 Corpas[33]发现,盐胁迫导致了G6PDH和其他脱氢代谢酶类的活性增加,从而降低活性氧水平,由此说明,G6PDH是植物抗盐氧化过程中的一个抗性酶;Nemoto和Sasakuma[34]发现,0.15 mol/L NaCl处理 2 h 之后,小麦G6PDH表达量开始积累,到12 h时达到最大值。此外,在紫花苜蓿受重金属铜胁迫[35],大豆受干旱胁迫时[36],也发现G6PDH的活性有不同程度的提高。
植物在不适宜的环境时会产生一系列的应答反应,活性氧的产生便是其中之一。G6PDH催化产生 NADPH通过与其他抗氧化酶 SOD、POD、过氧化氢酶 (Catalase,CAT)、谷胱甘肽还原酶 (Glutathione reductase,GR)、谷胱甘肽过氧化物酶 (Glutathione peroxidase,GPx) 等的相互作用清除有害的活性氧 (图1)。如果生物体缺乏这些保护酶机制,则很难在逆境中存活。
3 植物G6PDH基因的克隆及表达
1994年,Graeve等[37]首次从马铃薯的cDNA文库中分离了马铃薯胞质G6PDH基因,该基因与动物[38]、酵母[39]中获得的G6PDH的核苷酸相似性明显高于细菌来源的G6PDH基因,推导的氨基酸序列缺少转运肽序列以及其对二硫苏糖醇 (Dithiothreitol,DTT) 的不敏感都证明了该cDNA编码的是胞质G6PDH。1995年,Fahrendorf等[40]克隆得到苜蓿G6PDH基因,该基因的氨基酸序列没有转运肽序列,也没有相应得氧化还原Cys位点,属于胞质基因。2000年,Nemoto和Sasakuma[34]利用DDRT-PCR技术结合RACE的方法克隆得到小麦胞质G6PDH基因。随后,Schaewen等[41]利用RT-PCR结合RACE技术首次得到了来源于马铃薯的质体G6PDH基因,其氨基酸序列 N 端明显长于胞质基因,推测其为转运肽序列。Knihgt等[42]在烟草中获得了质体G6PDH基因,并且还得到了该基因的基因组序列。序列比对分析表明,该基因属于 P2类的质体G6PDH,其基因组大小为7 kb,包括10个外显子,编码593个氨基酸,IDHYLGKE是G6PDH的底物激活位点,在该基因的上游找到了可能的RNA聚合酶II结合位点 (TATA box) 和2个可能的重要启动子元件,一个是与亚硝酸盐调节有关的 NIT2结合位点 (TATCTA/G),另一个是热激因子结合位点HSF (AGAAA)。他们发现,在烟草根和叶片中,KNO3能诱导该基因增强表达,而且根诱导增强的倍数要高于叶。随着生物技术的发展,黄骥等[25]和 Hou等[43]利用新型电子克隆的方法分别克隆得到水稻胞质和质体G6PDH基因。最近,林元震等[44-45]克隆了杨树的G6PDH基因并获得该基因上游的启动子序列,该序列具有启动子的基本元件TATA-box、CAAT-box,而且还包含多个胁迫诱导元件,如低温诱导元件LTR,盐诱导元件GT-1,抗冻、缺水、脱落酸、抗寒元件MYB和MYC,以及光响应元件L-box、G-box、3AF-1、TC丰富区等。这些研究从基因的角度印证该酶参与各种环境胁迫的应答。
目前已在为数不多的植物中分离了G6PDH基因,但是随着基因组学和测序技术的发展,将会获得越来越多的G6PDH基因,为通过转基因技术改良植物品种奠定基础。
4 植物G6PDH的缺失和替代
随着 Hannond等[46]、Zamore等[47]和 Gisela[48]RNAi作用机制模型的提出,RNAi已被广泛用作研究基因功能的一种手段[49-51]。早在 2004年,Debnam等[52]研究了在转入内源的质体 P2型的G6PDH基因的有义链和无义链后发现,转基因烟草中P2型G6PDH基因的表达发生了巨大的改变,但对胞质G6PDH酶活力并没有显著的影响。并且发现,转入有义链的比转入无义链的蔗糖、葡萄糖和果糖的含量高。接着,Scharte等[6]将拟南芥根在氮饥饿诱导中高度表达的质体 P2型G6PDH基因,经过改造后转入易感病型烟草,用于胞质型G6PDH基因的表达,并使用RNAi技术干扰其内源的胞质G6PDH基因表达,由此获得了胞质G6PDH同工替代植株。研究发现,胞质同工替代酶提高了植物的防御能力,增强了植物的抗性。有意思的是在同工替代的植株中,同工替代酶的含量降低,说明同工替代系植株的抗性和酶含量是两个独立的过程,并且酶的质量而非数量对植物非常重要。他们认为同工替代酶在优化代谢途径方面显示出更大的潜力。最近,Asai等[31]将内源的胞质类型的G6PDH基因和两种质体类型的G6PDH基因 (P1和P2) 分别转入烟草,干扰内源基因的表达,发现在P2型基因沉默的植株过敏性细胞死亡和活性氧等物质含量下降,认为质体P2型G6PDH与植物过敏性细胞死亡和活性氧的产生相关。
5 已报道的植物G6PDH的关系
参照Cardi等[53]的方法,利用从NCBI蛋白质序列数据库中搜索获得的拟南芥质体P2-G6PDH的蛋白质序列,采用 BlastP 或者tblastn的方式在NCBI数据库中和其他基因组数据库中进行搜索。所有的数据获得来自 NCBI database (http://www.ncbi.nlm.nih.gov),Arabidopsis thaliana(http://www.arabidopsis.org/),Oryza sativa(http://rice.plantbiology.msu.edu/),Sorghum bicolor(http://genome.jgipsf.org/Sorbi1/Sorbi1.home.html),Populus trichocarpa(http://genome.jgipsf.org/poptr1_1/Poptr1_1.home.html)。核苷酸序列比对采用 ClustalW (www.ebi.ac.uk/Tools/clustalw2/index.html),分子量和等电点的采用ExPASy (http://www.expasy.org/tools/pi_tool.html),转运肽切割位点采用 ChloroP[54]和 TargetP[55]预测,系统发育树的构建采用 MEGA 4的 NJ构建[56]。
将拟南芥胞质、质体P1和P2三种类型,大麦 P2类型,杨树 P2类型,杜氏藻以及人的G6PDH氨基酸序列进行序列比对。其分别代表单/双子叶植物、木本植物、低等植物、哺乳动物以及胞质、P1、P2三种类型的G6PDH氨基酸序列的差异,结果见图2。不同来源G6PDH的序列比对发现,胞质和质体源于不同的进化历程。胞质 G6PDH约含有 510个氨基酸,分子量约58 kDa;P2比 P1多 10个左右氨基酸,约含有590个氨基酸,分子量约为66 kDa。质体氨基酸序列在N-端比胞质G6PDH多一段约60个氨基酸左右的转运肽序列,该序列在被运输入质体之后将被切除,切后的蛋白质序列与胞质的蛋白质类似。7种 G6PDH序列均含有保守的 rossman结构域、活性部位以及 NADP+结合位点。这结果与Wakao和Benning[17]以及Cardi等[53]的结果一致,但与 UniProtKB/Swiss-Pro数据库的数据不同,因此有必要对该酶的蛋白质结构进行深入研究。此外,在保守的 NADP+结合位点结构中第3位的氨基酸不同,在胞质中为苯丙氨酸,而在质体和人体中则为亮氨酸,这可能与特定区域NADP+的结合有关。
根据拟南芥 P2序列分析质体序列中的半胱氨酸的保守性,发现 5个半胱氨酸残基,即Cysl38、Cysl68、Cys176、Cys187 和 Cys235。其中Cysl68、Cys176、Cys187在高等植物及藻类植物中都是高度保守的。Cysl38在一些植物的 P1中为色氨酸,在藻类中为亮氨酸;而Cys235在一些植物的P1中为丝氨酸氨酸,在藻类中为甘氨酸。而且藻类与质体类型G6PDH氨基酸序列相似性大,支持绿藻是高等植物祖先的观点。
已报道的37条高等植物G6PDH氨基酸序列聚类结果见图3,序列的分子量、等电点及预测的转运肽切割位点见表1。所选择的37条序列相似性从80%~99%,可聚为3类,即Cluster I为胞质类型、Cluster II为质体P2类型和Cluster III质体P1类型。Cluster I包含单子叶植物和双子叶植物2个子群,各类群内序列相似性大。单子叶植物子群包含禾本科大麦、小麦、玉米、高粱等植物,双子叶子群包含拟南芥、烟草、马铃薯、杨树等植物。在质体类型Cluster II和Cluster III中同样如此。植物胞质或质体同一类型的酶氨基酸序列可能会有多条,如杨树质体P2和拟南芥的胞质中发现两条G6PDH序列,这可能源于基因的特殊复制事件。这些与Wakao和Benning[17]、Asai等[31]和Cardi等[54]的研究结果一致。此外,等电点预测结果表明,P2的等电点大于P1的等电点大于胞质的等电点,这可能与其适应不同的环境以及酶活性调控有关。
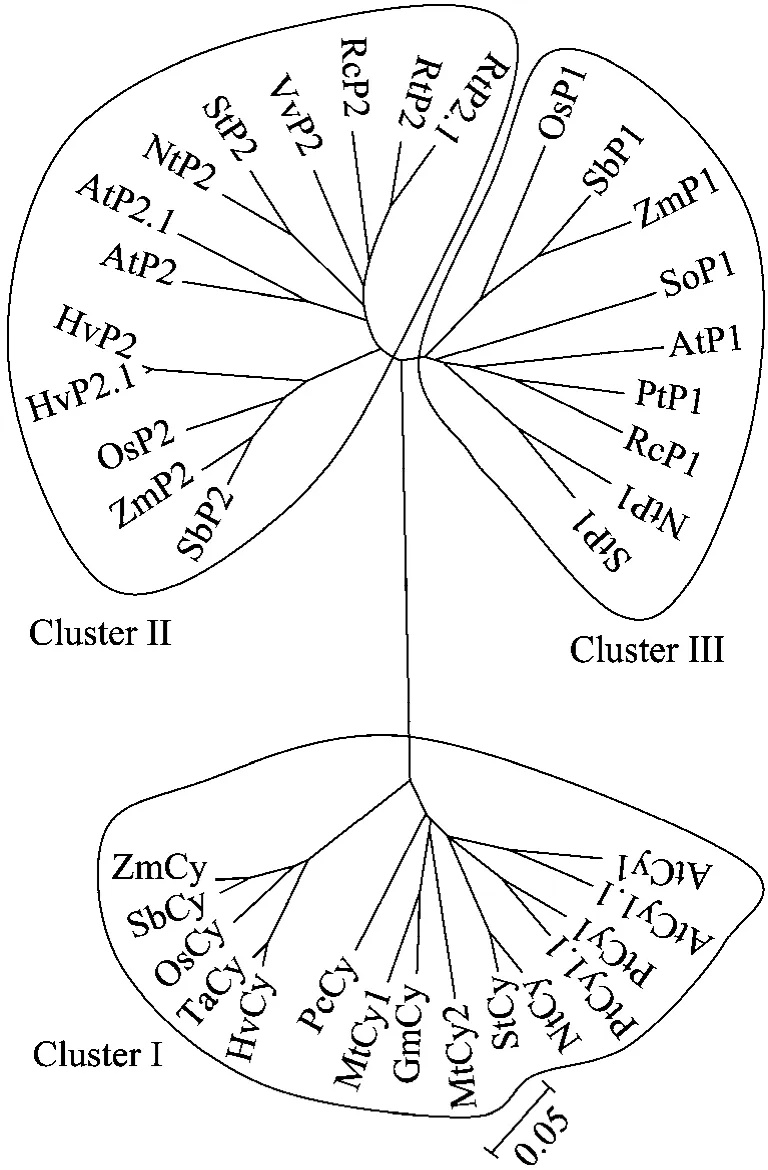
图3 高等植物37条G6PDHs的聚类分析Fig.3 Cluster analysis of 37 G6PDHs in higher plants.Cy: cytosolic-G6PDH; P1: P1-G6PDH; P2: P2-G6PDH.

表1 序列名称和登录号Table 1 Sequence and accession number
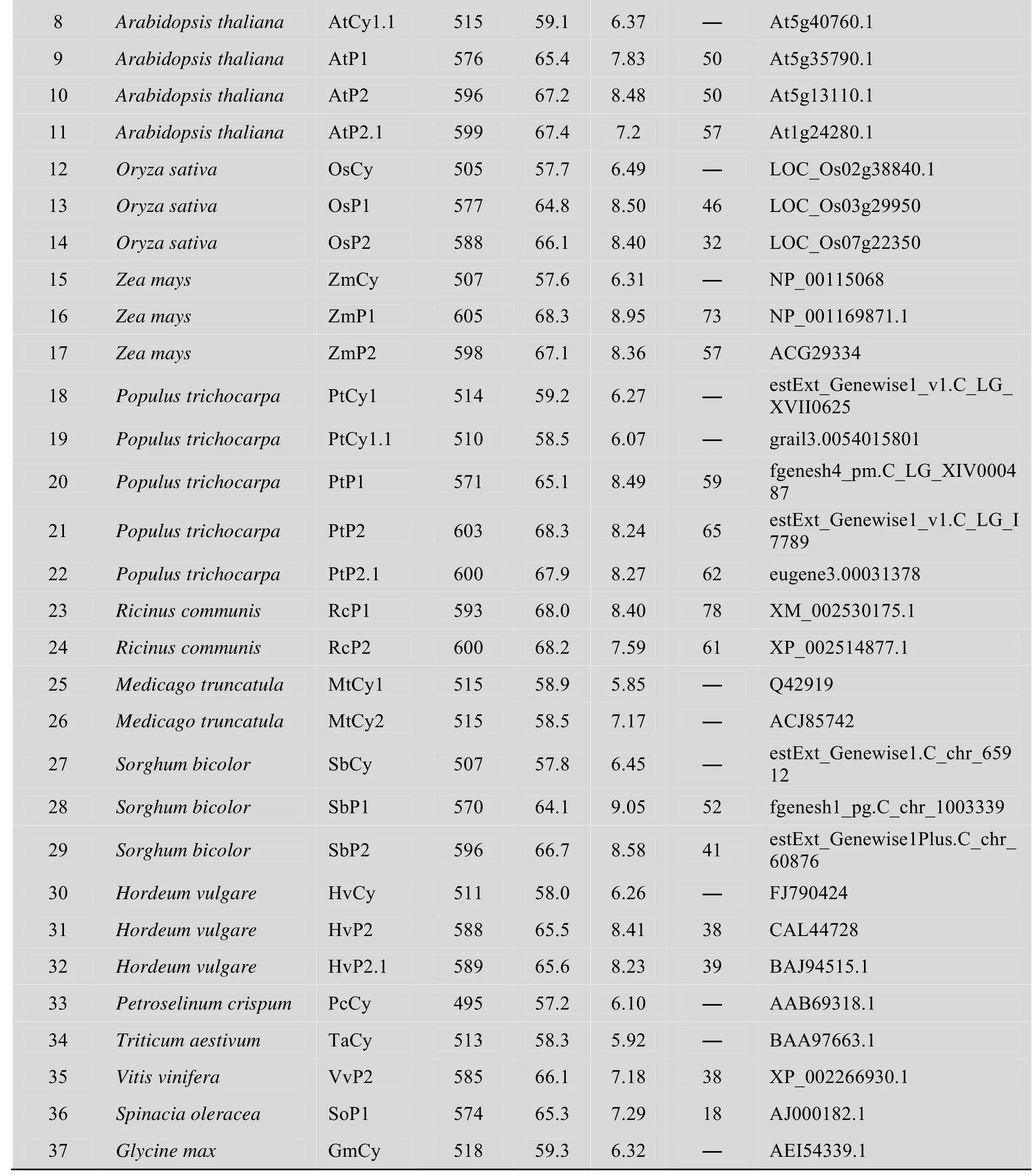
续表1
6 展望
虽然随着基因组和蛋白质组的发展,许多研究者获得了大量转录序列,但是分析催化特定生化通路中单一路径反应的酶,仍然是一种十分重要的策略[57]。
已有研究报道人体的G6PDH晶体结构[58]及三维结构模型[59],以探讨G6PDH缺失突变体对机体的影响。但植物G6PDH结构的研究目前还未见报道。G6PDHs作为植物PPP途径中起关键性调控酶,对其结构研究将有助于更深入了解该酶调控机制,从而进一步了解此G6PDHs在植物中的规律和功能,为基因改良植物做准备。
虽然众多研究认为质体P2型G6PDHs在植物中发挥着重要的作用,推测其可能是因为质体G6PDH保守氨基酸序列中的Cys残基的氧化还原修饰有关,但其半胱氨酸的具体氧化还原调节的分子机理仍然不清楚。因此,今后有必要对其进行深入研究,以了解其具体调控机制。
由于RNAi具有高度的序列专一性和有效的干扰活力,因此,它可以在不破坏基因结构或不引起基因突变的情况下,敲除某种基因,以研究它的功能。已有研究表明RNAi能够在哺乳动物中抑制特定基因的表达,制作多种表型,而且抑制基因表达的时间可以控制在发育的任何阶段,产生类似基因敲除的效应。但是,它用于转基因植物G6PDHs的研究才刚刚开始。因此,有必要运用这种新技术,研究各种质体和胞质G6PDHs基因参与植物生长发育及抵抗各种生物和非生物的环境胁迫的调控机制,将有利于我们全面地认识G6PDH的功能。
REFERENCES
[1] Esposito S, Massaro G, Vona V, et al. Glutamate synthesis in barley roots: the role of the plastidial glucose-6-phosphate dehydrogenase. Planta, 2003,216: 639−647.
[2] Hutchings D, Rawsthorne S, Emes MJ. Fatty acid synthesis and the oxidative pentose phosphate pathway in developing embryos of oilseed rape(Brassica napusL.). J Exp Bot, 2005, 56(412):577−585.
[3] Huang J, Wang JF, Zhang HS. Advances on plant pentose phosphate pathway and its key enzymes.Chin Bull Bot, 2004, 21(2): 139−145.
黄骥, 王建飞, 张红生. 植物戊糖磷酸途径及其两个关键酶的研究进展. 植物学通报, 2004,21(2): 139−145.
[4] Kruger NJ, Von Schaewen A. The oxidative pentose phosphate pathway: structure and organisation. Curr Opin Plant Biol, 2003, 6(3):236−246.
[5] Scheibe R. Malate valves to balance cellular energy supply. Physiol Plant, 2004, 120(1): 21−26.
[6] Scharte J, Schön H, Tjaden Z, et al. Isoenzyme replacement of glucose-6-phosphate dehydrogenase in the cytosol improves stress tolerance in plants.Proc Natl Acad Sci USA, 2009, 106(19):8061−8066.
[7] Lin SZ, Zhang ZY, Liu WF, et al. Role of glucose-6-phosphate dehydrogenase in freezing-induced freezing resistance ofPopulus suaveolens. J Plant Physiol Mol Biol, 2005, 31(1): 34−40.
[8] Spolarics Z, Condon MR, Siddiqi M, et al. Red blood cell dysfunction in septic glucose-6-phosphate dehydrogenase-deficient mice. Am J Physiol Heart Circ Physiol, 2004, 286(6):H2118−H2126.
[9] Pinna A, Carru C, Solinas G, et al.Glucose-6-phosphate dehydrogenase deficiency in retinal vein occlusion. Invest Ophthalmol Vis Sci,2007, 48(6): 2747−2752.
[10] Sobngwi E, Gautier JF, Kevorkian JP, et al. High prevalence of glucose-6-phosphate dehydrogenase deficiency without gene mutation suggests a novel genetic mechanism predisposing to ketosis-prone diabetes. J Clin Endocrinol Metab, 2005, 90(8):4446−4451.
[11] Park J, Rho HK, Kim KH, et al. Overexpression of glucose-6-phosphate dehydrogenase is associated with lipid dysregulation and insulin resistance in obesity. Mol Cell Biol, 2005, 25(12): 5146−5157.
[12] Legan SK, Rebrin I, Mockett RJ, et al.Overexpression of glucose-6-phosphate dehydrogenase extends the life span ofDrosophila melanogaster. J Biol Chem, 2008, 283(47):32492−32499.
[13] Geigenberger P, Kolbe A, Tiessen A. Redox regulation of carbon storage and partitioning in response to light and sugars. J Exp Bot, 2005,56(416): 1469−1479.
[14] Eicks M, Maurino V, Knappe S, et al. The plastidic pentose phosphate translocator represents a link between the cytosolic and the plastidic pentose phosphate pathways in plants. Plant Physiol, 2002,128(2): 512−522.
[15] Wang XM. Studies on the mechanism of regulations of glucose-6-phosphate dehydrogenase in the adaptation of reed callus to salt stress[D].Lanzhou: Lanzhou University, 2008.
王晓敏. 葡萄糖-6-磷酸脱氢酶在芦苇愈伤组织盐适应性中调节作用的机理研究[D]. 兰州: 兰州大学, 2008.
[16] Dennis DT, Miernyk JA. Compartmentation of nonphotosynthetic carbohydrate metabolism. Annu Rev Plant Metab, 1982, 33: 23−50.
[17] Wakao S, Benning C. Genome-wide analysis of glucose-6-phosphate dehydrogenases inArabidopsis. Plant J, 2004, 41(2): 243−256.
[18] Wendt UK, Wenderoth I, Tegeler A, et al.Molecular characterization of a novel glucose-6-phosphate dehydrogenase from potato(Solanum tuberosumL.). Plant J, 2000, 23(6):723−733.
[19] Wakao S, Andre C, Benning C. Functional analyses of cytosolic glucose-6-phosphate dehydrogenases and their contribution to seed oil accumulation inArabidopsis. Plant Physiol, 2008, 146(1): 277–288.
[20] Hauschiid R, Von Schaewen A. Differential regulation of glucose-6-phosphate dehydrogenase isoenzyme activities in potato. Plant Physiol, 2003,133(1): 47−62.
[21] Ben-Bassat D, Anderson LE. Light-induced release of bound glucose-6-phosphate dehydrogenase to the stroma in pea chloroplasts. Plant Physiol, 1981,68(2): 279−283.
[22] Wenderoth I, Scheibe R, Von Schaewen A.Identification of the cysteine residues involved in redox modification of plant plastidic glucose-6-phosphate dehydrogenase. J Biol Chem, 1997,272(43): 26985−26989.
[23] Wendt UK, Hauschiid R, Lange C, et al.Evidence for functional convergence of redox regulation in G6PDH isoforms of cyanobacteria and higher plant. Plant Mol Biol, 1999, 40(3):487−494.
[24] Zhao YH, Liu HQ, Yang SL, et al. Affection of respiratory inhibitor NaN3on dormancy relieving and germination ofPanax quinquefoliumseed and its synegistic effect with low temperature. Prim J Chin Mat Med, 2000, 14(4): 6−7.
赵永华, 刘惠卿, 杨世林, 等. 呼吸抑制剂 NaN3对西洋参种子休眠和萌发的影响及其与温度的相互作用. 基层中药杂志, 2000, 14(4): 6−7.
[25] Huang J, Zhang HS, Wang JF, et al. Molecular cloning and characterization of rice 6-phosphogluconate dehydrogenase gene that is up-regulated by salt stress. Mol Biol Rep, 2003,30(4): 223−227.
[26] Xu YL, Guan CY, Tan TL, et al. Changes of oil content and oil biosynthesis-related enzymes activities and their correlation during seed formation inBrassica napus. Acta Agron Sin,2008, 34(10): 1854−1857.
徐一兰, 官春云, 谭太龙, 等. 油菜种子形成中含油量与其合成相关酶活性的变化及其相关性.作物学报, 2008, 34(10): 1854−1857.
[27] Chen C. Study on the role of G6PD in the elicitor-mediated taxol biosynthesis and the mechanism of its antioxidation [D]. Wuhan:Huazhong University of Science and Technology,2004.
陈超. G6PD在诱导合成紫杉醇中的作用及其抗氧化机理研究[D]. 武汉: 华中科技大学, 2004.
[28] Wang Z. Plant Physiology. Beijing: China Agriculture Press, 2002.
王忠. 植物生理学. 北京: 中国农业出版社,2002.
[29] Ye JR, Huang SH, Li CD, et al. Studies on the relation of glucose-6-phosphate dehydrogenase and phenylalanine ammonia lyase in slash needles with resistance to brown spot needle blight. Sci Silvae Sin, 1994, 30(5): 430−435.
叶建仁, 黄素红, 李传道, 等. 磷酸葡萄糖脱氢酶和苯丙氨酸解氨酶与抗松针褐斑病的关系. 林业科学, 1994, 30(5): 430−435.
[30] Šindelář L, Šindelářová M. Correlation of viral RNA biosynthesis with glucose-6-phosphate dehydrogenase activity and host resistance. Planta,2002, 215(5): 862−869.
[31] Asai S, Yoshioka M, Nomura H, et al. A plastidic glucose-6-phosphate dehydrogenase is responsible for hypersensitive response cell death and reactive oxygen species production. J Gen Plant Pathol,2011, 77(3): 152−162.
[32] Sagisaka S. Injuries of cold acclimatized poplar twigs resulting from enzyme inactivation and substrate depression during frozen storage at ambient temperatures for a long period. Plant Cell Physiol, 1985, 26(6): 1135−1145.
[33] Valderrama R, Corpas FJ, Carreras A, et al. The dehydrogenase-mediated recycling of NADPH is a key antioxidant system against salt-induced oxidative stress in olive plants. Plant Cell Environ,2006, 29: 1449−1459.
[34] Nemoto Y, Sasakuma T. Specific expression of glucose-6-phosphate dehydrogenase (G6PDH) gene by salt stress in wheat (Triticum aestivumL.). Plant Sci, 2000, 158(1/2): 53−60.
[35] Wang SH, Zhang H, He QY. Effects of copper stress onMedicago sativaseedlings leaf antioxidative system. Chin J Appl Ecol, 2011,22(9): 2285−2290.
王松华, 张华, 何庆元. 铜胁迫对紫花苜蓿幼苗叶片抗氧化系统的影响. 应用生态学报, 2011,22(9): 2285−2290.
[36] Wang H. Methyl jasmonate in soybean the protective effect of drought adaptation in the physiological response[D]. Beijing: Central University for Nationalities, 2011.
王慧. 茉莉酸甲酯在大豆抗旱适应中保护作用的生理响应[D]. 北京: 中央民族大学, 2011.
[37] Graeve K, Schaewen A, Scheibe R. Purification,characterization and cDNA sequence of glucose-6-phosphate dehydrogenase from potato.Plant J, 1994, 5(3): 353−361.
[38] Persico MG, Viglietto G, Martini G, et a1. Isolation of human glucose-6-pbosphate debydrogenase(G6PD) cDNA clones: primary structure of the protein and unusual 5’non-coding region. Nude Acids Res, 1986, 14(6): 2511−2522.
[39] Thomas D, Cherest H, Surdin-Kerjan Y.Identification of the structural gene for glucose-6-phosphate dehydrogenase in yeast.Inactivation leads to a nutritional requirement for organic sulfur. EMBO J, 1991, 10(3): 547−553.
[40] Fahrendorf T, Ni WT, Shorrosh BS, et a1. Stress responses in alfalfa (Medicago sativaL.) XIX.Transcriptional activation of oxidative pentose phosphate pathway genes at the onset of the isoflavonoid phytoalexin response. Plant Mol Biol,1995, 28(5): 885−900.
[41] von Schaewen A, Langenkamoer G, Graeve K, et al. Molecular characterization of the plastidic glucose-6-phosphate dehydrogenase from potato in comparison to its cytosolic counterpart. Plant Physiol, 1995, 109(4): 1327−1335.
[42] Knight JS, Emes MJ, Debnam PM. Isolation and characterisation of a full-length genomic cloneencoding a plastidic glucose-6-phosphate dehydrogenase fromNicotiana tabacum. Planta,2001, 212(4): 499−507.
[43] Hou FY, Huang J, Lu JF. Isolation and expression analysis of plastidic glucose-6-phosphate dehydrogenase gene from rice (Oryza sativaL.).Acta Gen Sin, 2006, 33(5): 441−448.
[44] Lin YZ. Gene cloning, structure analysis and function identification of glucose-6-phosphate dehydrogenase fromPopulus suaveolens[D].Beijing: Beijing Forestry University, 2006.
林元震. 甜杨葡萄糖-6-磷酸脱氢酶基因克隆及结构分析与功能鉴定[D]. 北京: 北京林业大学,2006.
[45] Lin YZ, Zhang ZY, Guo H, et al. Isolation and analysis of glucose-6-phosphate dehydrogenase(G6PDH) promoter from poplar. Gen Appl Biol,2009, 28(3): 445−449.
林元震, 张志毅, 郭海, 等. 杨树葡萄糖-6-磷酸脱氢酶(G6PDH)基因启动子的克隆与分析. 基因组学与应用生物学, 2009, 28(3): 445−449.
[46] Hammond SM, Bernstein E, Beach D, et al. An RNA-directed nuclease mediates post-transcriptional gene silencing inDrosophilacells. Nature, 2000,404(6775): 293−296.
[47] Zamore PD, Tuschl T, Sharp PA, et al. RNAi:double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals.Cell, 2000, 101(1): 25−33.
[48] Storz G. An expanding universe of noncoding RNAs. Science, 2002, 296(5571): 1260−1263.
[49] Montgomery MK. RNA interference: historical overview and significance. Methods Mol Biol,2004, 265: 3−21.
[50] Kavi HH, Fernandez H, Xie WW, et al. Genetics and biochemistry of RNAi inDrosophila. Curr Top Microbiol Immunol, 2008, 320: 37−75.
[51] Nowotny M, Yang W. Structural and functional modules in RNA interference. Curr Opin Struct Biol, 2009, 19(3): 286−293.
[52] Debnam PM, Fernie AR, Leisse A, et al. Altered activity of the P2 isoform of plastidic glucose 6-phosphate dehydrogenase in tobacco (Nicotiana tabacumcv. samsun) causes changes in carbohydrate metabolism and response to oxidative stress in leaves. Plant J, 2004, 38(1): 49−59.
[53] Cardi M, Chibani K, Cafasso D, et al. Abscisic acid effects on activity and expression of barley(Hordeum vulgare) plastidial glucose-6-phosphate dehydrogenase. J Exp Bot, 2011, 62(11):4013−4023.
[54] Emanuelsson O, Nielsen H, von Heijne G. ChloroP,a neural network-based method for predicting chloroplast transit peptides and their cleavage sites.Protein Sci, 1999, 8(5): 978−984.
[55] Emanuelsson O, Nielsen H, Brunak S, et al.Predicting subcellular localization of proteins based on their N-terminal amino acid sequence. J Mol Biol, 2000, 300(4): 1005−1016.
[56] Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis (MEGA)software version 4.0. Mol Biol Evol, 2007, 24(8):1596−1599.
[57] White JA, Todd J, Newman T, et al. A new set of arabidopsis expressed sequence tags from developing seeds. The metabolic pathway from carbohydrates to seed oil. Plant Physiol, 2000,124(4): 1582−1594.
[58] Au SWN, Gover S, Lam VMS, et al. Human glucose-6-phosphate dehydrogenase: the crystal structure reveals a structural NADP+molecule and provides insights into enzyme deficiency. Structure,2000, 8(3): 293−303.
[59] Kiani F, Schwarzl S, Fischer S, et al.Three-dimensional modeling of glucose-6-phosphate dehydrogenase-deficient variants from German ancestry. PLoS One, 200, 2(7): e625.
Research progress in glucose-6-phosphate dehydrogenase in higher plants
Dingqun Yu, Haoru Tang, Yong Zhang, Ya Luo, and Zejing Liu
College of Horticulture,Sichuan Agricultural University,Ya'an625014,Sichuan,China
于定群, 汤浩茹, 张勇, 等. 高等植物葡萄糖-6-磷酸脱氢酶的研究进展. 生物工程学报, 2012, 28(7): 800−812.
Yu DQ, Tang HR, Zhang Y, et al. Research progress in glucose-6-phosphate dehydrogenase in higher plants. Chin J Biotech,2012, 28(7): 800−812.
Received:December 9, 2011;Accepted:February 21, 2012
Supported by:Scientific Research Fundation of the Education Department of Sichuan Province (No. 09ZB050).
Corresponding author:Haoru Tang. Tel/Fax: +86-835-2882515; E-mail: htang@sicau.edu.cn
四川省教育厅青年基金项目 (No. 09ZB050) 资助。
——有效的抗弓形虫药物靶标