三聚氰胺胶体金免疫层析试纸条的研制
龚云飞,陈宗伦,奚茜,李沐洁,王唯芬,王旻子,应永飞,张明洲
1 中国计量学院生命科学学院 浙江省生物计量与检验检疫技术重点实验室,浙江 杭州 310018
2 杭州迪恩科技有限公司,浙江 杭州 310013
3 浙江省畜产品质量安全检测中心,浙江 杭州 310020
三聚氰胺 (Melamine) 是一种三嗪类含氮杂环有机化工原料,广泛应用于木材、塑料、涂料、造纸、纺织、皮革、电气等行业[1]。三聚氰胺含氮量极高,不法商贩把廉价的三聚氰胺添加入食品中,以虚假提高食品中的蛋白质含量。2007年3月,美国发生4 000多起猫狗中毒死亡事件[2];2008年我国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症甚至死亡;2010年初再度爆发的问题奶粉事件,其原因都是奶粉中含有三聚氰胺[3],因此开展对食品及饲料中三聚氰胺残留的检测势在必行。目前,各国政府都禁止三聚氰胺用于食品生产,并规定了其在食品的最低限量值。三聚氰胺的检测方法主要有高效液相色谱法 (HPLC)[4-6]、气-质联用色谱法 (GC-MS)[7],液-质联用色谱法[6,8-10]和酶联免疫吸附法[11-15]。
胶体金免疫层析技术和酶联免疫吸附法等免疫分析技术近年来在生物各领域得到了越来越多的应用。目前,已报道的酶联免疫吸附法对实际样品中三聚氰胺的检测限在1.8~20 mg/L,已能满足各种食品或饲料的检测要求。胶体金免疫层析法 (GICA) 是近10年发展起来的一项新技术,它是基于抗原抗体的特异性反应,用胶体金作为标记物。该方法操作简单、快速、特异灵敏,不需要仪器,不需专业技术人员操作,几分钟内即可通过目视判断检测结果,并可保持检测结果,比酶联免疫吸附法操作更简单,更适合在现场应用。因此在食品安全及医学检验领域有广泛的应用[16-19]。本试验制备的三聚氰胺胶体金检测试纸条,为食品中三聚氰胺残留水平监测提供了便捷的方法,该试纸条具有较高的特异性、敏感性,而且操作简单,具有很好的应用前景。
1 材料与方法
1.1 主要试剂
三聚氰胺 (纯度98.5%) 购自上海凌峰化学试剂有限公司;羊抗鼠IgG、氯金酸和柠檬酸三钠购自 Sigma公司;硝酸纤维素膜 (简称 NC膜)分别购自Sartorius公司 (CN140)、Millipore公司 (M135) 和 Whatman公司 (Puraband impuraband);玻璃纤维素膜购自Millipore公司;PVC底板、W-8滤纸与 MF-11吸水纸购自Whatman公司;其他试剂为国产分析纯。三聚氰胺单克隆抗体 (1B12,IC50=8.3 mg/L) 和包被抗原MEL-OVA本实验室制备[20-21]。
纯牛奶 (伊利)、脱脂奶粉 (伊利) 与宠物饲料样品 (均经HPLC检测,为阴性),均购自杭州下沙物美超市。试验中简称为牛奶、奶粉和饲料。
1.2 主要仪器
ARISTA-Q5切割机和ARISTA-XZ100平台系统,均购自美国 Arista公司;恒温干燥箱DHG-9146A,购自上海秦迈仪器有限公司;除湿机购自日本川井公司;紫外可见分光光谱仪,Shimadzu UV-2501PC;三重四级杆串联质谱仪,Waters Alliance 2695。
1.3 胶体金的制备与鉴定
采用柠檬酸三钠还原法制备胶体金溶液:取0.01%氯化金溶液100 mL搅拌加热至沸腾,迅速加入2.5 mL 1%柠檬酸三钠水溶液,继续搅拌煮沸20 min,直至溶液呈透亮状,停止加热;室温冷却,用超纯水恢复到原体积,4 ℃保存备用。
胶体金质量采用紫外扫描鉴定:胶体金溶液进行400~600 nm紫外扫描,观察最大吸收峰的峰形和峰宽。
1.4 胶体金标记抗体的制备与鉴定
室温下,将10 mL用0.1 mol/L K2CO3调pH为8.2的胶体金溶液加入50 mL烧杯中,边搅拌边逐滴加入 2 mL用 0.01 mol/L PBS稀释为0.1 g/L的纯化三聚氰胺单克隆抗体 (1B12) 溶液;继续搅拌标记反应10 min后,逐滴加入2 mL 5% BSA溶液,继续搅拌10 min。采用高速离心法纯化金标抗体,将上述金标抗体溶液常温低速(1 831´g离心20 min,弃沉淀,取红色上清夜4 ℃下10 989´g离心40 min;将中层可流动的暗红色沉淀转移到另一新离心管中,用含 1% BSA的0.01 mol/L的PBS混悬至原量;平衡过夜,4 ℃下10 989´g离心40 min,中层可流动的暗红色沉淀转移到另一新离心管中,用含1% BSA与0.02% NaN3的0.01 mol/L的PBS混悬为原体积的1/10~1/40,4 ℃保存备用。
采用紫外扫描对金标抗体质量进行鉴定,400~600 nm紫外扫描,通过观察最大吸收峰的峰形和峰宽的完整性来判断金标抗体质量的好坏。
1.5 NC膜的选择
选择了 Sartorius、Millipore和 Whatman三种 NC膜进行包被抗原 MEL-OVA (检测线,1 000 mg/L) 和羊抗鼠IgG (质控线,1 000 mg/L)的包被试验,用PBS及其添加100 mg/L、200 mg/L三聚氰胺标准品的样品进行测试,选择出线快、清晰与灵敏度达到要求的NC膜进行后续试验。
1.6 胶体金标记抗体喷膜量、包被抗原包被量的选择
1.6.1 胶体金标记抗体喷膜量的选择
制备的胶体金标记 MEL单克隆抗体 1B12 mAb用0.01 mol/L的PBS稀释10倍后,分别按每1 cm2玻璃纤维素膜喷涂20 µL、40 µL和60 µL体积进行喷膜,干燥后分别组装试纸条;用PBS及其添加50 mg/L、100 mg/L、150 mg/L三聚氰胺标准品的样品稀释液进行测试,选择最佳喷膜量。
1.6.2 NC膜包被抗原包被量的选择
包被抗原MEL-OVA稀释成1 500 mg/L、1 200 mg/L和1 000 mg/L分别在NC膜检测线上划线,质控线上均用1 000 mg/L的羊抗鼠IgG进行划线,干燥后分别组装试纸条;用样品稀释液及其添加50 mg/L、100 mg/L三聚氰胺标准品的样品稀释液进行测试。
1.7 样品垫前处理试验
采用0.01 mol/L PBS (pH 7.0)、0.01 mol/L PBS (pH 7.5)、0.01 mol/L TBS (pH 8.5) 对样品垫进行前处理,组装试纸条,分别用pH值约为7.0阴性液体纯牛奶样品及其添加50 mg/L、100 mg/L三聚氰胺标准品的样品进行测试,选择样品垫最佳处理方式。
1.8 试纸条组装与测试
1.8.1 试纸条制备与组装
用ARISTA-XZ1000平台系统在NC膜检测线与质控线分别喷上最佳包被量的包被抗原MEL-OVA与1 000 µg/mL的羊抗鼠IgG,在玻璃纤维素膜喷上最佳喷金量的胶体金标记MEL单克隆抗体1B12;NC膜和玻璃纤维素膜于烘箱中37 ℃干燥24 h,均置于干燥的容器中存放备用。依次搭接地粘贴吸水纸、样本垫、玻璃纤维素膜和NC膜于PVC粘性底板上,ARISTA试纸条切刀机切割成一定尺度的试纸条,装入检测卡中,再装入一袋干燥剂、封口,室温保存。如图1为试纸条组装模式图。
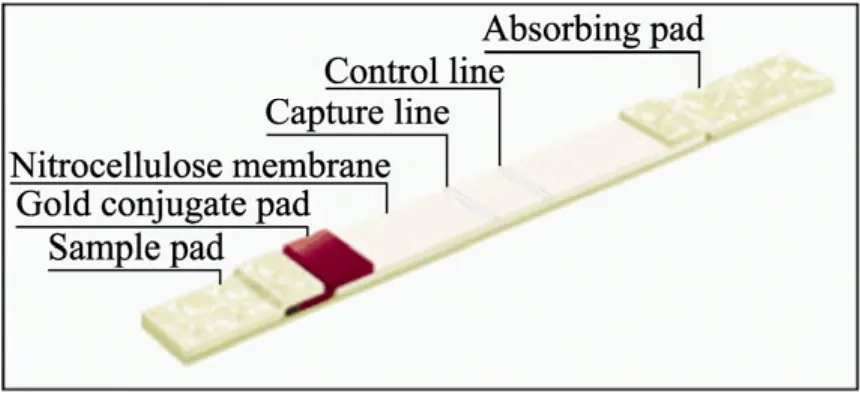
图1 试纸条组装模式图Fig. 1 Cross-section of immunochromatographic strip.
1.8.2 最低检测限测试
PBS中分别添加0 mg/L、5 mg/L、10 mg/L、25 mg/L、50 mg/L、100 mg/L和200 mg/L的三聚氰胺标准品,以PBS为对照,分别用优化条件制备的试纸条进行测试,共对3个批次进行2个重复试验。
1.8.3 实际样品添加测试
阴性样品中添加三聚氰胺标准品,采用组装的试纸条进行测试。1) 牛奶样品:直接添加三聚氰胺标准液到阴性纯牛奶中,使三聚氰胺的添加浓度依次为:0 mg/L、50 mg/L、100 mg/L和200 mg/L;2) 奶粉:先将奶粉溶于水中,再添加三聚氰胺标准液于奶粉溶液中,使三聚氰胺的添加浓度依次为:0 mg/L、50 mg/L、100 mg/L和200 mg/L;3) 饲料:先将饲料溶于水中,再添加三聚氰胺标准液于饲料溶液中,使三聚氰胺的添加浓度依次为:0 mg/L、100 mg/L、200 mg/L和500 mg/L。
1.8.4 与LC-MS/MS比对试验
1) 液相色谱条件:色谱柱:Waters xBridge HILIC 柱 (4.6 mm×150 mm,i.d.,3.5 μm);柱温:30 ℃;进样量:20 μL;流速:0.4 mL/min;流动相:20 mmol/L 甲酸铵:乙腈=8:2。
2) 质谱条件:采用电喷雾离子源 (ESI),正离子模式采集,离子源温度为110 ℃,脱溶剂温度为350 ℃,脱溶剂气和锥孔气为N2,脱溶剂流速为600 L/h,光电倍增器电压为650 V,毛细管电压为3.0 kV,萃取电压为2.0 V;碰撞气为高纯氩气,碰撞室压为3×105Pa;监测模式采用MRM 多反应监测方式,离子对为 m/z:127.2/85.1、127.2/68.1,其中m/z =127.2/85.1为定量离子对,离子对驻留时间为100 ms。
3) 样品处理:精确量取或称取试样2 mL或2 g于50 mL离心管,加入19 mL水-乙腈 (1:1,V/V) 和1 mL饱和乙酸铅溶液,混匀超声波提取15 min,10 000 r/min离心10 min,取上清液5 mL并加入0.2 mL甲酸充分混匀后过MCX固相萃取小柱,用6 mL乙腈淋洗,5 mL 5%氨水/甲醇溶液洗脱,60 ℃下氮气吹干,用0.1 mL 20 mmol/L乙酸铵溶液溶解后,加入0.9 mL乙腈充分混匀后,过0.22 μm滤膜后上机测定。
阴性牛奶与奶粉样品中添加三聚氰胺标准品,使浓度达到w1mg/L (w1=50+10 n,n=0,1,2, 3….),阴性饲料样品中添加三聚氰胺标准品,使浓度达到w2mg/L (w2=100+20 n,n=0,1,2,3….),分别用 LC-MS/MS法和本研究的试纸条对每个浓度的样品测试5次。
1.9 保存期加速试验
将制作好的三聚氰胺试纸条每5条装入1包铝箔袋中,加干燥剂密封,放置60 ℃烘箱中,每隔1天取出1包 (5条) 分别用3个阴性样本和2个阳性样本 (添加200 mg/L、400 mg/L三聚氰胺标准品的样本) 进行测试进行试纸条保存期试验,观察检测线的变化。
2 结果与分析
2.1 胶体金质量的鉴定
采用紫外扫描鉴定,胶体金溶液进行400~600 nm紫外扫描,观察最大吸收峰的峰形和峰宽。从图2可看出,A1与A2瓶胶体金溶液质量比A3、A4好,计算出A1-A4的胶体金金颗粒直径分别约为15、40、60、80 nm。以下试验采用A2胶体金进行。
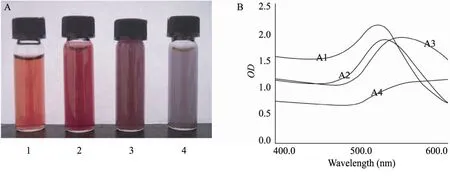
图2 制备的胶体金溶液实物图及紫外扫描图Fig.2 Exterior appearance and UV absorbance spectra of colloidal gold solution. (A) Preparation of colloidal gold solution. 1: 1.0 mL; 2: 1.5 mL; 3: 2.0 mL; 4: 2.5 mL. (B) The UV absorbance spectra of different colloidal golds. A1: 519.20 nm; A2: 525.00 nm; A3: 539.40 nm; A4: 594.80 nm.
2.2 胶体金标记MEL单克隆抗体质量的鉴定
从图3可看出,获得的金标抗体用0.01 mol/L的PBS稀释50倍后进行紫外扫描,最大吸收峰具有很好的峰形和峰宽,说明标记的胶体金抗体颗粒大小适中且均一,表示金标抗体质量好,可用于后续研究。
2.3 NC膜的选择
选择了Sartorius、Millipore和Whatman三种 NC膜进行包被抗原 MEL-OVA (检测线,1 000 µg/mL) 和 羊 抗 鼠 IgG (质 控 线 ,1 000 µg/mL) 的包被试验,用PBS及其添加100、200 ng/mL三聚氰胺标准品的样品进行测试,结果如图4。综合考虑膜的层析速度、检测线与质控线的显色情况、最低检测限与成本等因素,选择Whatman的NC膜。
2.4 胶体金标记抗体喷膜量的选择
制备的胶体金标记MEL抗体用0.01 mol/L的PBS稀释10倍后,分别按每1 cm2玻璃纤维素膜喷涂20、40、60 μL体积进行喷膜,干燥后分别组装试纸条;用样品稀释液及其添加50 mg/L、100 mg/L、150 mg/L三聚氰胺标准品的PBS进行测试。从图5可看出,喷膜量为60 μL/cm2效果最佳。
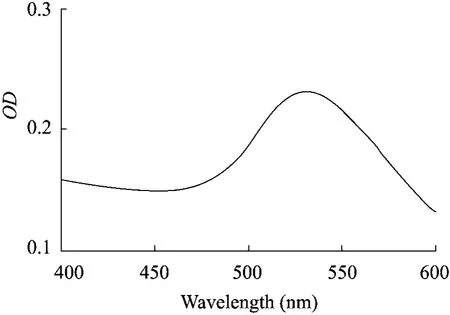
图3 金标MEL抗体紫外扫描图Fig.3 UV absorbance spectra of gold-antibody.
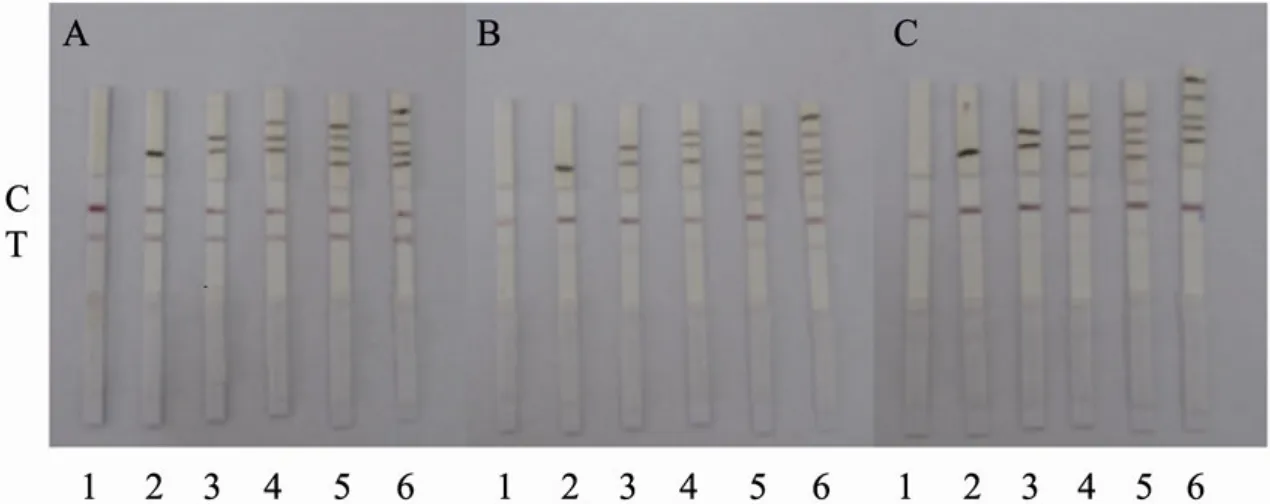
图4 不同NC膜制作的试纸条效果图Fig.4 The graph of strip produced by different NC membranes. (A) 0 mg/L (PBS). (B) 100 mg/L. (C) 200 mg/L. 1,2: Millipore NC membranes; 3,4: Whatman NC membranes; 5,6: Sartorius NC membranes. Amount added: C: control line; T: detection line.
2.5 NC膜包被抗原包被量的选择
包被抗原MEL-OVA稀释成1 500 mg/L、1 200 mg/L和1 000 mg/L分别在NC膜检测线上划线,质控线上均用1000 µg/mL的羊抗鼠IgG进行划线,干燥后分别组装试纸条;用样品稀释液及其添加50 mg/L、100 mg/L三聚氰胺标准品的样品稀释液进行测试。从图6可看出,包被抗原MEL-OVA为1200 mg/L时效果最佳。

图5 不同胶体金标记抗体喷膜量试纸条效果图Fig.5 The graph of strip produced by different gold-antibodies. (A) PBS. (B) 50 mg/L. (C) 100 mg/L. (D) 150 mg/L. 1: 60 µL/cm2; 2: 40 µL/cm2; 3: 20 µL/cm2.
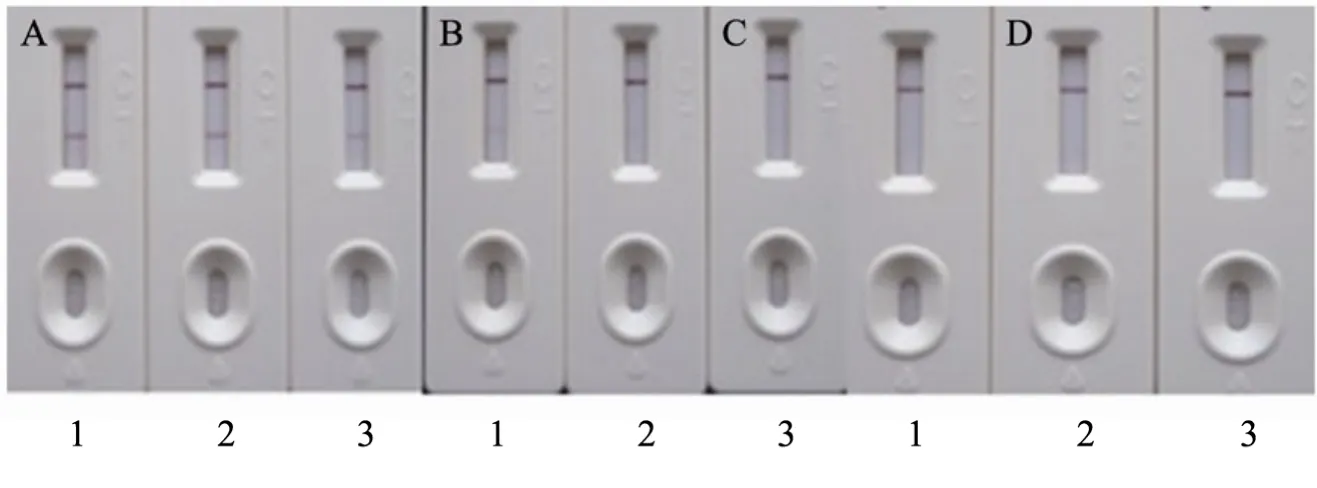
图6 不同包被抗原包被量试纸条效果图Fig.6 Graph of strip produced by different volumes of coating antigen. (A) PBS. (B) 50 mg/L. (C) 100 mg/L. 1: 1 500 mg/L; 2: 1 200 mg/L; 3: 1 000 mg/L.
2.6 样品垫前处理的选择
采用0.01 mol/L PBS (pH 7.0)、0.01 mol/L PBS (pH 7.5)、0.01 mol/L TBS (pH 8.5) 对样品垫进行前处理,组装试纸条,分别用pH值约为7.0阴性液体纯牛奶样品及其添加 50 ng/mL、100 ng/mL三聚氰胺标准品的样品进行测试。结果表明用0.01mol/L PBS (pH 7.5) 进行样品垫前处理具有较好的效果,对金标记物与抗原/抗体的结合起稳定的作用,同时也改变样品 pH值是整个系统达到稳定;同时可以使最低检测限得到优化 (图7)。
2.7 试纸条组装与测试
在上述研究基础上,确定三聚氰胺胶体金免疫层析试纸条的研制材料选择及工艺参数选择如下:NC膜,Whatman;胶体金标记三聚氰胺单克隆抗体喷膜量为 60 μL/cm2;包被抗原MEL-OVA包被量为1200 mg/L;二抗 (质控线)包被量为1 000 mg/L;0.01 mol/L PBS (pH 7.5)进行样品垫前处理。按此参数生产一批试纸条,进行检出限、实际样品加标、比对测试与保存期试验。

图7 样品垫前处理试验Fig.7 The test of sample pad pre-treatment. (A) PBS. (B) 50 mg/L. (C) 100 mg/L. 1: treatment by 0.01 mol/L PBS (pH 7.0); 2: treatment by 0.01 mol/L PBS (pH 7.5); 3: treatment by 0.01 mol/L TBS (pH 8.5); 4: no treatment.
2.7.1 最低检测限试验
试验结果如图8所示,随着MEL添加浓度的增大,检测线的颜色逐渐变淡,直至消失,在MEL添加浓度为50 mg/L时,检测线已经很难辨别,表明试纸条对三聚氰胺的最低检测限可达到
50 mg/L。
2.7.2 实际样本检测试验
HPLC检测阴性牛奶、奶粉与饲料样品中添加三聚氰胺标准品,采用组装的试纸条进行测试。由图9可见,试纸条在牛奶、奶粉和饲料中的肉眼可视最低检测限分别为 100 mg/L、100 ng/g和200 ng/g。

图8 MEL胶体金试纸条最低检测限图Fig.8 LOD of test trip for detecting melamine.

图9 胶体金试纸条法测定牛奶、奶粉和饲料中的三聚氰胺Fig.9 The result of detecting melamine in milk, milk powder and feed. (A) Milk, melamine concentration (mg/L): 0, 50, 100 and 200. (B) Milk powder, melamine concentration (ng/g): 0, 50, 100 and 200. (C) Feed, melamine concentration (ng/g): 0, 100, 200 and 500.
2.7.3 LC-MS/MS法与CGIA检测牛奶中三聚氰胺含量的比对
分别应用两种方法对不同浓度的样品测试5次,主要结果见表1。牛奶与奶粉样品中的MEL添加量为50 ng/g时,LC-MS/MS法能检出,且回收率良好,而试纸条对牛奶与奶粉样品中的MEL肉眼可视最低检测限为 100 ng/g,不能检出;牛奶与奶粉样品中的MEL添加量不小于为100 ng/g时,LC-MS/MS法和试纸条均能检出。而饲料样品中的 MEL添加量为 100 ng/g时,LC-MS/MS法能检出,且回收率良好,而试纸条对饲料样品中的 MEL肉眼可视最低检测限为200 ng/g,不能检出;添加量不小于200 ng/g时,LC-MS/MS法和试纸条均能检出。此结果表明,试纸条检测结果与 LC-MS/MS法具有很高的符合率。
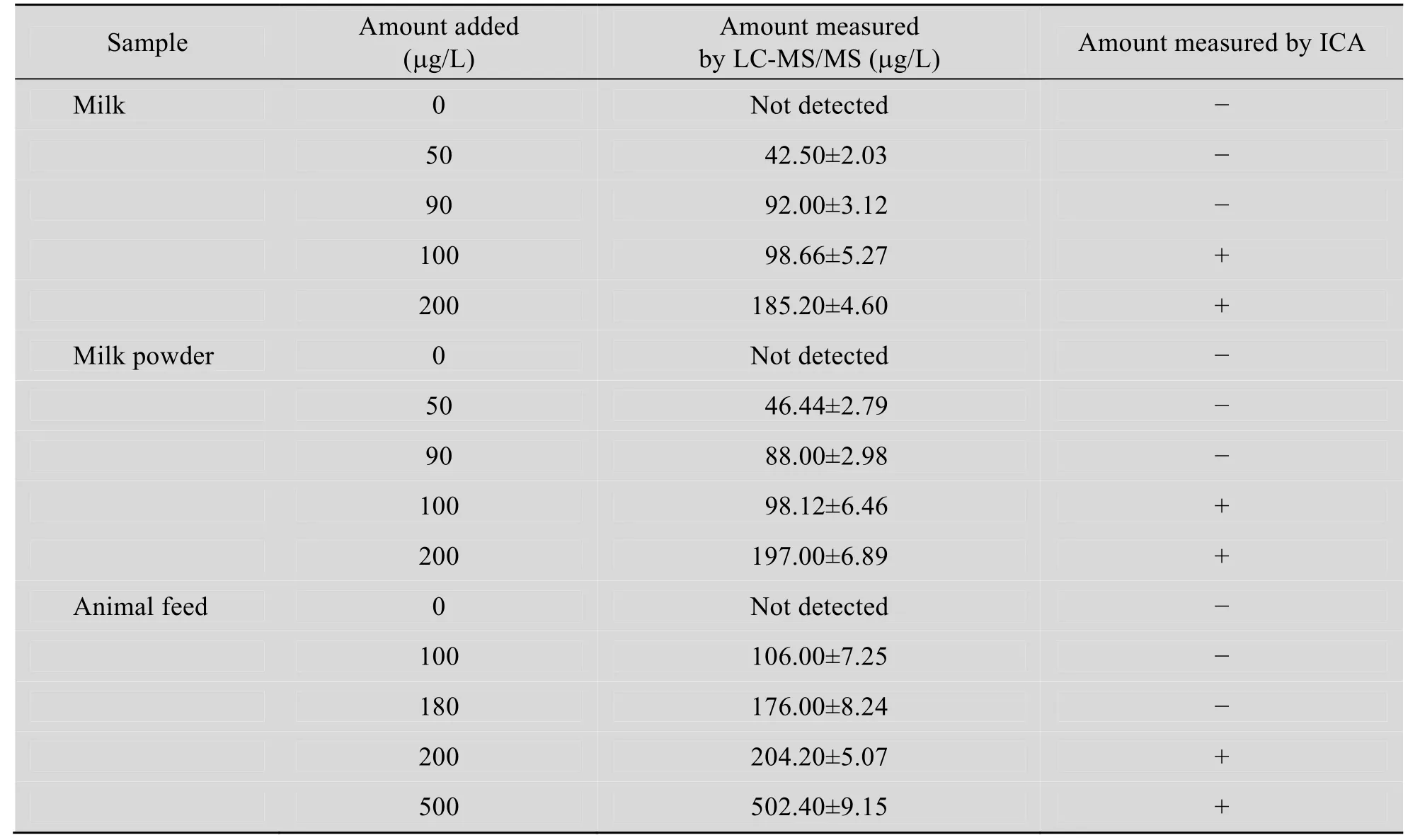
表1 LC-MS/MS法和金标法检测MEL的对比试验 (n=5)Table 1 The comparison test of melamine by LC-MS/MS and ICA (n=5)
2.7.4 试纸条保存期测试
保存期加速实验结果如表2所示,表明60 ℃条件下可保存12 d。根据试纸条保存期经验:胶体金免疫层析试纸条60 ℃下稳定1 d,相当于常温干燥环境下可保质1个月。可推论,三聚氰胺胶体金免疫层析试纸条常温干燥环境下至少可保质6个月。

表2 三聚氰胺试纸条保质期实验Table 2 Experiment of shelf life for melamine test strip
3 结论
基于抗原抗体结合原理的免疫分析技术以其特异、便捷、快速的优点,在小分子有害残留监测中被广泛应用。目前针对三聚氰胺的免疫分析技术也有报道,主要为酶联免疫吸附法和胶体金免疫层析法。其中介绍三聚氰胺的 ELISA检测法主要为论文,研制方法详尽;介绍三聚氰胺胶体金免疫层析法主要为专利[22-24],还处于知识产权保护中。
在本研究中,详细介绍了MEL胶体金免疫层析检测试纸条的研制过程:NC膜、金标三聚氰胺抗体喷膜量、包被抗原 (检测线) MEL-OVA包被量和二抗 (质控线) 包被量的工艺参数为:硝酸纤维素膜采用Whatman NC膜、胶体金标记MEL单克隆抗体最佳喷膜量为60 μL/cm2、包被抗原MEL-OVA最佳包被量为1200 mg/L、样品垫采用0.01 mol/L PBS (pH 7.5) 进行前处理。三聚氰胺胶体金试纸条肉眼可视最低检测限为50 mg/L;试纸条在牛奶、奶粉和饲料中的肉眼可视最低检测限分别为 100 mg/L、100 ng/g和200 ng/g,与LC-MS/MS法比对,具有较高的准确性;试纸条常温干燥环境下可保质6个月。能够检测出三聚氰胺含量大于50 mg/L的样品,适用于现场实际样品三聚氰胺残留水平监测,为三聚氰胺胶体金免疫层析检测试纸条的研制及产品化提供了参考,具有良好的应用前景。
REFERENCES
[1] Wang YJ. Raw Material of Organic Chemicals. Beijing: Chemical Industry Press, 2004: 727–728.王延吉. 有机化工原料. 北京: 化学工业出版社, 2004: 727−728.
[2] Lang L. FDA issues statement on diethylene glycol and melamine food contamination. Gastroenterology, 2007, 133(1): 5−6.
[3] Ingelfinger J R. Melamine and the global implications of food contamination. N Engl J Med, 2008, 359(26): 2745−2748.
[4] Sugita T, Ishiwata H, Yoshihira K, et al. Determination of melamine and three hydrolytic products by liquid chromatography. Bull Environ Contam Toxicol, 1990, 44(4): 567−571.
[5] Mniiz VR, Cbballos SG, Rosales MD, et al. Method development and validation for melamine and its derivatives in rice concentrates by liquid chromatography. Application to animal feed samples. Anal Bioanal Chem, 2008, 392(3): 523−531.
[6] Yu H, Tao YF, Chen DM, et al. Development of a high performance liquid chromatography method and a liquid chromatography-tandem mass spectrometry method with pressurized liquid extraction for simultaneous quantification and confirmation of cyromazine, melamine and its metabolites in foods of animal origin. Anal Chim Acta, 2010, 682(1/2): 48−58.
[7] FDA/ORA. Forensic Chemistry Center GC-MS screen for the presence of melamine and cyanuric acid[EB/OL]. [2007-04-10]. http://www.fda.gov/ cvm/Melamine Presence.htm.
[8] Vail T, Jail PR, Sparkman OD. Rapid and unambiguous identification of melamine in contaminated pet food based on mass spectrometry with four degrees of confirmation. J Anal Toxicol, 2007, 31(6): 304−312.
[9] Filigenzi MS, Puschner B, Aston LS, et al. Diagnostic determination of melamine and related compounds in kidney tissue by liquid chromatography/tandem mass spectrometry. J Agric Food Chem, 2008, 56(17): 7593−7599.
[10] Varelis P, Jeskelis R. Preparation of [(13)C(3)]-melamine and (13)C(3)]-cyanuric acid and their application to the analysis of melamine and cyanuric acid in meat and pet food using liquid chromatography-tandem mass spectrometry. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2008, 25(10): 1208−1215.
[11] Garber EAE. Detection of melamine using commercial enzyme-linked immunosorbent assay technology. J Food Prot, 2008, 71(3): 590−594.
[12] Choi JH, Kim YT, Lee JH. Rapid quantification of melamine in milk using competitive 1, 10-oxalyldiimidazole chemiluminescent enzyme immunoassay. Analyst, 2010, 135(9): 2445−2450.
[13] Wang ZY, Ma X, Zhang LY, et al. Screening and determination of melamine residues in tissue and body fluid samples. Anal Chim Acta, 2010, 662(1): 69−75.
[14] Zhu K, Li JC, Wang ZH, et al. Simultaneous detection of multiple chemical residues in milk using broad-specificity antibodies in a hybrid immunosorbent assay. Biosens Bioelectron, 2010, 26(5): 2716−2719.
[15] Tang MJ, Zhang H, Zheng XY, et al. Rapid detection of melamine in different matrixes of food samples by ELISA. Chin J Food Hyg, 2010, 22(4): 340−343.汤慕瑾, 张恒, 郑晓燕, 等. 酶联免疫吸附法快速测定不同样品基质中三聚氰胺. 中国食品卫生杂志, 2010, 22(4): 340−343.
[16] Zhang MZ, Wang MZ, Chen ZL, et al. Development of a colloidal gold based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Anal Bioanal Chem, 2009, 395(8): 2591−2599.
[17] Wang TC, Zhang T, Yang ST, et al. Preparation and application of a colloidal gold strip to detect the rabies antibody. Chin J Biotech, 2011, 27(5): 799−804.王铁成, 张涛, 杨松涛, 等. 狂犬病病毒抗体胶体金检测试纸的制备. 生物工程学报, 2011, 27(5): 799−804.
[18] Zhang JY, Zhang Y, Wang S. Rapid detection of sulphamethazine residues in pig muscle and milk by colloidal gold-based immumochromatographic assay. J Chin Inst Food Sci Technol, 2010, 10(1): 181−185.张佳宜, 张燕, 王硕. 胶体金免疫层析法快速检测猪肉及牛奶中磺胺二甲嘧啶残留. 中国食品学报, 2010, 10(1): 181−185.
[19] Lin T, Shao JJ, Cong GZ, et al. Establishment of colloidal gold-immunochroma-togrphy assay strip for detection of type Asial foot-and-mouth disease virus. Chin J Biotech, 2009, 25(5): 767−772.林彤, 邵军军, 丛国正, 等. Asial型口蹄疫病毒胶体金免疫层析检测方法的建立. 生物工程学报, 2009, 25(5): 767−772.
[20] Gong YF, Wang WF, Zhang MZ, et al. Preparation of artificial antigen of melamine and polyclonal antibody. China Univ Metrol, 2011, 22(1): 73−79.龚云飞, 王维芬, 张明洲, 等. 三聚氰胺人工抗原及多克隆抗体的制备. 中国计量学院学报, 2011, 22(1): 73−79.
[21] Wang MZ, Ying YF, Gong YF, et al. Preparation and identification of anti-melamine monoclonal antibody. J Anhui Agric Sci, 2012, 40(5): 2574−2576.王旻子, 应永飞, 龚云飞, 等. 三聚氰胺单克隆抗体制备与鉴定. 安徽农业科学, 2012, 40(5): 2574−2576.
[22] Qian JH,Liao YY. Establishment of colloidal gold-immunochromatogrphy assay strip for detecting melamine: CN, 200910060513, 2009-01-14.钱金宏, 廖园园. 三聚氰胺胶体金免疫层析检测试纸及制备方法: CN, 200910060513, 2009-01-14.
[23] He FY, Wan YP, Feng CW, et al. A special test strip for detecting melamine: CN, 200810240316.2, 2008-12-17.何方洋, 万宇平, 冯才伟, 等. 一种检测三聚氰胺的方法及其专用试纸: CN, 200810240316.2, 2008-12-17.
[24] Zhang SE, Sang LY, Bu LJ, et al. A colloidal gold-immunochromatogrphy assay strip for detection of melamine: CN, 201020107992.5, 2010-02-01.张少恩, 桑丽雅, 卜令杰, 等. 一种检测三聚氰胺的免疫胶体金试剂板: CN, 201020107992.5, 2010-02-01.