H2O2参与水杨酸诱导丹参培养细胞中丹酚酸B合成的信号转导
陈红艳,刘连成,董娟娥,夏广东
1 西北农林科技大学生命科学学院,陕西 杨凌 712100
2 西安陆军学院,陕西 西安 710108
药材丹参为唇形科鼠尾草属植物丹参(Salvia miltiorrhiza Bunge) 的干燥根及根茎,具有祛瘀止痛、活血通经、清心除烦等功效[1]。丹酚酸B (Sal B) 是丹参中的一种酚酸类物质,以Sal B为代表的酚酸类成分被认为是丹参中发挥药效的活性物质[2]。Sal B的生物合成是植物体细胞内一系列相关信号、酶及基因调控的复杂的生理过程,其合成积累具有可调控性。目前普遍认为,丹参酚酸类次生代谢物主要合成于两条代谢途径——苯丙烷代谢途径和迷迭香酸代谢途径。苯丙氨酸解氨酶 (PAL) 是苯丙烷途径的第一关键酶[3]。在各种生物逆境胁迫下,植物细胞的特征反应之一是苯丙烷代谢途径的激活[4]。L-苯丙氨酸被 PAL催化合成肉桂酸,再由肉桂酸-4-羟化酶 (Cinnamate-4-hydroxylase,CHA) 催化形成4-香豆酸,再转化成咖啡酸;L-酪氨酸被酪氨酸氨基转移酶 (TAT) 催化生成3,4-二羟基苯丙氨酸,由羟苯基丙酮酸还原酶 (Hydroxyphenylpyruvate reductase,HPPR) 催化生成3,4-二羟基苯乳酸,3,4-二羟基苯乳酸和咖啡酸在迷迭香酸合成酶(Rosmarinic acid synthase,RAS) 催化下合成迷迭香酸,再进一步合成Sal B。
水杨酸 (Salicylic acid,SA) 是一种存在于植物体内的酚酸类物质,被认为是一种内源信号调控细胞内氧化物水平从而抵御外界胁迫[5]。当病原体侵害植物时,SA可以快速积累到较高水平,且与 CAT结合并抑制其活性,从而导致细胞内H2O2含量迅速升高。H2O2可以作为信号分子诱导病原相关性蛋白表达以及激活系统获得性抗性活化[6]。已有研究表明,SA在激活植物对抗各种外界胁迫的抗性方面具有重要作用,如外源施加SA可以有效提高芥菜的耐高温性[7],增加黄瓜的耐寒性[8]、抗盐性[9]及抗重金属胁迫能力[10]等。SA还可作为诱导子被广泛用于促进植物次生代谢物的合成[11-12]。
H2O2为活性氧的一种,具有较高的化学反应活性,长期以来被认为是植物代谢中产生的一种毒副产品[13]。现在研究表明,由于H2O2相对稳定、可以跨膜运输,且较其他活性氧分子半衰期长,在配体与受体的相互作用,酶的激活、基因表达、细胞凋亡等过程中均发挥着作用。因此,H2O2被认为是在活性氧中最适合作信号分子的一种物质,在植物受到各种刺激后介导多种代谢反应[13]。植物体内H2O2有多种来源,一方面来自于光合作用和呼吸作用中的电子传递过程;另一方面来源于酶途径,包括烟酰胺腺嘌呤二核苷酸 (NADPH) 氧化酶、细胞壁过氧化物酶、胺氧化酶等[13]。H2O2介导多种生理生化过程,如系统获得性抗性 (Systemic acquired resistance,SAR)、过敏反应 (Hypersensitive resistance,HR)[14-15]、细胞衰老[16]、细胞程序化死亡(Programmed cell death, PCD)[17]等,是植物对细胞内信号及外界刺激反应的重要调节物,并可介导ABA信号来调节气孔开闭[18-19]、黄瓜不定根的形成和发育[20]、介导金丝桃次生代谢产物合成的过程[21]。
有关SA与H2O2之间的研究主要集中在SA作为防御反应过程中的信号物质与 H2O2之间的相互关系,如在防御反应中SA参与的信号转导途径与升高的H2O2含量水平有关[6]、SA作为上游调控物质激活氧化迸发[22]以及外源施加SA对植物细胞内H2O2的影响,如外源施加SA和稻瘟病菌诱导水稻细胞内 H2O2积累及激活防御反应机制[23]、SA诱导的H2O2参与的信号转导途径介导水稻根对镉的耐受性[3]。有关 H2O2是否可以作为信号分子介导SA诱导的次生代谢物合成积累方面还知之甚少。
研究表明,以SA作为诱导子可以有效提高丹参培养细胞中Sal B的合成[24]。但对于外源施加的SA 是如何被丹参细胞内的信号分子感受、传递并引起酚酸类化合物合成代谢的一系列过程还不清楚。目前报道的与植物细胞信号转导有关的生理和生化事件,包括氧化迸发和活性氧积累、离子跨膜运输、水杨酸的调控作用等有关的信号分子有Ca2+、IP3、NO及cGMP等[13]。但对与植物细胞内次生代谢物合成有关的信号分子及其信号途径之间的关系了解还不深入。本文以丹参悬浮培养细胞为材料,探讨H2O2在介导SA诱导的丹参细胞Sal B合成积累过程中的作用,以期为进一步了解与植物细胞内次生代谢物合成有关的信号分子及其信号转导途径奠定基础。
1 材料与方法
1.1 丹参悬浮培养细胞系的建立及培养条件
丹参种子来源于陕西天士力植物药业有限公司商洛丹参GAP药源基地。
1.1.1 无菌苗的诱导
将新鲜丹参种子用自来水冲洗2~4 h,用纱布去除表面蜡质层,再用自来水冲洗3次,然后于无菌操作间灭菌。首先,在70%乙醇 (分析纯,西安三浦化学剂公司) 中冲泡30 s,无菌水冲洗3次,然后在0.1% HgCl2(分析纯,利祥汞业化工有限公司) 中灭菌 10~15 min,无菌水冲洗 3次,接种在 MS固体培养基上。培养基中含有5.5 g/L 琼脂 (北京康倍斯科技有限公司) 和30 g/L 蔗糖 (广州市金华大化学试剂有限公司)培养条件:培养温度 (25±2) ℃,光照时间12~16 h,光照强度2 000~3 000 Lx。培养2个月。
1.1.2 愈伤组织诱导
取出生长 2个月的无菌苗,将叶片剪成0.5 cm×0.5 cm的小块,接种于MS固体诱导培养基上。培养基中含有1.0 mg/L NAA (天津博迪化工有限公司)、1.0 mg/L 6-BA (北京康倍斯科技有限公司)、1.0 mg/L 2,4-D (北京康倍斯科技有限公司)、5.5 g/L 琼脂、30 g/L 蔗糖,在光照条件下诱导出愈伤组织。将愈伤组织每20 d继代培养1次,2个月后其形态特征和生长速率稳定。
培养条件:培养温度 (25±2) ℃,光照时间12~16 h,光照强度2 000~3 000 Lx。
1.1.3 悬浮细胞培养
取转接后培养15 d的愈伤组织,按愈伤组织与培养液1︰15 (W/V) 的比例转接到MS液体培养基上 (不含琼脂和植物生长调节物质,含30 g/L蔗糖) 悬浮培养。培养温度为25 ℃,摇床转速为125 r/min,黑暗培养。
1.2 诱导及处理方法
分别将H2O2(分析纯,天津天力化学试剂有限公司)、DMTU (208-588-2,Sigma公司)、CAT (C-9322,Sigma公司)及IMD (B 0074,Sanland Chemical 公司) 溶液用 0.22 μm微孔过滤膜过滤,按照试验要求向培养基中加入不同浓度的上述溶液。另一组培养细胞中加入等体积的蒸馏水 (代替H2O2、DMTU、CAT及IMD) 作为对照。各种处理试剂的添加时间为 SA诱导处理前30 min。
1.3 苯丙氨酸解氨酶 (PAL) 和酪氨酸氨基转移酶 (TAT) 活性检测
取新鲜培养材料,置定性滤纸上,用抽滤瓶抽去培养液后,迅速用蒸馏水冲洗,再用抽滤瓶抽去表面水分备用。
PAL活性的测定按文献[25]的方法进行。在290 nm下测定吸光度,以每分钟OD值变化0.01为一个酶活单位U。
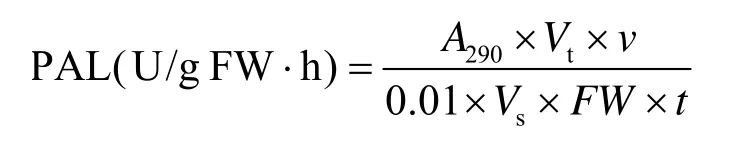
式中,Vt:酶液总体积 (mL);FW:样品鲜重 (g);Vs:测定时取酶液的体积 (mL);n:反应液总体积 (mL);t:反应时间 (h)。
TAT活性的测定按文献[24]的方法进行。在331 nm下测定吸光度,以每分钟OD值变化0.01为一个酶活单位U。
计算公式如下:
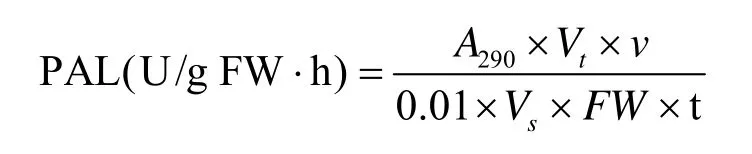
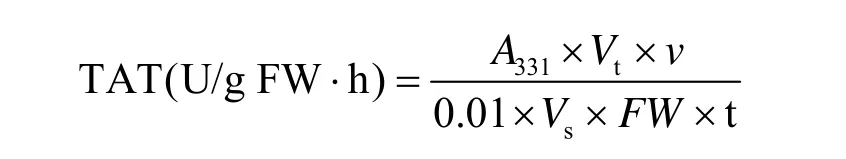
式中,Vt:酶液总体积 (mL);FW:样品鲜重 (g);Vs:测定时取酶液的体积 (mL);n:反应液总体积 (mL);t:反应时间 (h)。
1.4 过氧化氢 (H2O2) 含量检测
H2O2含量检测采用硫酸钛法[26]。称取大约0.2~0.3 g的新鲜材料,加入5 mL 于4 ℃下预冷的丙酮 (分析纯,成都科龙),在冰浴下迅速研磨成匀浆,在4 ℃下10 000 r/min离心10 min。取2 mL上清液,加入 0.5 mL 5% 硫酸钛(20044428,分析纯,国药集团) 混匀,再加入2 mL 浓氨水 (分析纯,四川西陇) 混匀,在4 ℃下10 000 r/min离心10 min,弃去上清液。用5 mL 2 mol/L的浓硫酸 (分析纯,四川西陇) 溶解沉淀,在波长415 nm处测定吸光度。
1.5 Sal B提取及含量检测
样品的制备:收获丹参培养物,在1200 r/min离心后收集细胞,然后在47 ℃真空干燥箱中干燥至恒重。取0.05 g左右干燥细胞置具塞试管中,用 70∶30 (V/V) 的甲醇-水溶液超声波提取45 min。提取液用 0.22 μm微孔滤膜过滤后待检测。
Sal B 含量检测采用高效液相色谱法(HPLC)[24],检测条件进行了适当修改。色谱条件为:色谱柱,shim-pack VP-ODS (250 mm×4.6 mm,i.d. 5 μm);流动相,甲醇-水-冰乙酸 (体积比43︰56︰1);流速,1 mL/min;进样量,10 μL;检测波长,281 nm;柱温,30 ℃。
2 结果与分析
2.1 水杨酸诱发丹参培养细胞 H2O2释放、PAL和TAT活化及Sal B合成
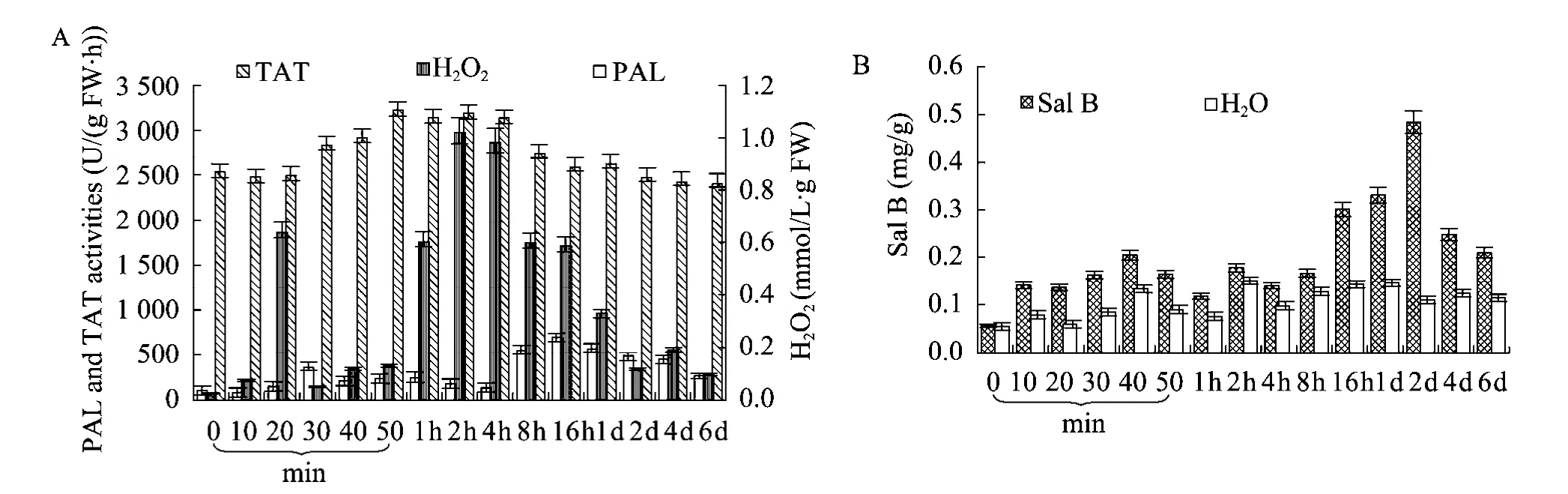
图1 水杨酸诱导后丹参悬浮培养细胞中H2O2含量、PAL活性、TAT活性及Sal B含量变化Fig. 1 Time courses of H2O2 generation, the increase of PAL and TAT activity, as well as Sal B production of S. miltiorrhiza suspension cells treated with SA. 8-d-old cells treated with 22 mg/L SA were harvested at the time indicated, and the PAL and TAT activity, contents of H2O2 and Sal B were determined. Values are means of three independent experiments. The control received vehicle solvent only. Bars represented standard errors.
在水杨酸处理10 min后,丹参培养细胞中H2O2含量开始明显增加,并在处理20 min时达到第1个峰值,随后下降;在处理50 min时快速增加并在2 h左右达到第2个峰值 (图1 A)。丹参培养细胞中PAL活性在诱导后30 min时出现第1个峰值,随后大幅度下降;在4 h时快速增加并在16 h左右达到第2个峰值 (图1 A)。TAT活性在处理后30 min开始上升,在50 min左右达到峰值,在4 h左右开始下降 (图1 A)。丹参培养细胞中Sal B含量的升高稍晚于PAL活性的增加。在水杨酸处理8 h后细胞中Sal B的含量开始升高,在2 d左右达到最高 (图1 B)。以上结果表明,水杨酸诱导的PAL活性及Sal B含量的升高均发生在 H2O2产生的峰值之后。说明H2O2可能在SA诱导丹参培养细胞Sal B合成积累的过程中起重要作用。
2.2 H2O2在丹参培养细胞PAL和TAT活化、Sal B合成过程中的作用
2.2.1 H2O2对培养细胞中PAL、TAT活性和Sal B含量的影响
用 H2O2水溶液单独处理丹参培养细胞后发现,H2O2对细胞中PAL和TAT活性及Sal B含量均具有明显的促进作用 (图2)。
H2O2处理后,细胞中的PAL活性在20 min出现第1个峰值,随后下降;处理1 h时,PAL活性快速增加,并在8 h达到第2个峰值。TAT活性在处理后30 min开始上升,在40 min达到峰值,在处理后4 h左右开始下降 (图2 A)。
Sal B含量的升高稍晚于PAL和TAT活性的增加。H2O2处理8 h后,Sal B的含量开始增加,在处理1 d左右达到最高 (图2 B)。
以上结果表明,H2O2处理后,培养细胞中PAL和TAT的活化及Sal B含量的升高均明显比用SA单独处理时 (图1 A) 有所提前。说明丹参细胞对H2O2反应快于SA诱导。
2.2.2 培养细胞中酶活性变化和 Sal B合成对H2O2具有浓度依赖性
用不同浓度的 H2O2处理后,与对照相比丹参培养细胞中PAL和TAT的活化及Sal B含量的增加对H2O2具有浓度依赖性 (图3)。
H2O2浓度在1~10 mmol/L范围内,与对照组(H2O) 相比,丹参细胞中PAL和TAT活性及Sal B含量的变化随着 H2O2浓度的增加而增加;当H2O2浓度超过10 mmol/L时,对PAL和TAT活性及Sal B合成积累具有抑制作用。表明丹参培养细胞中PAL和TAT活性及Sal B合成积累对H2O2具有浓度依赖性,即低浓度的H2O2对Sal B合成积累具有促进作用,较高浓度的 H2O2对细胞造成伤害甚至杀死细胞,导致Sal B的合成积累受到抑制。

图2 H2O2对丹参培养细胞PAL、TAT活性和Sal B含量的影响Fig. 2 Time courses of Sal B production and PAL and TAT activity of S. miltiorrhiza suspension cells treated with H2O2. 8-d-old cells treated with 10 mmol/L H2O2 were harvested at the time as indicated, and Sal B contents and PAL and TAT activity were then determined. Values are means of three independent experiments. Bars represented standard errors.

图3 不同浓度的H2O2对丹参培养细胞PAL、TAT的活性和Sal B含量的影响Fig. 3 Effects of different H2O2 concentrations on PAL and TAT activity as well as Sal B production of S. miltiorrhiza suspension cells. 8-d-old cells treated with different concentrations of H2O2 were harvested 8 h, 16 h and 2 d later, and the TAT and PAL activity as well as Sal B contents were then determined. Values are means of three independent experiments. Bars represented standard errors. 1: H2O; 2: SA; 3: 1 mmol/L H2O2; 4: 10 mmol/L H2O2; 5: 30 mmol/L H2O2; 6: 50 mmol/L H2O2; 7: 70 mmol/L H2O2.
不同浓度的H2O2处理组与SA处理组相比,即使使用最适H2O2浓度 (10 mmol/L) 处理,丹参细胞中PAL和TAT活性及Sal B含量仍低于SA处理组,说明H2O2并不是SA诱导丹参细胞中Sal B合成积累的唯一信号分子,可能还存在其他途径共同介导SA诱导丹参细胞中Sal B合成积累。
2.3 SA诱发Sal B合成及PAL和TAT的活化对H2O2具有依赖性
过氧化氢酶 (Catalase, CAT) 是一种分子量(240 kDa) 较大的H2O2清除剂,可以有效地清除细胞质膜外的H2O2[19]。二甲基硫脲 (DMTU) 是一种常用的H2O2淬灭剂[27]。活性氧 (ROS) 可以通过质膜NADPH氧化酶把细胞质中NADPH的电子传递给O2从而形成然后通过歧化作用生成H2O2[29]。由质膜NADPH氧化酶产生的 H2O2作为信号分子已有很多报道[29-30]。在哺乳动物中性粒细胞中发现的NADPH氧化酶复合物的抑制剂二苯基碘 (DPI) 和咪唑 (IMD) 能够抑制植物中由病原菌等诱导子诱导产生的H2O2的积累[14,31-32]。为了进一步证实H2O2是SA促进丹参细胞中PAL和TAT活化及Sal B合成所必需的信号分子,分别考查H2O2清除剂CAT、H2O2淬灭剂 DMTU和 NADPH氧化酶抑制剂IMD对SA处理下丹参悬浮细胞中PAL和TAT活化及Sal B合成的影响。
2.3.1 CAT在SA及外源施加H2O2诱导丹参培养细胞中H2O2产生及Sal B积累过程中的作用
100 U CAT单独处理丹参培养细胞时,CAT组与对照组 (H2O) 相比,H2O2及Sal B含量均没有明显变化 (图4);当用CAT与22 mg/L SA或10 mmol/L H2O2联合处理时,CAT对外源H2O2诱导的丹参培养细胞内H2O2及Sal B的含量均具有消除作用,但不影响SA诱导丹参培养细胞内H2O2的产生及Sal B的积累。这一结果说明,外源施加的CAT不影响SA诱导的丹参培养细胞内H2O2产生及Sal B积累,但可以通过清除细胞外源H2O2从而消除H2O2引起的细胞内H2O2的产生和Sal B的积累。主要是因为CAT是非细胞通透性分子,外源施加不能清除掉细胞内的H2O2。
2.3.2 DMTU在外源施加SA及H2O2诱导丹参培养细胞中H2O2产生及Sal B积累过程中的作用
分别用100、500和700 μmol/L的DMTU单独处理丹参培养细胞,与对照组 (H2O) 相比,当DMTU的浓度为100 μmol/L时,丹参培养细胞中H2O2及Sal B的产生受到抑制;当DMTU的浓度为500 μmol/L时,丹参细胞中H2O2及Sal B的含量极显著降低 (图5);当DMTU的浓度为700 μmol/L时,细胞中H2O2及Sal B的产生被完全抑制 (数据未显示)。
分别用100、500和700 μmol/L的DMTU与 22 mg/L SA或10 mmol/L H2O2联合处理丹参培养细胞,500 μmol/L的DMTU明显抑制了外源施加的H2O2对细胞内H2O2及Sal B的诱导作用(图5);700 μmol/L的DMTU完全抑制了外源施加H2O2或SA对丹参细胞内H2O2及Sal B的诱导作用 (图中未显示)。
以上结果表明,500 μmol/L的DMTU对丹参细胞内H2O2及Sal B合成积累的抑制作用可以被外源施加的H2O2或SA所逆转;DMTU对H2O2或SA诱导丹参培养细胞内H2O2及Sal B的产生的抑制作用具有浓度依赖性。

图4 CAT (100 U) 对SA (22 mg/L) 和外源H2O2 (10 mmol/L) 处理诱导丹参培养细胞产生H2O2及Sal B含量的影响Fig. 4 Effects of CAT (100 U) on H2O2 and Sal B content treated with SA (22 mg/L) and H2O2 (10 mmol/L). 8-d-old cells treated with CAT before SA treatment 30 min were harvested 8 h and 2 d later, and the H2O2 and Sal B contents were then determined. Values are means of three independent experiments. Bars represented standard errors.

图5 DMTU对SA (22 mg/L) 和外源施加H2O2 (10 mmol/L) 处理诱导丹参培养细胞产生H2O2及Sal B含量的影响Fig. 5 Effects of different concentrations of DMTU on H2O2 and Sal B content treated with SA (22 mg/L) and H2O2 (10 mmol/L). 8-d-old cells treated with DMTU before SA treatment 30 min as indicated were harvested 8 h and 2 d later, and the H2O2 and Sal B contents were then determined. Values are means of three independent experiments. Bars represented standard errors.1: H2O; 2: SA; 3: H2O2; 4: 100 μmol/L DMTU; 5: 500 μmol/L DMTU; 6: 100 μmol/L DMTU+SA; 7: 500 μmol/L DMTU+SA; 8: 100 μmol/L DMTU+H2O2; 9: 500 μmol/L DMTU+H2O2.
2.3.3 IMD在外源施加SA及H2O2诱导丹参培养细胞中H2O2产生及Sal B积累过程中的作用
NADPH氧化酶是植物细胞内 H2O2产生的主要来源[14,33-34]。IMD是NADPH氧化酶特异性抑制剂,能够有效抑制NADPH氧化酶活性[22-23]。前文证明了细胞内的 H2O2由SA诱导产生且对Sal B合成积累具有一定的作用,为了进一步明确 H2O2为SA诱导产生的细胞内的信号分子在诱导次生代谢物合成积累中的作用,用IMD抑制丹参培养细胞内 H2O2的产生,考察H2O2的作用。
用100~300 μmol/L的IMD单独处理时,与对照组 (H2O) 相比,IMD可以有效抑制培养细胞中H2O2及Sal B的产生;用100 μmol/L的IMD与22 mg/L的SA或10 mmol/L的H2O2联合处理时 (图6),100 μmol/L的IMD的抑制作用可以被外源施加的H2O2或SA逆转。当IMD的浓度高于100 μmol/L时,IMD的抑制作用不会被外源施加的H2O2或SA逆转 (图中未显示)。原因是当用较高浓度的IMD处理时,IMD通过抑制NADPH氧化酶活性从而抑制H2O2产生,而H2O2又是介导Sal B产生的信号分子,从而导致Sal B合成量降低;当用较高浓度的IMD与SA联合处理时,由于NADPH氧化酶的活性完全被抑制,SA又无法诱导NADPH氧化酶活化,从而无法诱导H2O2产生,最终导致Sal B的合成积累受阻。
综上所述,SA在诱导丹参培养细胞Sal B合成积累过程中依赖于 NADPH氧化酶产生的H2O2,H2O2在介导SA诱导Sal B合成过程中起着信号分子的作用。
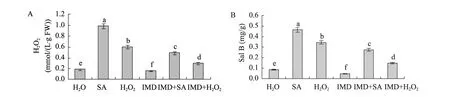
图6 IMD (100 μmol/L) 对SA (22 mg/L) 和外源施加H2O2 (10 mmol/L) 处理诱导丹参培养细胞产生H2O2及Sal B含量的影响Fig. 6 Effects of IMD (100 μmol/L) on H2O2 and Sal B content treated with SA (22 mg/L) and H2O2 (10 mmol/L). 8-d-old cells treated with IMD before SA treatment 30 min as indicated were harvested 8 h and 2 d later, and the H2O2 and Sal B contents were then determined. Values are means of three independent experiments. Bars represented standard errors.
3 讨论与结论
在诱导子胁迫下,植物细胞可以活化多种生理和生化反应[13],包括系统获得抗性 (SAR) 和过敏反应 (HR),衰老、细胞程序化死亡、气孔关闭、细胞壁发育等[14]。其中通过过敏反应生成次生代谢物来缓解外界胁迫是植物细胞最典型的防卫反应之一。SA作为诱导子可以有效提高丹参培养细胞中过氧化物酶 (POD)、多酚氧化酶(PPO) 及苯丙氨酸解氨酶 (PAL) 的活性[35],而这些酶与植物抗逆性密切相关,是植物防卫和生化反应的重要指标,酶活性的增高在一定程度上表征了植物细胞次生代谢能力的增强,有利于次生代谢产物的合成和积累。SA有效地诱导丹参培养细胞中与次生代谢相关的酶类,如 PAL和TAT活化及次生代谢产物咖啡酸和丹酚酸B的合成积累[24,35]。本研究观察到,SA处理丹参培养细胞后,PAL和TAT活性均有所升高,二者在作用时间上互补,共同起着促进丹参培养细胞中Sal B合成积累的作用。
SA在诱导防御反应中的作用机制是通过上游调控活性氧水平 (如 H2O2含量) 来完成[22],如外源施加SA可以有效诱导烟草和拟南芥叶片中H2O2的积累[22,36]。SA诱导丹参培养细胞Sal B合成积累过程中伴随有抗氧化酶类如 POD、SOD、CAT活性的变化[24],表明SA诱导Sal B积累过程中有活性氧的参与。本研究结果显示,SA诱导丹参培养细胞中 H2O2的产生先于 PAL活化及 Sal B合成加强,说明丹参细胞中 H2O2的产生位于PAL活化和Sal B合成途径激活的上游。这与Hung等[16]对ABA诱导水稻细胞花青素合成积累的研究结果相一致。
本实验中,外源施加低浓度的 H2O2可以有效促进丹参培养细胞中PAL和TAT活化和Sal B的合成积累 (图2),表明H2O2是触发丹参细胞中PAL和TAT活化及Sal B合成加强的充分条件,且Sal B的合成积累对H2O2具有浓度依赖性(图3),但即使是在最适H2O2浓度 (10 mmol/L)作用下,丹参细胞中Sal B含量仍低于SA处理组,且TAT活性升高起始于H2O2和PAL的第1个峰值出现之后,结束于H2O2第2个峰值出现之后 (图1),说明H2O2是介导Sal B合成的重要信号分子,但不是唯一的决定因子。在丹参细胞中除了 H2O2外,可能还存在着其他信号分子或信号途径共同参与介导SA诱导丹参细胞中Sal B合成。
CAT是H2O2的有效清除剂,只能清除细胞外的H2O2,对细胞内的H2O2没有清除作用[4,13]。本实验中,CAT对外源施加的H2O2诱导丹参培养细胞内H2O2的产生及Sal B含量的积累具有消除作用,但不影响SA诱导丹参培养细胞内H2O2的产生及Sal B的合成积累,说明CAT对丹参培养细胞内H2O2产生及Sal B的合成并无作用,但是可以通过清除细胞外源 H2O2从而消除 H2O2对丹参细胞内H2O2的产生和Sal B合成的促进作用。由于CAT不能透过细胞质膜,所以对SA诱导丹参细胞内H2O2产生及Sal B合成积累没有产生影响,进一步说明 H2O2是由SA诱导后在丹参细胞内产生并起作用。
DMTU作为一种H2O2淬灭剂可以有效清除细胞内的H2O2,如DMTU可以有效抑制ABA诱导水稻细胞中花青素的产生[28]。本实验用500 μmol/L的DMTU处理可以抑制丹参细胞内H2O2及Sal B的产生,且这种抑制作用可以被外源施加的 H2O2或 SA逆转;但较高浓度(700 μmol/L) 的DMTU可以完全抑制外源施加的H2O2或SA对丹参细胞内H2O2及Sal B的诱导作用,且抑制作用不可被 SA或H2O2逆转,表明一定浓度的DMTU可以削弱H2O2或SA对丹参细胞中Sal B合成的诱导作用,说明SA诱导丹参培养细胞合成Sal B是通过H2O2所介导的信号转导途径。
NADPH氧化酶是植物细胞产生 H2O2的主要酶类[31,37]。IMD能够有效抑制NADPH氧化酶的活性,从而抑制H2O2的产生。用0.1 mmol/L的IMD处理可以有效清除ABA诱导的水稻叶片中由NADPH氧化酶产生的H2O2[15];100 μmol/L的IMD降低了ABA诱导的水稻叶片中花青素的合成,说明 H2O2可能作为信号分子介导花青素的合成[16]。本实验用100 μmol/L IMD与22 mg/L的SA或H2O2联合处理丹参培养细胞,发现IMD对细胞内H2O2和Sal B的抑制作用可以被外源施加的H2O2或SA逆转。当用浓度大于100 μmol/L的IMD处理时,IMD完全抑制了NADPH氧化酶的活性,以致完全阻断了SA诱导Sal B的合成。说明IMD对丹参培养细胞内Sal B合成积累的抑制作用依赖于由 NADPH氧化酶所产生的H2O2,H2O2作为信号分子在SA诱导丹参细胞合成Sal B中起重要作用。
综上所述,水杨酸可以诱导丹参悬浮细胞中PAL和TAT活化、Sal B合成及H2O2产生,且水杨酸诱导丹参细胞中H2O2的产生先于PAL活化及Sal B合成加强,说明丹参细胞中H2O2的产生可能位于 PAL活化及 Sal B合成途径激活的上游。外源H2O2单独处理也能提高丹参细胞中PAL和TAT的活性及Sal B含量,表明H2O2是触发丹参细胞中PAL和TAT活化及Sal B合成加强的充分条件。H2O2清除剂 CAT、H2O2的淬灭剂DMTU和NADPH氧化酶抑制剂IMD阻断了水杨酸对丹参悬浮细胞中H2O2及Sal B合成的促进作用,又表明 H2O2是水杨酸诱导子诱发丹参细胞中Sal B合成加强的必要条件。但由于SA和外源H2O2在诱导丹参培养细胞Sal B合成积累过程中,H2O2的产生和TAT的活化没有时间上的相关性,且即使在最佳浓度H2O2诱导下,H2O2诱导的Sal B的合成量也未达到SA处理组,说明丹参细胞中还存在着其他信号分子或其他信号途径共同参与介导SA诱导Sal B合成积累。以上结果说明,H2O2是水杨酸促进丹参培养细胞中Sal B合成、PAL和TAT活化信号转导途径中所必需的信号分子,但不是唯一的信号分子。
REFERENCES
[1] The Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia. Beijing: Chemical Industry Press, 2005: 53.中华人民共和国药典委员会. 中国药典. 北京:化学工业出版社, 2005: 53.
[2] Du GH, Zhang JT. Water-soluble phonetic compounds of Salvia miltiorrhiza advances in research of salvianolic acid. Bas Med Sci Clin, 2000, 20(5): 10−14.杜冠华, 张均田. 丹参水溶性有效成分——丹酚酸研究进展. 基础医学与临床, 2000, 20(5): 10-14.
[3] Pellinen RI, Korhonen MS, Tauriainen AA, et al. Hydrogen peroxide activates cell death and defense gene expression in Birch. Plant Physiol, 2002, 130(2): 549−560.
[4] Kima SH, Kronstad JW, Ellis BE. Induction of phenylalanine ammonia-lyase activity by tryptophan in Ustilago maydis. Phytochemistry, 2001, 58(6): 849−857.
[5] Guo B, Liang YC, Zhu YG, et al. Role of salicylic acid in alleviating oxidative damage in rice roots (Oryza sativa) subjected to cadmium stress. Environ Pollut, 2007, 147(2): 743−749.
[6] Chen ZX, Silvia H, Klessig DF. Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid. Science, 1993, 262(5141): 1883−1886.
[7] Dat JF, Foyer CH, Scott IM. Changes in salicylic acid and antioxidants during induced thermo tolerance in mustard seedlings. Plant Physiol, 1998, 118(4): 1455−1461.
[8] Kang HM, Saltveit ME. Chilling tolerance of maize, cucumber and rice seedling leaves and roots are differentially affected by salicylic acid. Physiol Plant, 2002, 115(4): 571–576.
[9] Borsani O, Valpuesta V, Botella MA. Evidence for a role of salicylic acid in the oxidative damage generated by NaCl and osmotic stress in Arabidopsis seedlings. Plant Physiol, 2001, 126(3): 1024−1030.
[10] Metwally A, Finkemeier I, Georgi M, et al. Salicylic acid alleviates the cadmium toxicity in barley seedlings. Plant Physiol, 2003, 132(1): 272–281.
[11] Miao ZQ, Wei ZJ, Yuan YJ. Study on the effects of salicylic acid on tuxol biosynthesis. Chin J Biotech, 2000, 16(4): 509−513.苗志奇, 未作君, 元英进. 水杨酸在紫杉醇生物合成中诱导作用的研究. 生物工程学报, 2000, 16(4): 509−513.
[12] Zhang Y, Wang Y, Jiang SC, et al. Cloning of the differential expression fragment from ginseng culture induced by salicylic acid. Genomics Appl Biol, 2009, 28(2): 245−250.张悦, 王义, 蒋世翠, 等. 水杨酸诱导下人参培养物差异表达基因片段的克隆. 基因组学与应用生物学, 2009, 28(2): 245−250.
[13] Neill S, Desikan R, Hancock J. Hydrogen peroxide signalling. Curr Opin Plant Biol, 2002, 5(5): 388−395.
[14] Alvarez ME, Pennell RI, Meijer PJ, et al. Reactive oxygen intermediates mediate a systemic signal network in the establishment of plant immunity. Cell, 1998, 92(6): 773−784.
[15] Melillo MT, Leonettil P, Bongiovanni M, et al. Modulation of reactive oxygen species activities and H2O2accumulation during compatible and incompatible tomato-root-knot nematode interactions. New Phytol, 2006, 170(3): 501−512
[16] Hung KT, Hsu YT, Kao CH. Hydrogen peroxide is involved in methyl jasmonate-induced senescence of rice leaves. Physiol Plant, 2006, 127(2): 293−303.
[17] Levine A, Tenhaken R, Dixon RA, et al. H2O2from the oxidative burst orchestrates the plant hypersensitive disease resistance response. Cell, 1994, 79(4): 583−593.
[18] Lee S, Choi H, Suh S, et al. Oligogalacturonic acid and chitosan reduce stomatal aperture by inducing the evolution of reactive oxygen species from guard cells of tomato and Commelina communis. Plant Physiol, 1999, 121(1): 147−152.
[19] Zhang X, Zhang L, Dong FC, et al. Hydrogen peroxide is involved in abscisic acid-induced stomatal closure in Vicia faba. Plant Physiol, 2001, 126(4): 1438−1448
[20] Li SW, Xue LG, Xu SJ, et al. Hydrogen peroxide involvement in formation and development of adventitious roots in cucumber. Plant Growth Regul, 2007, 52(2): 173−180.
[21] Xu MJ, Dong JF, Zhang XB. NO and H2O2signal interaction in the cell-mediated heat shock-induced synthesis of hypericin in Hypericum. Sci China (Ser C): Life Sci, 2008, 38(7): 643−653.徐茂军, 董菊芳, 张新波. NO和H2O2在介导热激诱发金丝桃细胞合成金丝桃素中的信号互作.中国科学(C 辑): 生命科学, 2008, 38(7): 643−653.
[22] Chen Z, Ricigliano JW, Klessig DF. Purification and characterization of a soluble salicylic acid-binding protein from tobacco. Proc Natl Acad Sci USA, 1993, 90(20): 9533−9537.
[23] Ganesan V, Thomas G. Salicylic acid response in rice: influence of salicylic acid on H2O2accumulation and oxidative stress. Plant Sci, 2001, 160(6): 1095−1106.
[24] Dong J, Wan GW, Liang ZS. Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salvia miltiorrhiza cell culture. J Biotechnol, 2010, 148(2/3): 99−104.
[25] Wan GW, Dong JE, Lang ZS, et al. Phenylalanine ammonia lyase (PAL) and polyphenol oxidase (PPO) activities of in vitro root under different culturing conditions in Salvia miltiorrhiza. Acta Bot Bor-Occident Sin, 2007, 27(12): 2417−2477.宛国伟, 董娟娥, 梁宗锁, 等. 培养条件对离体丹参根苯丙氨酸解氨酶和多酚氧化酶活性的影响. 西北植物学报, 2007, 27(12): 2471−2477.
[26] Li SW, Xue LG, Xu SJ, et al. Hydrogen peroxide acts as a signal molecule in the adventitious root formation of mung bean seedlings. Environ Exp Bot, 2009, 65(1): 63−71.
[27] Casano LM, Martín M, Sabater B. Hydrogen peroxide mediates the induction of chloroplastic Ndh complex under photooxidative stress in Barley. Plant Physiol, 2001, 125(3): 1450−1458.
[28] Kuo TH, Cheng DG, Hsu YT, et al. Abscisic acid-induced hydrogen peroxide is required for anthocyanin accumulation in leaves of rice seedlings. J Plant Physiol, 2008, 165(12): 1280−1287.
[29] Tanou G, Molassiltis A, Diamantidis G. Hydrogen peroxide- and nitric oxide-induced systemic antioxidant prime-like activity under NaCl-stress and stress-free conditions in citrus plants. J Plant Physiol, 2009, 166(17): 1904−1913.
[30] Wang J, Higins VJ. Nitric oxide modulates H2O2-mediated defenses in the Colletotrichum coccodestomato interaction. Physiol Mol Plant Pathol, 2005, 67(3/5): 131−137.
[31] Auh CK, Murphy TM. Plasma membrane redox enzyme is involved in the synthesis of O2-and H2O2by phytophthora elicitor-stimulated rose cells. Plant Physiol, 1995, 107(4): 1241−1247.
[32] Bestwick CS, Brown IR, Bennett MHR, et al. Localization of hydrogen peroxide accumulation during the hypersensitive reaction of lettuce cells to Pseudomonas syringae pv phaseolicola. Plant Cell, 1997, 9(2): 209−221.
[33] Desikan R, Cheung MK, Bright J, et al. ABA, hydrogen peroxide and nitric oxide signalling in stomatal guard cells. J Exp Bot, 2004, 55(395): 205−212.
[34] Potikha TS, Collins CC, Johnson DI, et al. The involvement of hydrogen peroxide in the differentiation of secondary walls in cotton fibers. Plant Physiol, 1999, 119(3): 849−858.
[35] Wan GW. Effect of elicitor on accumulation of salvianolic acid and secondary metabolism enzyme activities in Salvia miltiorrhiza Bunge callus[D]. Yangling: Northwest Agricultural and Forest University, 2008.宛国伟. 诱导子对丹参酚酸类化合物含量及合成酶的影响[D]. 杨凌: 西北农林科技大学, 2008.
[36] Rao MV, Paliyath G, Ormrod DP, et al. Influence of salicylic acid on H2O2production, oxidative stress, and H2O2-metabolizing enzymes: salicylic acid-mediated oxidative damage requires H2O2. Plant Physiol, 1997, 115(1): 137−149.
[37] Foreman J, Demidchik V, Bothwell JHF, et al. Reactive oxygen species produced by NADPH oxidase regulate plant cell growth. Nature, 2003, 422(6930): 442−446.