Exendin-4类似物的克隆、表达与体内生物活性检测
李泰明,谷春娇,葛晓宇,李哲哲,王丹,马艳红,刘涛,张美由,李丽,刘景晶
中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 210009
Exendin-4是从希拉毒蜥唾液中分离到的一种含有 39个氨基酸的多肽,与人胰高血糖素样肽-1 (GLP-1) 有 53%的同源性[1]。作为 GLP-1受体激动剂,Exendin-4具有促进葡萄糖依赖性的胰岛素分泌[2],刺激胰岛 β细胞再生[3],抑制餐后胰高血糖素的产生、延迟胃排空、抑制食欲等作用[4-5],并且其半衰期远远长于 GLP-1[6]。Exendin-4的这些生理功能使其在 2型糖尿病的治疗中显示了广阔的前景。
化学合成的Exendin-4的酰胺化修饰类似物已于2005年在美国FDA批准上市 (商品名Byta)[7],但化学合成的Exendin-4类似物存在成本较高,价格昂贵,步骤多,收率低,过程涉及有害化学物质等缺点[8]。现有的基因工程方法合成的Exendin-4常出现表达量较低的情况[9-11],一方面可能是由于天然Exendin-4 C端36-39位氨基酸存在 PPPS的刚性结构,有研究表明[12-13],Exendin-4 C端的 31-39位氨基酸形成的色氨酸笼子在与GLP-1受体的结合方面作用很小,截去了PPPS对活性影响不大,所以本实验优选了截短型的 Exendin-4[14],并在截短型的 Exendin-4的N端添加2个脯氨酸与融合伴侣C端的天冬氨酸形成酸水解位点;另一方面是由于小分子多肽在大肠杆菌表达系统中容易降解[15],本实验室将Exendin-4类似物与一含有132个氨基酸的融合伴侣通过酸水解位点连接,在大肠杆菌中实现了融合蛋白的高表达,不需要使用较为昂贵的肠激酶等[16-17],在盐酸作用下即可将融合伴侣与目的肽分离,根据目的肽与融合伴侣等电点的差异,通过离子交换层析分离得到Exendin-4类似物,获得的目的肽中不含有二硫键,通过http://mobyle. pasteur.fr/cgi-bin/portal.py网站在线预测其二级结构为线性,与Exendin-4的二级结构相似,包涵体经处理后不需要复性等步骤,分离纯化方法简便。健康雄性ICR小鼠口服糖耐量实验初步验证Exendin-4类似物的活性。
1 材料与方法
1.1 材料
1.1.1 试剂
分子克隆工具酶及 T4 DNA 连接酶(Fermentas公司);质粒抽提试剂盒 (南京天为生物科技有限公司);PCR胶回收试剂盒 (TaKaRa公司);分子量截留量2 000 Da的透析袋、考马斯亮蓝蛋白测定试剂盒(上海生工生物工程有限公司);引物合成 (GeneScript Corporation公司);DNA测序 (南京金思瑞生物技术有限公司);Sephadex A-50阴离子交换树脂 (GE health);GLP-1标准品为中国药科大学药化实验室赠与;胰岛素注射液 (40 U/mL) 购自江苏万邦公司;血糖测试仪和血糖试纸 (北京怡成生物电子技术有限公司);小鼠胰岛素测定试剂盒 (瑞典Mercodia公司);其余试剂均属国产分析纯。
1.1.2 质粒、菌株与动物
重组质粒pED[18]及重组质粒5#由本实验室构建保存,菌株E. coli BL21由本实验室保存。清洁级6~8周龄,雄性ICR小鼠购自扬州大学实验动物中心[合格证号: SCXK(苏)2007-0001]。
1.2 方法
1.2.1 Exendin-4类似物基因的克隆
构建过程见图1,构建所需引物见表1。PCR反应以pED质粒中的Pro-Pro-Exendin-4-Asp基因为模板,M1及M2分别为上下游引物,反应参数为:94 ℃ 5 min ;94 ℃ 1 min,56 ℃,40 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。PCR产物进行琼脂糖凝胶电泳,回收。
1.2.2 融合伴侣基因的改造
根 据 铰 链 区 (-CPPCPAP-) 和 八 肽(-KRKRKKSR-) 的氨基酸序列,选用大肠杆菌偏爱密码子转化成核苷酸序列,插入 pED载体融合伴侣C-端的苏氨酸的核苷酸序列之后,并在融合伴侣 5¢端增设 NcoⅠ酶切位点,3¢端增设BamHⅠ酶切位点,在计算机辅助分析后,PCR反应以pED质粒中融合伴侣基因为模板,P1及P2分别为上下游引物,反应参数为:94 ℃ 5 min; 94 ℃ 0.5 min,55 ℃ 0.5 min ,72 ℃ 1 min,28个循环;72 ℃延伸5 min。PCR反应产物经琼脂糖凝胶电泳后回收纯化。
PCR产物经NcoⅠ、BamHⅠ37℃双酶切2 h,纯化酶切产物Ⅰ。pED质粒经NcoⅠ、BamHⅠ于37 ℃双酶切2 h,纯化酶切产物Ⅱ。T4 DNA连接酶16 ℃连接酶切产物Ⅰ、Ⅱ。将连接产物转化E. coli BL21感受态细胞后涂布于含100 μg/mL卡那霉素的LB固体培养基上,37 ℃过夜培养,挑取阳性单克隆进行菌落 PCR鉴定后测序,将测序正确的重组的pED质粒命名为5#质粒。
1.2.3 Exendin-4类似物基因表达载体的构建
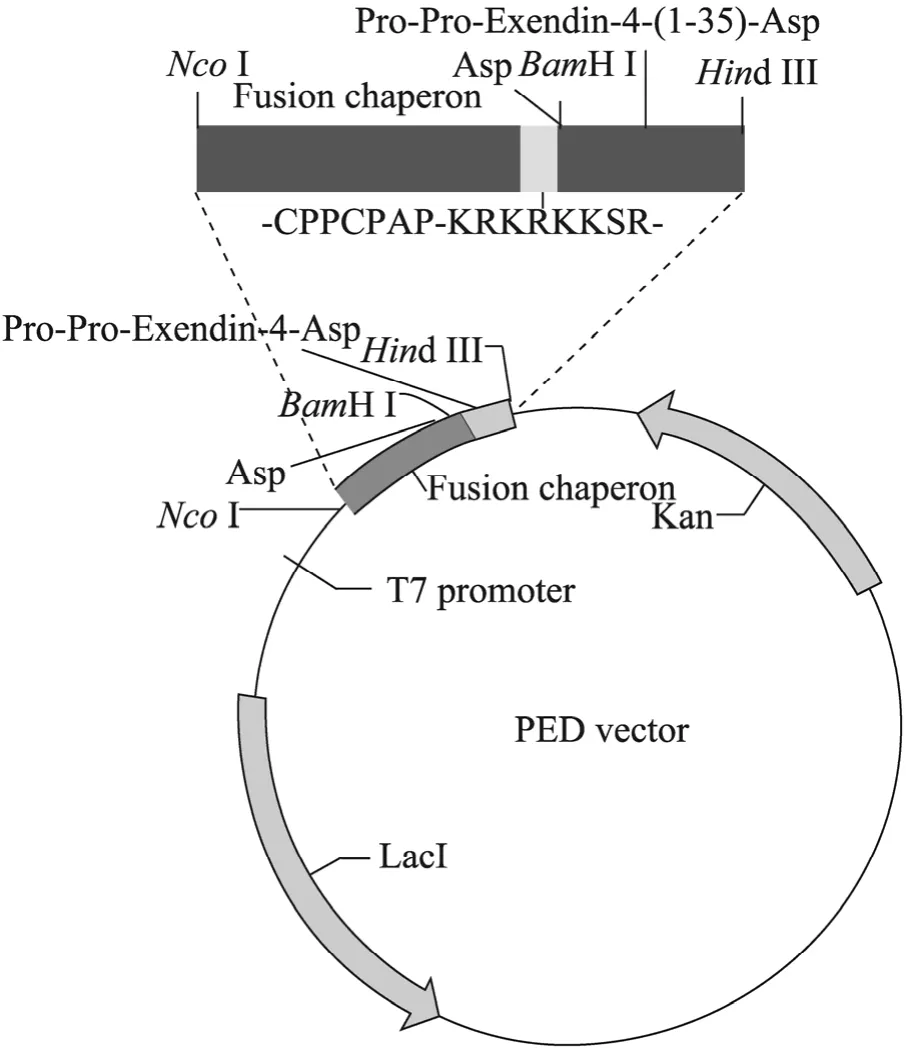
图1 5#重组质粒构建过程示意图Fig. 1 Construction of 5# recombinant plasmid.
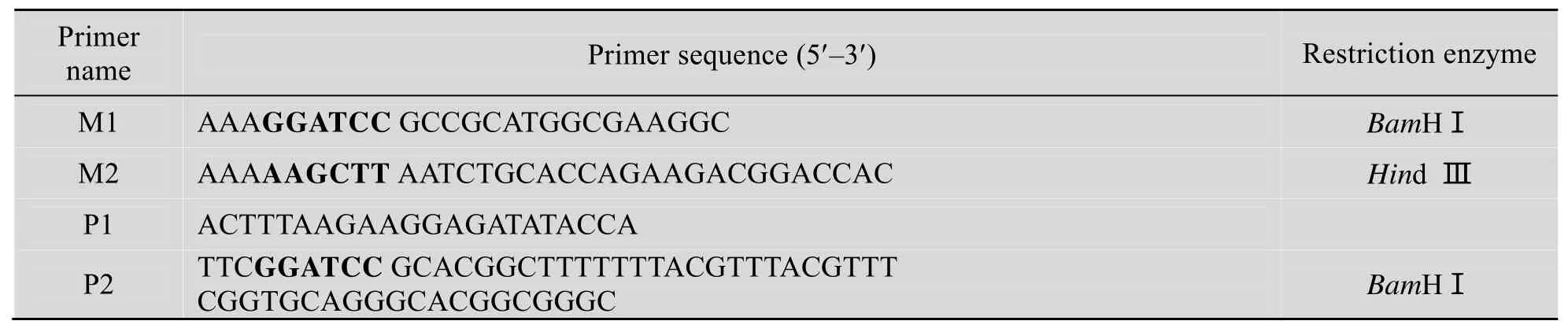
表1 引物DNA序列Table 1 DNA sequence of primers
Exendin-4类似物基因的 PCR 产物经BamHⅠ、Hind Ⅲ 37 ℃双酶切2 h,纯化酶切产物Ⅰ。5#质粒经 BamHⅠ,Hind Ⅲ 37 ℃双酶切2 h,纯化酶切产物Ⅱ。T4 DNA连接酶16 ℃过夜连接酶切产物Ⅰ、Ⅱ。将连接产物转化E. coli BL21感受态细胞后涂布于含100 μg/mL卡那霉素的LB固体培养基上,37 ℃过夜培养,挑取阳性单克隆进行菌落PCR鉴定后测序。
1.2.4 融合蛋白的诱导表达及分离纯化
测序正确后,在摇瓶实验的基础上采用优化后的培养条件,以 1%接种量在 LB培养基中37 ℃、220 r/min振荡培养8~10 h后,5%的接种量转接于6.5 L玉米浆发酵液中,添加1%色拉油作为消泡剂,搅拌转数为560 r/min,上罐后3.5 h后OD600达到1.4,加入终浓度为5 mmol/L的乳糖诱导,8 h后收集发酵液,4 ℃、12 000 r/min离心15 min,收集菌体,SDS-PAGE检测融合蛋白的表达情况。
分离纯化过程与文献[19]相似。将收集到的菌体按 4 mL/g 的体积加入菌体裂解缓冲液(0.02%溶菌酶,0.75% TritonX-100,50 mmol/L Tris-HCL,1 mmol/L EDTA) 37 ℃、220 r/min振荡培养,裂解至溶液不粘滞时,4 ℃、12 000 r/min离心20 min收集沉淀。每克裂解后的菌体沉淀加入10 mL包涵体洗涤液1 (0.2% TritonX-100,50 mmol/L Tris-HCl),将包涵体悬浮于洗涤液1中剧烈振荡2 h后,4 ℃、12 000 r/min离心20 min收集沉淀。将沉淀加入适量蒸馏水中重悬洗涤,洗涤后4 ℃、12 000 r/min离心20 min收集沉淀。得到的包涵体在包涵体洗涤液2 (2 mol/L尿素,10% TritonX-100) 中洗涤2次,4 ℃、12 000 r/min离心20 min收集洗涤后的包涵体。每克包涵体加入8 mL包涵体溶解液 (8 mol/L尿素, 50 µmol/L Tris-HCl),混匀,4 ℃搅拌过夜,4 ℃、12 000 r/min离心20 min,收集上清液。将得到的上清进行乙醇分级沉淀,首先加入0.5倍体积的−20 ℃预冷的无水乙醇,边加边轻轻搅拌以沉淀杂蛋白,−20 ℃放置20 min,12 000 r/min离心20 min,收集上清。在离心后上清中加入1倍体积的预冷的无水乙醇沉淀融合蛋白,−20 ℃放置20 min,12 000 r/min离心20 min,收集上清。向离心后上清中加入3倍体积的预冷的无水乙醇沉淀融合蛋白,−20 ℃放置2 h,12 000 r/min离心20 min后收集沉淀,得到融合蛋白。
1.2.5 融合蛋白的酸水解
融合蛋白中加入50 mmol/L盐酸溶液 (融合蛋白含量为5%),置于48 ℃水浴锅水解48 h,将酸水解后的溶液pH分别调至7.6、9.3,进行等电点沉淀,4 ℃放置2 h后,4 ℃、12 000 r/min离心20 min离心,去除沉淀中的杂蛋白,得到目的肽含量丰富的上清。
1.2.6 Exendin-4类似物的分离纯化
将等电点沉淀离心后的上清液在0.02 mol/L乙酸铵 (pH 5.6) 中透析48 h,上样于0.02 mol/L乙酸铵(pH 5.6) 平衡好的QAE Sephadex A-50离子交换柱,使用含0.05、0.1、0.3、0.5 mol/L NaCl的乙酸铵 (pH 5.6) 溶液进行阶段洗脱,280 nm波长处检测吸收。收集样品,Tris-Tricine-PAGE电泳分析蛋白纯度,透析除盐并冻干。送至中国药科大学分析测试中心进行电喷雾质谱(ESI-MS) 测定Exendin-4类似物相对分子质量。
1.2.7 Exendin-4 类似物的体内生物活性测定
清洁级6~8周龄的健康雄性ICR小鼠,每笼7只,自由饮水摄食,适应环境1周后随机分8组,分别为空白对照组,胰岛素组,GLP-1低剂量给药组,GLP-1中剂量给药组,GLP-1高剂量给药组,Exendin-4低剂量给药组,Exendin-4中剂量给药组,Exendin-4高剂量给药组,每组 7只,称重并编号,实验前禁食12 h,仅给予饮水。胰岛素组皮下注射给予20 μg/kg胰岛素,GLP-1低、中、高剂量给药组及Exendin-4类似物低、中、高剂量给药组分别皮下注射给予20 μg/kg、80 μg/kg、140 μg/kg样品 (上述样品均溶于pH 7.0的灭菌磷酸盐缓冲液后经0.22 μm滤膜过滤除菌);空白对照组小鼠皮下给予等量磷酸盐缓冲液。各组小鼠分别于给药后 15 min,灌胃2.0 g/kg葡萄糖,并于葡萄糖负荷后0、10、20、40、60、80、100、120 min对小鼠进行尾静脉取血,血糖仪测定血糖。给予葡萄糖10~20 min后断尾取血100 μL于含20 μL、0.1 mol/L EDTA的灭菌EP管中,4 ℃、13 000 r/min离心30 s,取上清,小鼠胰岛素含量测定试剂盒检测小鼠血浆中胰岛素含量,所有实验数据均以平均数±标准差表示,采用t检验进行组间比较。
2 结果
2.1 Exendin-4类似物基因表达载体的构建
PCR扩增产物经电泳后在约131 bp处有明亮条带,与已知Exendin-4类似物基因大小 (131 bp)相吻合,见图2。成功将pED质粒的融合伴侣改造为 5#质粒具有的融合伴侣,以重组 5#质粒为模板,M3、M2分别为上下游引物进行融合蛋白基因的PCR扩增,PCR产物在约531 bp出现条带 (图3),与预期结果相符。测序结果表明,Exendin-4类似物基因成功插入 5#载体的BamHⅠ和Hind Ⅲ酶切位点之间,序列比对后与预期结果完全一致。
2.2 融合蛋白的表达及 Exendin-4类似物的纯化

图2 Exendin-4类似物基因的PCR扩增结果Fig. 2 Application results of Exendin-4 analogue gene by PCR. 1: DNA molecular marker; 2: product of PCR.
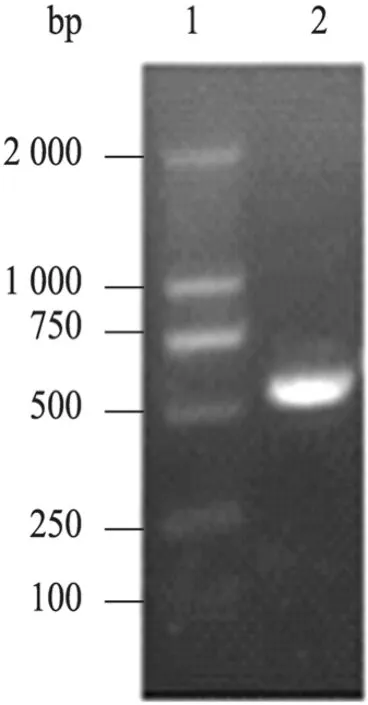
图3 重组质粒的PCR验证Fig. 3 PCR identification of recombinant plasmid. 1: DNA molecular marker; 2: product of recombinant plasmid.
乳糖诱导表达的融合蛋白经 SDS-PAGE电泳分析,融合蛋白以包涵体形式存在。与未经乳糖诱导组相比,在相对分子量约22.11 kDa处可见融合蛋白的表达条带,大小与预期相符,经过BandScan软件分析,表达量约占菌体总蛋白的40% (图4)。离子交换层析分离Exendin-4类似物过程中,0.3 mol/L NaCl洗脱时可以收集到样品峰,经 Tris-Tricine-PAGE电泳后,BandScan软件分析目的肽的纯度为91.8% (图5),透析并冻干,于−20℃保存。电喷雾质谱给出的一组峰分子量都相差22,是加了不同个数的钠离子峰。如:m/z 4139 是[M+Na]+,m/z 4161 是[M+2Na-H]+,m/z 4183是[M+3Na-2H]+等等,由此分析出目的肽相对分子质量为4 116.4 Da,与理论推算值4 115.95 Da基本一致 (图6)。
2.3 Exendin-4类似物的降血糖活性检测
结果见表 2。Exendin-4各组给药后,给予2.0 g/kg葡萄糖,在葡萄糖负荷后,Exendin-4各剂量组随着剂量的增加,存在剂量依赖关系。Exendin-4各剂量组与空白对照组相比能够显著降低血糖浓度 (P<0.01),与 GLP-1各剂量组相比降糖作用较为显著 (P<0.01),与胰岛素组相比并未引起低血糖效应。
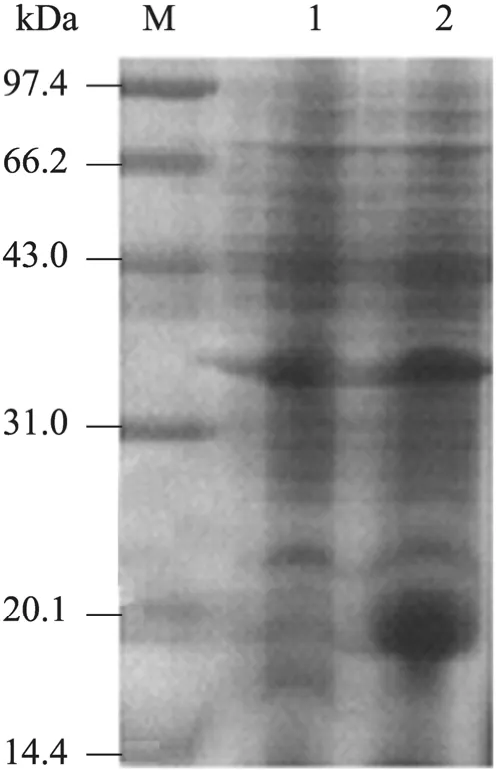
图4 SDS-PAGE电泳检测融合蛋白表达情况Fig. 4 SDS-PAGE analysis of fusion protein. M: protein molecular marker; 1: non-inducing expression of fusion protein; 2: lactose-induced expression of fusion protein.

图5 Tris-Tricine-PAGE电泳检测Exendin-4类似物纯度Fig. 5 The purity analysis of Exendin-4 analogue by Tris-Tricine-PAGE. 1: Exendin-4 analogue; 2: insulin.

图6 Exendin-4类似物的电喷雾质谱分析Fig. 6 ESI-MS analysis of Exendin-4 analogue.
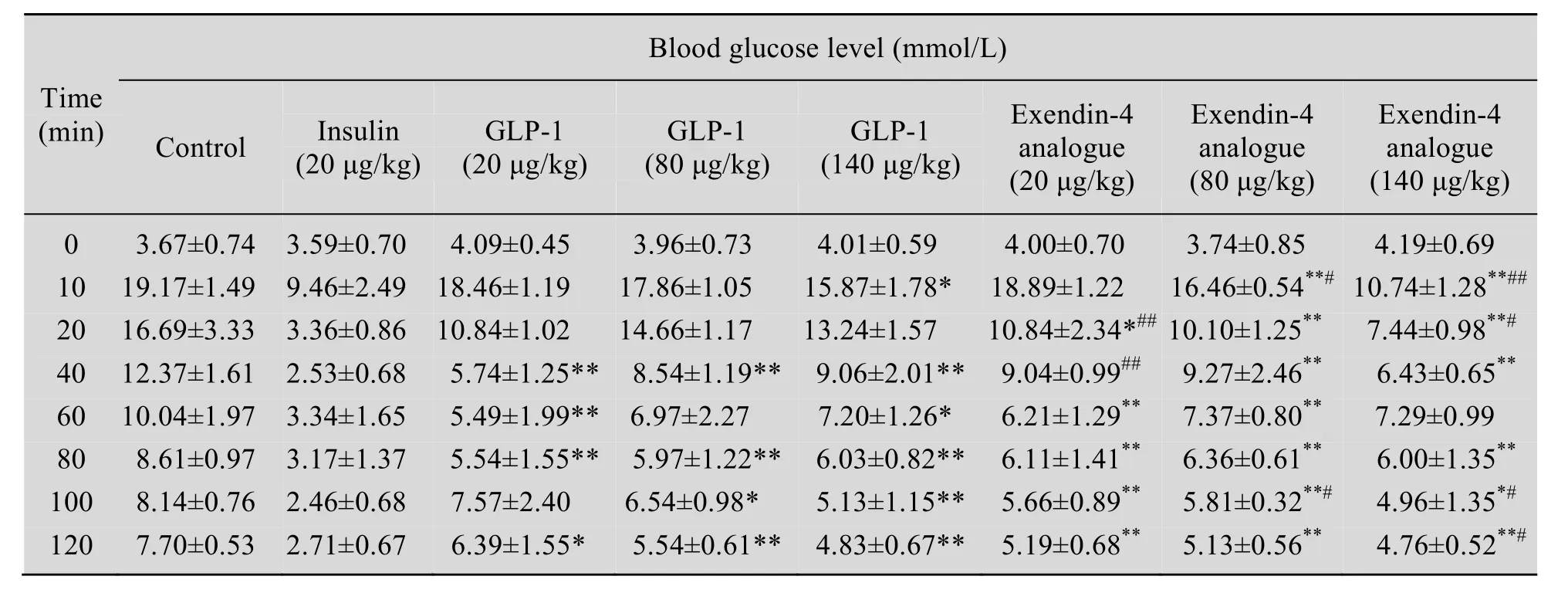
表2 Exendin-4类似物的降血糖活性 (与空白对照组比较*P<0.05,**P<0.01;与 GLP-1组比较#P<0.05, ##P<0.01)Table 2 The activity of Exendin-4 analogue in decrease hypoglycaemia (Compare with control *P<0.05, **P<0.01; compare with GLP-1 #P<0.05, ##P<0.01)
2.4 Exendin-4类似物的促进胰岛素分泌活性检测
从图 7可以看出,Exendin-4各给药组小鼠在葡萄糖负荷后,其血清胰岛素水平均有升高趋势,并呈剂量依赖性,与空白组相比,Exendin-4类似物的低、中、高剂量均能显著升高血浆胰岛素浓度 (P<0.01);Exendin-4类似物的低、中、高剂量组与 GLP-1各剂量组相比亦能显著性地升高血浆胰岛素浓度(P<0.01)。
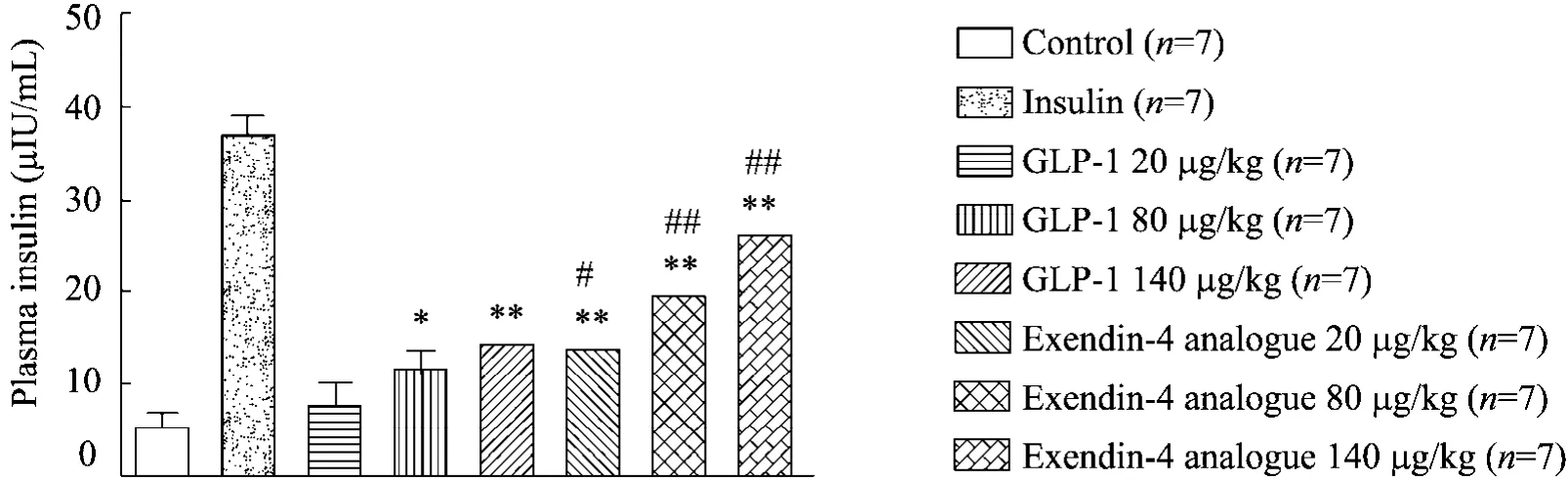
图7 Exendin-4类似物对血液胰岛素浓度影响 (与空白对照组比较*P<0.05, **P<0.01;与GLP-1组比较#P<0.05, ##P<0.01)Fig. 7 The activity of Exendin-4 analogue in plasma insulin. Compare with control *P<0.05, **P<0.01; compare with GLP-1 #P<0.05, ##P<0.01.
3 讨论
目前通过基因工程方法获得Exendin-4及其类似物的表达系统共有两类:一类是真核表达系统,如张红绪等[20]报道了Exendin-4基因在巴斯德毕赤酵母中的分泌表达,表达量较低;王晖等[21]同样在巴斯德毕赤酵母中实现了 Exendin-4类似物基因串联体的分泌表达,表达量较高,但出现了前导序列切割不完全的情况,由于是以肠激酶识别序列连接Exendin-4类似物的串联体,重组蛋白在纯化过程中产生严重降解,即使经离子交换和亲和层析,仍不能去除可能存在的蛋白酶,抑制目的蛋白的降解。另一类是大肠杆菌表达系统,有文献[22]在大肠杆菌中成功分泌表达Exendin-4,表达量较低,为了便于后续分离纯化,其将组氨酸标签与目的肽相连而无法除去,这在一定程度上影响了Exendin-4的活性;本研究中所采用的是大肠杆菌表达系统,融合蛋白以包涵体的形式表达,避免了分泌表达造成的信号肽切割不完全,表达量较低,目的蛋白以肠激酶切割容易降解等缺点,融合蛋白酸水解后在Exendin-4类似物N端残留的脯氨酸在进入体内后,被体内的二肽基肽酶 (DPPIV) 水解,不会影响活性;此外,Exendin-4类似物为线性肽,不需要复性等繁琐步骤。
前人曾利用 pED载体表达 Exendin-4类似物,表达量不高,形成的包涵体结构松散,融合伴侣与目的肽等电点相近,酸水解过程中产生与目的肽分子量相近的杂多肽无法利用等电点沉淀除去,利用分子筛层析无法将目的肽有效分离。本研究 pED载体融合伴侣基因区域增添了CPPCPA肽段及KRKRKKSR肽段的基因,从而成为5#载体。CPPCPAP肽段富含的半胱氨酸使融合蛋白之间以相互交织的二硫键相连,所形成的包涵体结构致密;KRKRKKSR肽段富含的碱性氨基酸使融合伴侣的等电点由5.15升为9.30,与Exendin-4类似物的等电点4.59差距较大,便于等电点沉淀除去杂蛋白及离子交换层析分离纯化目的肽。
由实验结果可以初步判定此种Exendin-4类似物具有促进胰岛素的分泌及调节血糖作用,并且这种作用是葡萄糖浓度依赖性的。本课题组计划在后续的研究中建立2型糖尿病动物模型,长效实验进一步验证其是否具有促进胰岛β细胞增殖及降低糖化血红蛋白 (HbA1c) 水平的作用及其体内药代动力学各相关指标。
REFERENCES
[1] Gedulin BR, Nikoulina SE, Smith PA, et al. Exenatide (Exendin-4) improves insulin sensitivity and β-Cell mass in insulin-resistant obese fa/fa zucker rats independent of glycemia and body weight. Endocrinology, 2005, 146(4): 2069−2076.
[2] Parkes DG, Pittner R, Jodka C, et al. Insulinotropic actions of exendin-4 and glucagon-like peptide-1 in vivo and in vitro. Metabolism, 2001, 50(5): 583−589.
[3] Tourrel C, Bailbé D, Meile MJ, et al. Glucagon-like peptide-1 and Exendin-4 stimulate β-Cell neogenesis in streptozotocin-treated newborn rats resulting in persistently improved glucose homeostasis at adult age. Diabetes, 2001, 50(7): 1562−1570.
[4] Kolterman OG, Buse JB, Fineman MS, et al. Synthetic Exendin-4 (Exenatide) significantly reduces postprandial and fasting plasma glucose in subjects with type 2 diabetes. J Clin Endocrinol Metab, 2003, 88(7): 3082−3089.
[5] Mank CM, Moore CX, Jodka CM, et al. Antiobesity action of peripheral exenatide (exendin-4) in rodents: effects on food intake, body weight, metabolic status and side-effect measures. Int J Obes, 2006, 30(9): 1332−1340.
[6] Hansen KB, Vilsbøll T, Knop FK. Incretin mimetics: a novel therapeutic option for patients with type 2 diabetes-a review. Diabetes Metab Syndr Obes, 2010, 3: 155−163.
[7] Akkati S, Sam KG, Tungha G. Emergence of promising therapies in diabetes mellitus. J Clin Pharmacol, 2011, 51(6): 796−804.
[8] Li TM, Liu T, Zhang MY, et al. Construction and expression of human glucagon-like peptide-2 analog multimers in prokaryotic cells. Pham Biotech, 2011, 18(2): 100−105.李泰明, 刘涛, 张美由, 等. 人胰高血糖素样肽-2类似物基因串联体构建及原核细胞表达. 药物生物技术, 2011, 18(2): 100−105.
[9] Wang XC, Zu XY, Chen HG, et al. Preparation and purification Exendin-4 from Escherichia coli: China, 200810049811. 5. 2009- 11-25.
[10] Yi L, Yin XP, Wei DZ, et al. Expression and purification of Exendin-4 dimer in Escherichia coli and its interaction with GLP-1 receptor in vitro. Protein Pept Lett, 2006, 13(8): 823−827.
[11] Yan R, Ding Y, Yang ZY, et al. New method for preparing and expression recombinant Exendin-4: CN, 201010513310. 5. 2011-03-30.
[12] Runge S, Schimmer S, Oschmann J, et al. Differential structural properties of GLP-1 and Exendin-4 determine their relative affinity for the GLP-1 receptor N-Terminal extracellular domain. Biochemistry, 2007, 46(19): 5830−5840.
[13] Doyle ME, Theodorakis MJ, Holloway HW, et al. The importance of the nine-amino acid C-terminal sequence of exendin-4 for binding to the GLP-1 receptor and for biological activity. Regul Pept, 2003, 114(2/3): 153−158.
[14] Li TM, Gu CJ, Liu JJ, et al. An Exendin-4 analogue: China, 102260346A. 2011-11-30.
[15] Deng Q, Wang CX, Lu JZ, et al. Gene cloning and plasmid construction of recombinant bovine lactoferricin. J Anhui Agri Sci, 2008, 36(11): 4442−4444, 4476.邓强, 王春晓, 鲁健章, 等. 牛乳铁蛋白抗菌肽(Lactoferricin)基因的克隆与表达质粒构建. 安徽农业科学, 2008, 36(11): 4442−4444, 4476.
[16] Yan R, Ding Y, Yang ZY, et al. Expression of recombinant Exendin-4 and a new method of preparation: China, 201010513310. 5. 2011-03-30.
[17] Yin XP, Wei DZ, Yi LN, et al. Expression and purification of exendin-4, a GLP-1 receptor agonist in Escherichia coli. Protein Expr Purif, 2005, 41(2): 259−265.
[18] Zhuang ZH, Shi XM, Wang CX, et al. Study on preparation and activity of a novel recombinant human parathyroid hormone analog Pro-Pro-[Arg11]-hPTH(1-34)-Pro-Pro. Pham Biotech, 2008, 15(5): 337−342.庄志华, 施小明, 王春晓, 等. 重组人甲状旁腺素相关肽Pro-Pro-[Arg11]-hPTH(1-34)-Pro-Pro的制备工艺及活性研究. 药物生物技术, 2008, 15(5): 337−342.
[19] Zhang HX, Zhang Y, Zhou QF, et al. Construction of Exendin-4 eukaryotic expression vector and its expression in P. pastoris. China Pharm, 2009, 20(22): 1707−1709.张红绪, 张怡, 周庆峰, 等. Exendin-4真核表达载体的构建及其在毕赤酵母中的表达. 中国药房, 2009, 20(22): 1707−1709.
[20] Zhang HX, Jia M, Zhou QF, et al. Construction of recombinant expression vector and secretion expression of Exendin-4 in E. coli. J Henan Normal Univ: Nat Sci, 2009, 37(2): 109−116.张红绪, 贾孟, 周庆峰, 等. exendin-4表达载体构建及其在大肠杆菌中分泌表达. 河南师范大学学报: 自然科学版, 2009, 37(2): 109−116.
[21] Wang H, Qian JC, Zhuang YP, et al. Influence of copy number and spacer peptides on secretive expression of exendin-4 analog in Pichia pastoris. J East China Univ Sci Techol: Nat Sci, 2008, 34(1): 40−46.王晖, 钱江潮, 庄英萍, 等. 不同拷贝数及间隔肽序列对毕赤酵母分泌表达 EXA的影响. 华东理工大学学报: 自然科学版, 2008, 34(1): 40−46.
[22] Malendowicz LK, Macchi C, Nussdorfer GG, et al. Effects of prolonged exendin-4 administration on entero-insular axis of normal and streptozotocininduced diabetic rats. Int J Mol Med, 2003, 11(6): 763−766.