过量表达烟酸单核苷酸腺苷酰转移酶对大肠杆菌NZN111产丁二酸的影响
苟冬梅,梁丽亚,刘嵘明,张常青,吴明科,马江锋,陈可泉,朱建国,2,姜岷
1南京工业大学生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 211816
2常茂生物化学工程股份有限公司博士后科研工作站,江苏 常州 213034
工业生物技术
过量表达烟酸单核苷酸腺苷酰转移酶对大肠杆菌NZN111产丁二酸的影响
苟冬梅1,梁丽亚1,刘嵘明1,张常青1,吴明科1,马江锋1,陈可泉1,朱建国1,2,姜岷1
1南京工业大学生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 211816
2常茂生物化学工程股份有限公司博士后科研工作站,江苏 常州 213034
大肠杆菌 NZN111是敲除了乳酸脱氢酶的编码基因 (ldhA) 和丙酮酸-甲酸裂解酶的编码基因 (pflB)的发酵生产丁二酸的潜力菌株。厌氧条件下NADH不能及时再生为NAD+,引起胞内辅酶NAD(H) 的不平衡,最终导致厌氧条件下菌株不能利用葡萄糖生长代谢。nadD为催化NAD(H) 合成途径中烟酸单核苷酸 (NaMN)生成烟酸腺嘌呤二核苷酸 (NaAD) 的烟酸单核苷酸腺苷酰转移酶 (Nicotinic acid mononucleotide adenylyltransferase,NAMNAT) 的编码基因,通过过量表达nadD基因能够提高 NAD(H) 总量与维持合适的NADH/NAD+比例。文中构建了重组菌E. coliNZN111/pTrc99a-nadD,在厌氧摇瓶发酵过程中通过添加终浓度为1.0 mmol/L的IPTG诱导表达,重组菌E. coliNZN111/pTrc99a-nadD中NAD+和NADH的浓度分别比宿主菌E. coliNZN111提高了3.21倍和1.67倍,NAD(H)总量提高了2.63倍,NADH/NAD+从0.64降低为0.41,使重组菌株恢复了厌氧条件下生长和代谢葡萄糖的能力。重组菌与对照菌相比,72 h内可以消耗14.0 g/L的葡萄糖产6.23 g/L的丁二酸,丁二酸产量增加了19倍。
丁二酸,烟酸单核苷酸腺苷酰转移酶,厌氧发酵,大肠杆菌NZN111,NADH/NAD+
Abstract:Escherichia coliNZN111 is a promising strain withldhAandpflBgenes inactivated for the production of succinic acid. However, with these mutations, NAD+could not be regenerated from NADH, and an unbalanced NADH/NAD+ratio eliminated cell growth and glucose utilization under anaerobic conditions. Nicotinic acid mononucleotide adenylyltransferase (NAMNAT), encoded by thenadDgene, catalyzes the reaction from nicotinic acid mononucleotide (NaMN) to nicotinic acid adenine dinucleotide (NaAD) during the synthetic pathway of NAD(H).Overexpression of thenadDgene could enhance the concentration of NAD(H) and maintain a suitable NADH/NAD+ratio.In this study, we constructed a recombinant strainE. coliNZN111/pTrc99a-nadD, and overexpressed NAMNAT with 1.0 mmol/L of IPTG under anaerobic conditions in sealed bottles. Compared toE. coliNZN111, the concentrations of NAD+and NADH in the recombinant strain increased by 3.21-fold and 1.67-fold, respectively. The total concentration of NAD(H)was increased by 2.63-fold, and the ratio of NADH/NAD+decreased from 0.64 to 0.42. The recombinant strain restored the cell growth and glucose utilization under anaerobic conditions. After 72 h, the recombinant strain could consume 14.0 g/L of glucose to produce 6.23 g/L of succinic acid, and the concentration of succinic acid was 19-fold higher than inE. coliNZN111.
Keywords:succinic acid, nicotinic acid mononucleotide adenylyltransferase, anaerobic fermentation,Escherichia coliNZN111, NADH/NAD+
丁二酸 (又称琥珀酸) 作为一种 C4平台化合物,广泛应用于医药、农药、染料、香料、油漆、食品、塑料、合成有机化学品以及聚丁二酸丁二醇酯 (PBS) 类生物可降解材料等行业,被美国能源部认为是未来 12种最有价值的生物炼制产品之一[1-4]。利用微生物发酵法转化可再生资源生产丁二酸,价格低廉、污染小、且在发酵过程中可吸收固定CO2,开辟了温室气体利用的新途径,工艺过程具有绿色、能耗低、原子经济性高的优点,成为近年来的研究热点[5-9]。
大肠杆菌NZN111由于缺乏了乳酸脱氢酶的编码基因 (ldhA) 和丙酮酸-甲酸裂解酶的编码基因 (pflB) 而使副产物乳酸和甲酸的生产途径阻断,具有潜在生产丁二酸的能力。但同时由于NADH依赖的乳酸脱氢酶 (LDH) 无法合成而限制了糖酵解过程中形成的 NADH再生为 NAD+的过程,造成辅酶不平衡,导致该菌株厌氧条件下不能利用葡萄糖进行生长[10-13]。Hong和 Lee[14]选择还原性糖山梨醇作为碳源,当以CO2为气相时,20 g/L山梨醇发酵产生10 g/L丁二酸,转化率达到50%。Boernke等[15]在E. coliNZN111中克隆表达苹果酸脱氢酶基因 (mdh) 后,能使其在厌氧条件下生长。同时,Stols等[16-17]将猪蛔虫Ascaris suum中的苹果酸酶基因转入到E. coliNZN111后,丁二酸的产率和生产强度分别为0.39 g/g 和 0.29 g/(L·h)。Goldberg 等[18]和 Wang等[19]都曾研究过在E. coli中过量表达富马酸还原酶基因 (frd) 直接转化富马酸生成丁二酸,获得较好的结果,富马酸转化率可达93%。以上3种酶都是丁二酸生成途径中的关键酶,并且在反应时都能使 NADH被氧化为 NAD+,缓解NZN111中辅酶系统的不平衡,使其能在厌氧的条件下生长并能产生一定量的丁二酸。由此可知,在构建高产丁二酸大肠杆菌菌株过程中,确保还原力的供给和胞内辅酶 NAD(H) 的平衡是重组大肠杆菌高产丁二酸的关键因素。图1显示了大肠杆菌的厌氧混合酸发酵途径[20]。
大肠杆菌中 NAD(H) 的生物合成途经如图2所示。San等[21-22]通过在大肠杆菌中过量表达鼠伤寒沙门氏菌Salmonella typhimurium中的烟酸转磷酸核糖激酶基因 (pncB),使NAD的总量增加,NADH/NAD+的比例降低,从而使其代谢流发生改变。Heuser等[23]通过在大肠杆菌中过量表达烟酸转磷酸核糖激酶基因 (pncB) 和烟酰胺腺嘌呤二核苷酸合成酶基因 (nadE) 后,均使细胞中NAD(H)的总量增加了两倍多,通过将这两个基因共表达后,使胞内的 NAD(H) 的总量增加了7倍多。
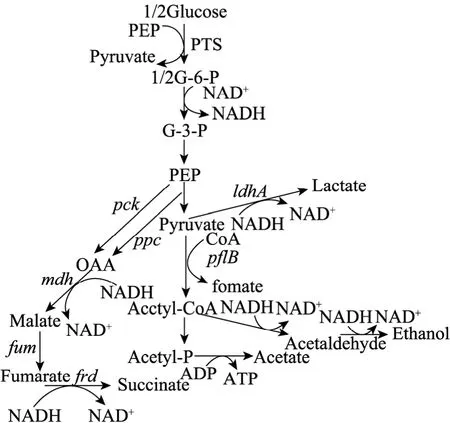
图1 大肠杆菌厌氧混合酸发酵途径[20]Fig.1 Pathways of anaerobic mixed acid fermentation forEscherichia coli[20].

图2 NAD(H) 在大肠杆菌中的生物合成途经[23]Fig.2 NAD(H) metabolism inEscherichia coli[23]. NaMN: nicotinic acid mononucleotide; NaAD: nicotinic acid adenine dinucleotide; NAD: nicotinamide adenine dinucleotide; PRPP: Phosphoribosyl pyrophosphate; NMN:nicotinamide mononucleotide.
本研究通过过量表达 NAD(H) 生物合成途经中的烟酸单核苷酸腺苷转移酶,构建了重组菌E. coliNZN111/pTrc99a-nadD,增加NAD(H) 的总量,降低NADH/NAD+比例,从而维持该菌株胞内的辅酶平衡,恢复了其在厌氧条件下的生长及耗糖能力,减少了副产物丙酮酸的积累并促进了丁二酸的合成。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌 DH5α由本实验室保藏;质粒pTrc99a由南京师范大学邵蔚蓝教授惠赠;E. coliNZN111 (ldhA::KanpflB::Cam) 由南伊利诺伊卡本代尔大学Clark教授惠赠,作为宿主菌和对照菌。
1.1.2 主要试剂
氨苄青霉素、氯霉素、硫酸卡那霉素,购自上海生工生物工程有限公司;基因组提取试剂盒和琼脂糖凝胶DNA回收试剂盒购自北京天根生化科技有限公司;质粒小量快速提取试剂盒为上海申能博彩生物科技有限公司产品;DNA片段回收试剂盒、限制性内切酶、Pyrobest DNA聚合酶和 T4 DNA连接酶为大连宝生物有限公司产品;酵母提取物和胰蛋白胨为Oxoid公司产品;CO2气体购自南京上元工业气体厂。

表1 研究中所用到的引物Table 1 Primers used in this study
1.2 方法
1.2.1nadD基因的克隆
引物设计:参照nadD基因序列 (来源于E. coliK12基因组,GenBank Accession No. 0009435) 设计,由上海申能博彩生物科技有限公司合成。分别在上下游引物的 5¢端引入了NcoI和HindⅢ酶切位点 (下划线标示),引物序列如表1所示。
PCR 反应体系:ddH2O 37.5 μL,10×pyrobest bufferⅡ5 μL,dNTPs (10 mmol/L) 4 μL,模板DNA (100 μg/ L) 0.5 μL,上下游引物(50 μmol/L)各 1 μL,Pyrobest DNA Polymerase (2.5 U/μL)1 μL。总体积 50 μL。
PCR 反应条件:94 ℃预变性 5 min;94 ℃45 s,55 ℃45 s,72 ℃72 s,35 个循环;72 ℃10 min。
1.2.2 重组质粒的构建
将纯化后的nadD基因片段以及质粒pTrc99a进行NcoⅠ和Hind Ⅲ双酶切,把双酶切后得到的片段在T4 DNA连接酶的作用下16 ℃连接过夜,构建得到重组质粒 pTrc99a-nadD并转化于E. coliNZN111感受态。涂布于含氯霉素、硫酸卡那霉素和氨苄青霉素的 LB平板上 37 ℃培养 12 h后挑选抗性克隆,提取质粒后进行Hind Ⅲ单酶切及NcoⅠ和Hind Ⅲ的双酶切鉴定。菌体转化采用CaCl2法[24]。
1.2.3 重组烟酸单核苷酸先苷转移酶的诱导表达
有氧诱导:37 ℃、200 r/min培养菌体到OD600约0.6左右,IPTG至终浓度为1.0 mmol/L,30 ℃、170 r/min诱导8 h。
样品处理:采取超3 s停5 s的策略共超声破碎3 min,于4 ℃、12 000 r/min 离心15 min,取上清即粗酶液,进行SDS-PAGE分析。
1.2.4 辅酶NADH与NAD+浓度的测定[25]
反应时依次添加150 μL上述的细胞提取液、0.9 mL的纯水、1.8 mL的混合反应液 (等体积的1.0 mol/L甘氨酸二肽/烟酸缓冲液、纯乙醇、40 mmol/L EDTA、4.2 mmol/L噻吩兰和双倍体积的16.6 mmol/L PES混合,30 ℃水浴10 min) 和150 μL的乙醇脱氢酶 (500 U/mL),迅速混匀后,测定波长570 nm处的吸光度值A570,做出测定得到的吸光度值A570随时间变化曲线,并将所得到曲线的斜率带到标准曲线中去,得到待测样品中NADH与NAD+的浓度。
1.2.5 培养基及培养条件
有氧摇瓶培养基:LB培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠5 g/L,pH 7.0,氯霉素、硫酸卡那霉素和氨苄青霉素的终浓度分别为25 μg/mL、30 μg/mL 和 100 μg/mL。
纯厌氧血清瓶发酵及两阶段发酵用培养基:30 mL LB液体培养基,添加0.48 g碱式碳酸镁,20 g/L葡萄糖,抗生素添加同有氧培养,添加终浓度为1.0 mmol/L的诱导剂IPTG (异丙基-β-D-硫代半乳糖苷) 以诱导表达NAMNAT。
1.2.6 培养方法
某项目建设规模全长70.4km,占地约6800亩(约4.53km2),设互通立交7个,特大型桥梁1座,桥长1578m,特长隧道1座,长4.88km。全线各类桥梁共计46座,总长约11.2km;全线隧道共计11座,全长约12.6km,项目全线桥隧比达33.8%,特别是项目南段(傅家至东胜)桥隧比高达67%,施工难度较大。项目总投资8.21×109元,为BOT+EPC总承包项目。工期始终处于受控状态,本项目工程已近尾声,本文通过对本项目的进度管理分析浅谈工期的影响因素和采取的应对措施,以供高速公路管理人员参考。
有氧摇瓶培养:将保存于-80 ℃的菌种在加有相应抗生素的平板上活化,挑单菌落到 5 mL LB试管,37 ℃、200 r/min培养10 h,1%接种量接种到好氧培养基中,37 ℃、200 r/min培养5 h。
纯厌氧血清瓶发酵:转接10%的菌液到血清瓶中,通入过滤除菌后的CO2气体2 min,保证血清瓶中为厌氧环境,加入终浓度 1.0 mmol/L的IPTG,30 ℃、170 r/min发酵72 h。
两阶段发酵:将100 mL有氧摇瓶培养至对数期末期的菌液,8 000 r/min离心10 min,倒掉上清,加入3~4 mL培养液,进行混匀,然后加入含有30 mL LB加碳酸镁的血清瓶中,通入过滤除菌后的CO2气体2 min,保证血清瓶中为厌氧环境,加入终浓度1.0 mmol/L的IPTG,30 ℃、170 r/min发酵24 h。
1.2.7 最佳生长条件的确定
1) IPTG诱导最佳浓度的确定:厌氧血清瓶发酵时,在初始OD600值为 0.7的培养液中加入 IPTG终浓度分别为 0.1、0.3、0.5、0.7、1.0、1.2、1.5 mmol/L,30 ℃、170 r/min厌氧发酵,发酵周期72 h,留样测定OD600,残糖和丁二酸含量。不同IPTG浓度的摇瓶分别有3个平行样。
2) 烟酸最佳浓度的确定:厌氧血清瓶发酵时,在初始OD600值为0.7的培养液中加入终浓度分别为0、0.1、0.3 mmol/L的烟酸和1.0 mmol/L的IPTG,厌氧发酵30 ℃、170 r/min,发酵周期72 h,留样测定OD600,残糖和丁二酸含量。不同烟酸浓度的摇瓶分别有3个平行样。
1.2.8 发酵及代谢物分析
2 结果与分析
2.1 烟酸单核苷酸腺苷酰转移酶基因的克隆与表达
用限制性内切酶NcoⅠ和Hind Ⅲ双酶切PCR扩增后的目的基因片段nadD和载体pTrc99a,酶切产物纯化后用T4 DNA连接酶进行连接,构建表达载体pTrc99a-nadD,构建流程如图3所示。
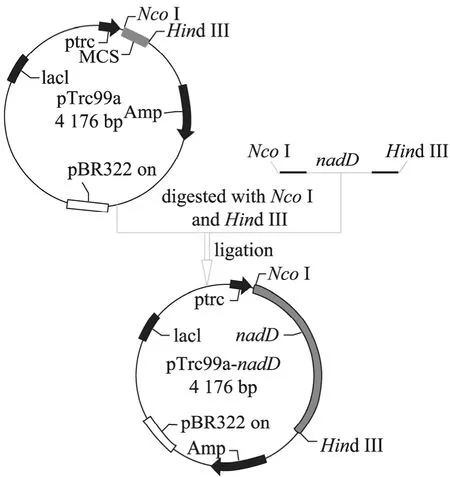
图3 pTrc99a-nadD表达载体的构建图谱Fig.3 Map of construction of pTrc99a-nadDexpression vector.
重组质粒 pTrc99a-nadD经限制性内切酶Hind Ⅲ酶切的条带大小为4 925 bp,经限制性内切酶NcoI和Hind Ⅲ酶切的条带大小分别为805 bp和4 120 bp。重组质粒经单、双酶切鉴定(图 4),结果与预期一致,并经测序后目的基因序列与公布的序列100%匹配。

图 4 重组质粒 pTrc99a-nadD的单酶切和双酶切鉴定Fig.4 Identification of pTrc99a-nadDbyrestriction endonuclease digestion. M: λ-EcoT 14 I digest marker;1: pTrc99a-nadDdigested withHind Ⅲ; 2: pTrc99anadDdigested withNcoI andHind Ⅲ.
2.2 NAMNAT酶活的诱导表达
37 ℃、200 r/min培养菌体到OD600为0.7左右,加入IPTG至终浓度分别为1.0 mmol/L,30 ℃、170 r/min诱导8 h后,对E. coliNZN111/pTrc99a和构建的重组菌株进行粗酶液的 SDS-PAGE电泳以及NADH和NAD+测定,结果如图5和表2所示。
由图5全菌体蛋白电泳可见25 kDa左右的目的条带,这与预期的大肠杆菌24 kDa的nadD基因表达蛋白的相对分子量一致。表明在 IPTG的诱导下,NAMNAT得到了表达。
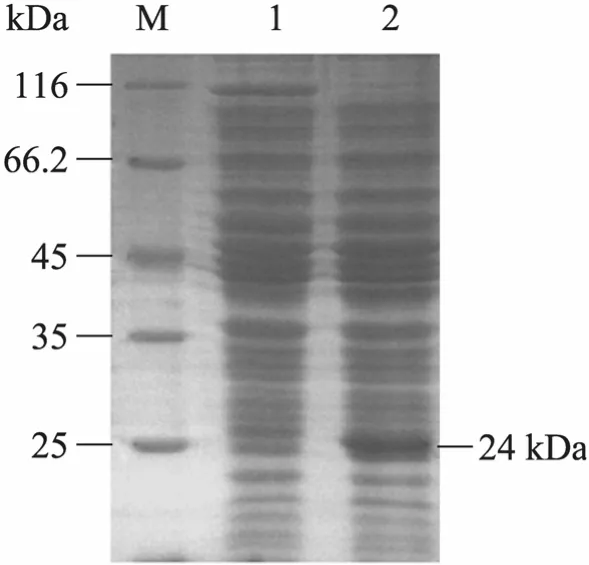
图 5 过量表达nadD基因后细胞提取物的SDS-PAGE图Fig.5 SDS-PAGE analysis of pTrc99a-nadDexpression. M: protein molecular weight marker; 1:E.coliNZN111/pTrc99a; 2:E. coliNZN111/pTrc99anadD.
由表2可知:重组菌中的烟酸单核苷酸腺苷酰转移酶基因得到了过量表达,NADH的浓度提高了 0.49倍,NAD+的浓度提高了 2.33倍,NAD(H) 的总量提高了 2.02倍,可见烟酸单核苷酸腺苷酰转移酶的过量表达可以使 NAD(H)总量得到很大的提高。
2.3 最佳生长条件的优化
2.3.1 IPTG浓度的优化
图6表明,当IPTG添加终浓度为1.0 mmol/L时,生物量、耗糖和丁二酸的值最高。实验结果显示,在一定范围内,IPTG浓度越高,生物量和丁二酸的值越高,当超过1.0 mmol/L以后,生物量和丁二酸的值不仅没有提高,反而减少,出现这种现象的原因可能是IPTG本身具有细胞毒性,浓度过高,不利于菌体的生长代谢;另外,过高浓度的IPTG也可能会诱导外源基因的高表达,过高的酶活会加重菌体生长和基础代谢负担,不利于目标代谢物的生产。

表2 对照菌与重组菌的NADH、NAD+以及NAD(H) 的浓度Table 2 The concentration of NADH, NAD+and NAD(H) in the control strain and in the recombinant strain
2.3.2 烟酸浓度的优化
烟酸作为NAD(H) 补给合成途径中的底物,在优化IPTG浓度之后,分别考察添加不同烟酸浓度对重组菌生长、耗糖及产酸的影响。实验结果表明 (图7),添加不同的烟酸浓度后,对菌体的生长、耗糖和产酸都有一定的影响,当烟酸添加终浓度为0 mmol/L时,丁二酸的产量为最高,当烟酸的添加终浓度超过0 mmol/L时,丁二酸的浓度都有所降低。
2.4 厌氧血清瓶发酵
有氧培养结束后,按10%的接种量转接到厌氧血清瓶,使初始OD600值约为0.7左右,添加终浓度为1.0 mmol/L的IPTG,发酵72 h后测定细胞干重、辅酶NAD+和NADH的量,并测定残糖及丁二酸的含量。结果见表3。

图6 加入不同浓度IPTG进行诱导对重组菌株生长、耗糖及产丁二酸的影响Fig.6 Effect of different concentrations of IPTG on the cell mass, glucose consumed and succinic acid concentration at the end of the fermentation in NZN111/pTrc99a-nadD.Note:A-G: NZN111/pTrc99anadDinducedwith different IPTG. A: 0.1 mmol/L; B:0.3 mmol/L; C: 0.5 mmol/L; D: 0.7 mmol/L; E:1.0 mmol/L; F: 1.2 mmol/L; G: 1.5 mmol/L.
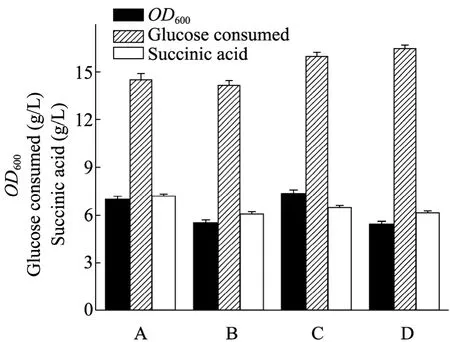
图 7 加入不同浓度烟酸进行诱导对重组菌株生长、耗糖及产丁二酸的影响Fig.7 Effect of different concentrations of nicotinic acid on the cell mass, glucose consumed and succinic acid concentration at the end of the fermentation in NZN111/pTrc99a-nadD.Note:A-D: NZN111/pTrc99anadDwith different NA. A: 0 mmol/L; B: 0.1 mmol/L;C: 0.3 mmol/L; D: 0.5 mmol/L.
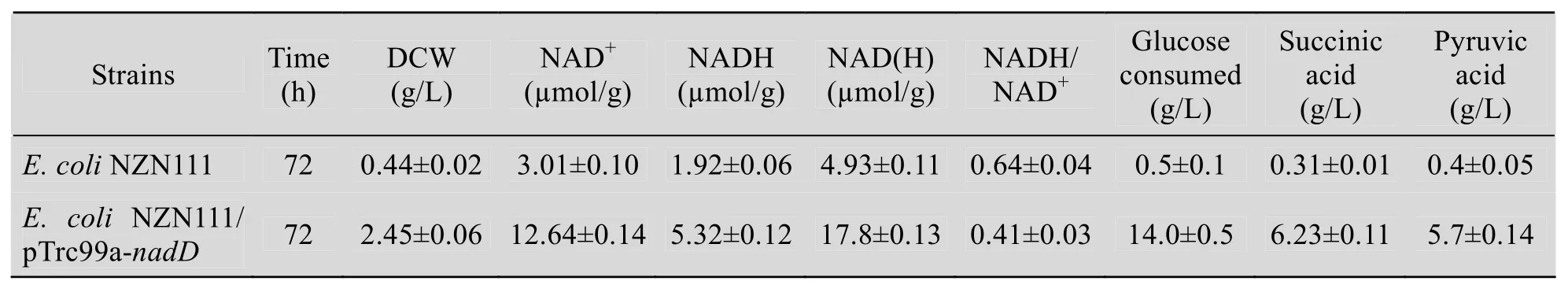
表3 厌氧血清瓶培养后各种参数的测定结果Table 3 Results of these parameters on anaerobic fermentation in sealed bottles
由表3可知,重组菌与对照菌相比,72 h内可以消耗14.0 g/L的葡萄糖产6.23 g/L的丁二酸,而对照菌几乎没有丁二酸生成,重组菌细胞干重是对照菌的5.5倍,NAD+增加了3.21倍,NADH增加了1.67倍,表明过量表达烟酸单核苷酸腺苷酰转移酶基因后,在一定程度上,恢复了大肠杆菌NZN111在厌氧条件下的生长和耗糖能力。NAD(H) 的总量增加了2.63倍,NADH/NAD+的比例由0.64降到0.41,该现象说明增加 NAD(H) 的总量和维持合适的NADH/NAD+的比例对于 NZN111产生还原性末端产物丁二酸是有利的。若能将二者结合起来,可改变代谢流的方向,减少其他副产物的产生,从而很大程度地提高丁二酸的产率和生产强度。
2.5 两阶段发酵
有氧培养 6 h后,将 100 mL的菌液8 000 r/min离心10 min,将菌泥接入血清瓶,添加终浓度为1.0 mmol/L的IPTG,发酵24 h后,测其OD600、残糖、丁二酸、丙酮酸、乙酸等不同产物的含量。结果见表4。
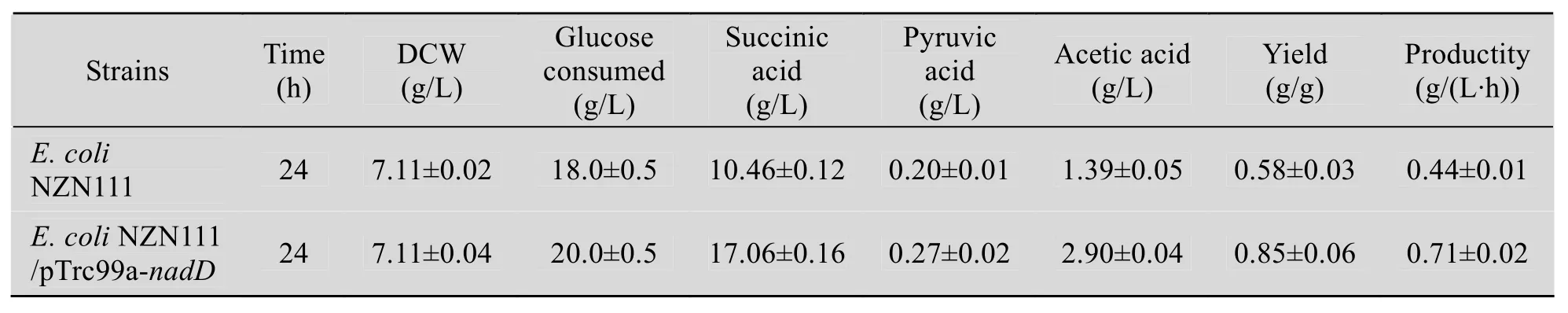
表4 两阶段血清瓶培养后各种参数的测定Table 4 Results of these parameters on dual-phase fermentation in sealed bottles
由表4可知,重组菌发酵24 h后,消耗20 g/L的葡萄糖,产生17.06 g/L的丁二酸,丁二酸产量是对照菌的1.63倍,其得率和生产强度分别为0.85 g/g和0.71 g/(L·h),而对照菌的得率和生产强度分别为0.58 g/g和0.44 g/(L·h),进一步说明过量表达烟酸单核苷酸腺苷酰转移酶,有利于厌氧条件下丁二酸的生成。
3 结论
文中构建重组大肠杆菌 NZN111/pTrc99anadD,过量表达了烟酸单核苷酸腺苷酰转移酶,与对照菌NZN111相比,有氧条件下NAD+的浓度提高了2.33倍,NADH的浓度提高了0.49倍,NAD(H) 的总量增加了 2.02倍,这表明过量表达烟酸单核苷酸腺苷酰转移酶,能提高胞内的NAD(H) 的总量,有利于丁二酸的生产。进一步在厌氧血清瓶中进行发酵,通过对其诱导条件进行优化,提供菌体生长代谢的良好条件和合适的表达基因的酶活,使其耗糖和丁二酸产量都有很大的提高。通过加入终浓度为 1.0 mmol/L的IPTG,使烟酸单核苷酸腺苷酰转移酶得到了过量表达,辅酶 NAD(H) 的总量增加了 2.63倍,NADH/NAD+的比例由 0.64降到 0.41,特别是NAD+的浓度增加了3.21倍,提供了充足的NAD+来进行葡萄糖的氧化,在厌氧条件下,使菌株能够利用葡萄糖代谢生长,重组菌细胞干重是对照菌的5.5倍,使丁二酸的产量大大提高。Liu等[26]报道了在大肠杆菌 NZN111过量表达 NAD(H)合成途径中的烟酸转磷酸核糖激酶,使NAD(H)恢复平衡,也恢复了NZN111厌氧条件下生长和产酸能力。文中通过在NZN111中过量表达烟酸单核苷酸腺苷酰转移酶,再次证实增加NAD(H)的总量和维持合适的 NADH/NAD+的比例是重组大肠杆菌生产还原性末端产物的关键因素,这为提高丁二酸的产量及确定基于 NAD(H) 调控丁二酸高收率、高生产强度的生物合成策略提供了依据。
REFERENCES
[1] Wang QZ, Wu W, Zhao XM. Market analysis for bioconversion of succinic acid and its derivatives.Chem Ind Eng Prog, 2004, 23(7): 794−798.
王庆昭, 吴巍, 赵学明. 生物转化法制取琥珀酸及其衍生物的前景分析. 化工进展, 2004, 23(7):794−798.
[2] Zhan XB, Zhu YH, Wang DH. Succinic acid production and potential market. Food Sci Technol,2003(2): 44−49.
詹晓北, 朱一晖, 王东海. 琥珀酸发酵生产工艺及其产品市场. 食品科技, 2003(2): 44−49.
[3] Wang DX, Ma TN. Preparation of succinic acid from highly oxidized paraffin. Chemical Engineer,2003, 96(3):15−16.
王大勋, 马铁宁. 从深度氧化石蜡中提取琥珀酸.化学工程师, 2003, 96(3):15−16.
[4] McKinlay JB, Vieille C, Zeikus GJ. Prospects for a bio-based succinate industry. Appl Microbiol Biotechnol, 2007, 76(4): 727-740.
[5] Zeikus JG, Jain M K, Elankovan P. Biotechnology of succinic acid production and markets for derived industrial products. Appl Microbiol Biot, 1999,51(5): 545−552.
[6] Lee PC, Lee SY, Hong SH, et al. Biological conversion of wood hydrolysate to succinic acid byAnaerobiospirillum succiniciproducens. Biotechnol Lett, 2003, 25(2): 111−114.
[7] McKinlay JB, Zeikus JG, Vieille C. Insights intoActinobacillussuccinogenesfermentative metabolism in a chemically defined growth medium. Appl Environ Microbiol, 2005, 71(11):6651−6656.
[8] Lee JW, Lee SY, Song H, et al. The proteome ofMannheimia succiniciproducens, a capnophilic rumen bacterium. Proteomics, 2006, 6(12):3550−3556.
[9] Jiang M, Liu SW, Ma JF, et al. Effect of growth phase feeding strategies on succinate production by metabolically engineeredE. coli. Appl Environ Microbiol, 2010, 76(4): 1298−1300.
[10] Wu H, Li ZM, Zhou L, et al. Improved succinic acid production in the anaerobic culture of anEscherichia coli pflBldhAdouble mutant as a result of enhanced anaplerotic activities in the preceding aerobic culture. Appl Environ Microbiol,2007, 73(24): 7837−7843.
[11] Wang W, Z Li. Production of succinate by apflB ldhAdouble mutant ofEscherichiacolioverexpressing malate dehydrogenase. Bioprocess Biosyst Eng, 2009, 32(6): 737−745.
[12] Vemuri GN, Eiteman MA, Altman E. Effects of growth mode and pyruvate carboxylase on succinic acid production by metabolically engineered strains ofEscherichia coli. Appl Environ Microbiol, 2002,68(4): 1715−1727.
[13] Singh A, Lynch MD, Gill RT. Genes restoring redox balance in fermentation-deficientE. coliNZN111. Metab Eng, 2009, 11(6): 347−354.
[14] Hong S, Lee S. Importance of redox balance on the production of succinic acid by metabolically engineeredEscherichia coli. Appl Microbiol Biotechnol, 2002, 58(3): 286−290.
[15] Boernke WE, Millard CS, Stevens PW, et al.Stringency of substrate-specificity ofEscherichia colimalate-dehydrogenase. Arch Biochem Biophy,1995, 322(1): 43–52.
[16] Stols L, Kulkarni G, Harris BG, et al. Expression ofAscaris suummalic enzyme in a mutantEscherichia coliallows production of succinic acid from glucose. Appl Biochem Biotechnol, 1997,63-65 (1): 153–158.
[17] Stols L, Donnelly MI. Production of succinic acid through overexpression of NAD(+)-dependent malic enzyme in anEscherichia colimutant. Appl Environ Microbiol, 1997, 63(7): 2695–2701.
[18] Goldberg I, Lonberg-Holm K, Bagley EA, et al.Improved conversion of fumarate to succinate byEscherichia colistrains amplified for fumarate reductase. Appl Environ Microbiol, 1983, 45(6):1838−1847.
[19] Wang XH, Gong CS, Tsao GT. Bioconversion of fumaric acid to succinic acid by recombinantE.coli. Appl Biochem Biotechnol, 1998, 70-72(1):919−928.
[20] Clark DP. The fermentation pathways ofEscherichia coli. FEMS Microbiol Lett, 1989,63(3): 223−234.
[21] Berrios- Rivera SJ, San KY, Bennett GN. The effect of NAPRTase overexpression on the total levels of NAD, the NADH/NAD+ratio, and the distribution of metabolites inEscherichia coli.Metab Eng, 2002, 4(3): 238−247.
[22] San KY, Bennett GN, Berríos-Rivera SJ, et al.Metabolic engineering through cofactor manipulation and its effects on metabolic fluxredistribution inEscherichia coli. Metab Eng,2002, 4(2): 182-192.
[23] Heuser F, Schroer K, Ltüz S, et al. Enhancement of the NAD(P)(H) pool inEscherichia colifor biotransformation. Eng Life Sci, 2007, 7(4):343−353.
[24] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001: 24−25.
[25] Li J, Chen KQ, Huang XM, et al. Establishment of the determination of NAD+and NADH in the anaerobic fermentation of organic acids. Food Sci Technol, 2008, 33(12): 254−257.
李建, 陈可泉, 黄秀梅, 等. 厌氧发酵有机酸体系中 NAD+和 NADH测定方法的建立. 食品科技, 2008, 33(12): 254−257.
[26] Liu RM, Ma JF, Liang LY, et al. Effect of overexpression of nicotinic acid phosphoribosyl transferase on succinic acid production inEscherichia coliNZN111. Chin J Biotech, 2011,27(10): 1438−1447.
刘嵘明, 马江锋, 梁丽亚, 等. 过量表达烟酸转磷酸核糖激酶对大肠杆菌NZN111产丁二酸的影响. 生物工程学报, 2011, 27(10): 1438−1447.
Effect of overexpression of nicotinic acid mononucleotide adenylyltransferase on succinic acid production inEscherichia coliNZN111
Dongmei Gou1, Liya Liang1, Rongming Liu1, Changqing Zhang1, Mingke Wu1,Jiangfeng Ma1, Kequan Chen1, Jianguo Zhu1,2, and Min Jiang1
1State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing211816,Jiangsu,China
2Post-Doctoral Research Working Station,Changmao Biochemical Engineering Company Limited,Changzhou213034,Jiangsu,China
苟冬梅,梁丽亚,刘嵘明,等. 过量表达烟酸单核苷酸腺苷酰转移酶对大肠杆菌 NZN111产丁二酸的影响. 生物工程学报,2012, 28(9): 1059−1069.
Gou DM,Liang LY,Liu RM,et al. Effect of overexpression of nicotinic acid mononucleotide adenylyltransferase on succinic acid production inEscherichia coliNZN111. Chin J Biotech, 2012, 28(9): 1059−1069.
Received:March 5, 2012;Accepted:May 11, 2012
Supported by:National Natural Science Foundation of China (No. 21076105), National Basic Research Program of China (973 Program) (No.2009CB724701), Priority Academic Program Development of Jiangsu Higher Education Institutions.
Corresponding author:Min Jiang. Tel: +86-25-83172078; Fax: +86-25-84172062; E-mail: bioengine@njut.edu.cn
国家自然科学基金 (No. 21076105),国家重点基础研究发展计划 (973计划) (No. 2009CB724701),江苏高校优势学科建设工程项目资助。

