丝状真菌Amorphotheca resinae ZN1的糠醛降解代谢分析
王晓凤,张 建,辛秀娟,鲍 杰
华东理工大学生物工程学院 生物反应器工程国家重点实验室,上海 200237
丝状真菌Amorphotheca resinae ZN1的糠醛降解代谢分析
王晓凤,张 建,辛秀娟,鲍 杰
华东理工大学生物工程学院 生物反应器工程国家重点实验室,上海 200237
木质纤维素在预处理过程产生的降解产物对后续的酶水解和微生物发酵过程产生了强烈的抑制。因此,这些抑制物的脱除即所谓的“脱毒”步骤是正常进行后续酶解和发酵的前提条件。我们对本实验室筛选的丝状真菌Amorphotheca resinae ZN1的糠醛的代谢路径进行了研究。丝状真菌A. resinae ZN1转化糠醛的降解代谢途径可以简述为:糠醛首先快速地转化为毒性较低的糠醇;在有氧条件下,糠醇又再度生成不致对微生物产生危害的低浓度糠醛,糠醛继续氧化为糠酸。推测糠酸可能继续进入TCA循环,进而完成糠醛的完全降解。研究结果为将来加快丝状真菌A. resinae ZN1生物脱毒速率、改善木质纤维素生物转化的限速步骤提供了重要的实验依据。关键词: 降解途径,生物脱毒,糠醛,木质纤维素
在木质纤维素的生物转化过程中,预处理是破坏木质纤维素致密结构、提高纤维素酶解效率的必需步骤[1]。高温、强酸或强碱的预处理在破坏木质纤维素结构的同时,不可避免地生成了多种对后续酶解和微生物发酵过程具有强烈抑制作用的降解产物,主要包括有机酸类化合物、呋喃类化合物和酚类化合物[2-6],因此,要实现对木质纤维素的有效生物转化,必须对预处理后的原料进行脱毒处理。
目前常用的脱毒方法有水洗法[7]、过碱化处理 (Overliming)[8]、活性炭或离子交换树脂吸附[9]、真空蒸发[2]以及生物降解等[10-13]。这些方法中具有实际应用价值的仅有水洗法和过碱化方法,但都存在着大量耗水和大量废水产生、物料损失严重、处理后物料高含水等严重问题[14]。与其他脱毒方法相比,生物脱毒法条件温和、抑制物转化彻底、耗能低且废水少,而且脱毒后的物料可以直接进入乙醇发酵,但脱毒效率低[15-16]是制约生物脱毒法广泛应用的核心问题。因此,得到一株能够高效降解各种抑制物的微生物是生物脱毒法的关键[17]。
糠醛由于含有呋喃环,不易受到代谢过程的破坏,生物降解较为缓慢。Gerhard等从含有亚硫酸盐的连续发酵罐中分离出了一株能够转化糠醛的菌株Desulfovibrio sp. F-1[18]。这株菌能够在无机盐和生长因子受限制的硫酸盐培养基中,以糠醛作为唯一的碳源和能源生长,得率为1.6~1.8 mmol乙酸/mmol糠醛。Mohammad等对有氧及厌氧情况下的驯化酿酒酵母CBS 8066降解糠醛进行了研究[19],在有氧或者厌氧的分批发酵中,糠醛主要代谢为糠醇 (产率约为70%),而且在指数期生长期代谢能力最强,稳定期较弱;糠醛使酵母的比生长速率和乙醇产率下降,而当糠醛完全代谢完后有所回升。Belay等对一株产甲烷球菌属的突变株Methanococcus deltae LH厌氧转化糠醛进行了研究[20],该菌株代谢糠醛的主要产物是糠醇,同时生成甲烷和二氧化碳气体,但它不能以糠醛为唯一碳源及能源生长。Nichols等从被糠醛污染过的土壤中分离到了一种可以代谢呋喃衍生物、有机酸以及酚类化合物的真菌Coniochaeta ligniaria NRRL30616,可以把毒性强的糠醛转化为弱毒性的相应醇的形式,即糠醇,然后再氧化为相应的酸,从而使得酵母的后续发酵生产乙醇得以进行[21]。
近两年,荷兰Delft University of Technology的一个研究组对糠醛的代谢路径进行了较为深入的研究。Wierckx等从土壤中分离获得的Cupriavidus basilensis HMF14能够代谢转化5-羟甲基糠醛和糠醛,但却不能利用葡萄糖、木糖、阿拉伯糖以及甘露糖[22];进一步的代谢路径研究表明,C. basilensis HMF14代谢糠醛的产物分别是糠醇和糠酸,并最终进入支持细胞生长的代谢路径;在这3种呋喃衍生物中,糠醛对微生物的毒性最大,因此在微生物转化糠醛时,首先将它快速地转化为糠醇,从而使糠醛含量保持在一个低水平浓度范围内,然后再分批少量地通过将其氧化为糠醛作为过渡阶段,最终将其氧化为糠酸,通过细胞摄入,将糠酸大量地运输到细胞中,支持菌体生长,因此在这个过程中,糠醛、糠醇和糠酸是相互转化的,且这个过程中只能看到少量的糠酸积累。Koopman等建立了C. basilensis HMF14的突变体转座子文库,鉴定出了呋喃衍生物代谢途径涉及的基因,并在假单胞菌Pseudomonas putida体内重构了糠醛和5-羟甲基糠醛的代谢途径[23]。
Zhang等从稀酸预处理后的玉米秸秆中筛选到了一株脱毒真菌Amorphotheca resinae ZN1,并对其作了分子生物学和微生物学鉴定,而且在玉米秸秆发酵乙醇过程中得到了有效利用[15]。本实验主要是以糠醛作为唯一碳源对这一煤油真菌A. resinae ZN1的抑制物代谢路径进行了研究。所提出的煤油真菌A. resinae ZN1转化糠醛的降解代谢途径跟前人提出的细菌中的代谢途径基本一致,糠醛首先快速地转化为毒性较低的糠醇,糠醇又再度生成不致对微生物产生危害的低浓度糠醛,糠醛继续氧化为糠酸。推测糠酸的进一步降解路径可能与其他微生物类似[23],通过进入TCA循环完成糠醛的完全降解。研究结果对将来加快煤油真菌A. resinae ZN1生物脱毒速率、改善木质纤维素生物转化的限速步骤提供了重要的实验依据。
1 材料与方法
1.1 试剂和药品
糠醛购自上海德默化学技术有限公司 (上海,中国),糠醇和糠酸购自国药集团化学试剂有限公司 (上海,中国)。磷酸二氢钾、硫酸镁、硫酸铵、氯化钙购自上海凌峰化学试剂有限公司(上海,中国),酵母提取物购自Oxoid Ltd (Basingstoke Hampshire,England)。所有试剂和药品均为分析纯。
1.2 脱毒菌株及培养
脱毒菌种为本实验室筛选和保存的Amorphotheca resinae ZN1,该菌的分子生物学和微生物学鉴定见文献[8]。A. resinae ZN1菌株在PDA试管斜面保存和传代。PDA培养基的制备简述:取去皮马铃薯200 g,切成小块,加水1 000 mL。煮沸l h,用8层纱布过滤,然后补足水至1 L,并添加葡萄糖20 g,琼脂粉20 g,121 ℃灭菌20 min,贮存备用。该培养基为菌株的传代保存培养基。
1.3 A. resinae ZN1的培养和发酵
种子培养基:KH2PO42 g/L,(NH4)2SO41 g/L,MgSO4·7H2O 1 g/L,CaCl20.5 g/L,酵母提取物1 g/L,葡萄糖40 g/L。
发酵培养基:KH2PO42 g/L,(NH4)2SO41 g/L,MgSO4·7H2O 1 g/L,CaCl20.5 g/L,酵母提取物1 g/L,葡萄糖20 g/L。灭菌后分别添加过滤除菌的糠醛 (约0.6 g/L)。
无机盐培养基:KH2PO42 g/L,(NH4)2SO41 g/L,MgSO4·7H2O 1 g/L,CaCl20.5 g/L。灭菌后加入过滤除菌的糠醛 (约0.6 g/L)。
发酵菌种的培养:用无菌水从培养好的PDA斜面试管洗下孢子悬液,然后按照10% (V/V)的接种量接入含有种子培养基的三角瓶中,置于28 ℃的恒温培养箱里静止培养3 d。
发酵操作是在3 L发酵罐 (保兴生物科技有限公司,上海,中国) 中进行的,装液量为1 L,20% (V/V) 接种量,温度26 ℃,转速100 r/min,并通过调节通气量来控制不同的溶氧水平。在发酵过程中,用2 mol/L的HCl和NaOH维持发酵体系的pH在5.5,并不时取样,取样后立即用0.22 µm的滤膜过滤样品,然后保存在4 ℃的冰箱,以备后续的分析。
1.4 分析方法
呋喃衍生物 (包括糠醛、糠醇、糠酸) 通过RP-HPLC (Reversed-phase HPLC,LC-20AT,UV/VIS detector SPD-20A;Shimadzu,Kyoto,Japan) 和GC-MS (QP5000,Shimadzu,Agilent 19091S-433) 进行定性分析,并用RP-HPLC进行定量分析。
RP-HPLC的配置和工作条件为:YMC-Pack ODS-A柱 (LC-20AT,UV/VIS detector SPD-20A;Shimadzu,Toyoto,Japan),流动相流速1 mL/min;进样量20 µL;柱温35 ℃,流动相为乙腈∶超纯水=50:50;检测波长为:糠醛、糠醇和糠酸为220 nm。
葡萄糖和乙酸是通过HPLC (LC-20AD,refractive index detector RID-10A;Shimadzu,Toyoto,Japan)测定的。HPLC的配置和工作条件为:Bio-Rad HPX-87H柱,流动相为5 mmol/L硫酸,柱温为65 ℃流速为0.6 mL/min。所有从发酵罐中取的样品,进样前均在14 000 r/min的条件下离心7 min,并通过0.22 μm的滤膜过滤。以上所有糠醛代谢过程均有两个重复实验。
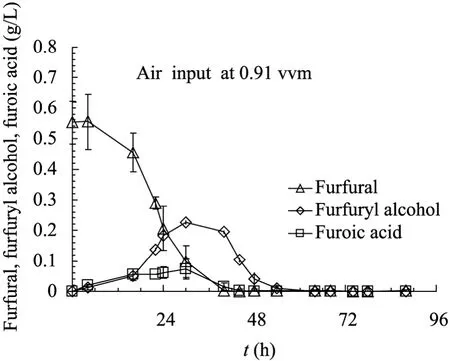
图1 A. resinae ZN1以糠醛为唯一碳源的代谢转化Fig. 1 Metabolism of furfural as the sole carbon source by A. resinae ZN1. Conditions: 20% incaution, 26 °C, pH 5.5, 100 r/min, ventilation of 0.91 vvm.
2 结果与分析
2.1 A. resinae ZN1的糠醛代谢分析
为了更清楚地了解A. resinae ZN1生物脱除糠醛的代谢路径,也为了验证糠醛能否作为丝状真菌A. resinae ZN1的唯一碳源,本研究采用了含糠醛的无糖无机盐离子培养基。种子扩培后用500 mL的无菌水洗菌膜2次,将洗去残糖的菌膜接种到含糠醛的无糖无机盐离子培养基中进行发酵,结果见图1。该实验是采用的无糖无机盐离子培养基对A. resinae ZN1进行培养,从培养情况来看,A. resinae ZN1依然可以很好地进行生长繁殖,从接种发酵开始到糠醛转化期间,发酵罐内从刚开始接种的少量菌片到发酵罐内壁周围贴满黑色的成片状菌丝、发酵罐搅拌桨上缠满菌丝片,发酵液从初始的澄清透亮状态到发酵液变成黑色、浑浊状态,菌体生物量大量增加。但是,由于菌体生长的不规则性,准确地定量测定生物量较为困难。从图1可以看出,糠醛可以作为A. resinae ZN1的唯一碳源及能源进行生长和发酵,首先,糠醛快速地向糠醇转化,随后进一步转化为糠酸。由于糠酸可以顺利进入后续的代谢步骤,糠酸积累不显著,并最终被完全代谢,所以在代谢进行到42 h后,已经看不到糠酸的积累;而糠醛还原为糠醇的速度要远远快于糠醇进一步氧化的速度,所以在糠醛快速转化的阶段(16 h至42 h之间),糠醇的积累量要大于糠酸的积累量。对于微生物而言,糠醛对其生长的抑制作用最大,而糠醇的毒性最弱,A. resinae ZN1将高浓度的糠醛先快速地还原为糠醇,在一定程度上就大大减弱了糠醛对其生长的强抑制作用,然后再将弱毒性的糠醇进一步氧化为糠酸,并将之彻底代谢掉。在有氧状态下,A. resinae ZN1不需要特殊的营养因子可以很好地降解糠醛。A. resinae ZN1可以以少数几种无机盐作为营养代谢糠醛,表现出了与以往研究中脱毒菌种所不具有的独特性质[18,24]。
溶氧水平对真菌的液体培养非常重要。本研究对不同溶氧水平的A. resinae ZN1代谢糠醛的情况进行了考察,结果见图2。图2中糠醛的转化曲线error bar跨度比较大,分析原因可能是由于菌种接种时的生长状态存在一定差异。本文中的保藏菌种是在PDA试管斜面培养基上培养的,斜面上菌种的生长状态很难测定其生长曲线,每批种子接种时的生长状态可能不同,因此A. resinae ZN1对糠醛的转化速率可能会存在一定差异。
分析图2A可知,不通空气时,糠醛转化和糠醇生成速率较慢,而且生成糠醇后几乎不向糠酸转化,也检测不到糠酸的积累。由于糠醇对微生物的毒性很小,生物脱毒进行到这一步,即可以进行下一步的酶解和乙醇发酵过程。由此可见,A. resinae ZN1可以在厌氧状态下进行生物脱毒。图2A还表明,在糠醛代谢完全之前葡萄糖几乎不消耗,而在糠醛被完全代谢后,葡萄糖的消耗速度大大加快,表明当有抑制物存在时,A. resinae ZN1优先转化其生长抑制物。
分析图2B可知,在较低的溶氧状态下(0.45 vvm),糠醛转化和糠醇生成速率显著增加,并出现有糠酸积累的阶段。与厌氧状态下糠醛代谢一致的是,糠醛首先快速转为毒性较低的糠醇,然后再氧化成为糠酸,而氧的存在是糠醇进一步快速氧化为糠酸的必要条件。在糠醛被完全转化前,葡糖糖的消耗速度不大;当糠醛被完全转化为糠醇后,葡萄糖的消耗速度大大增加。
分析图2C可知,在较高的溶氧水平下(1.88 vvm),糠醛的转化非常迅速,而由于高溶氧的存在,糠醇向糠酸的转化也更为快速;而且糠醇和糠酸积累的阶段持续时间很短。高溶氧条件下的葡萄糖利用情况与低溶氧状态时相近。
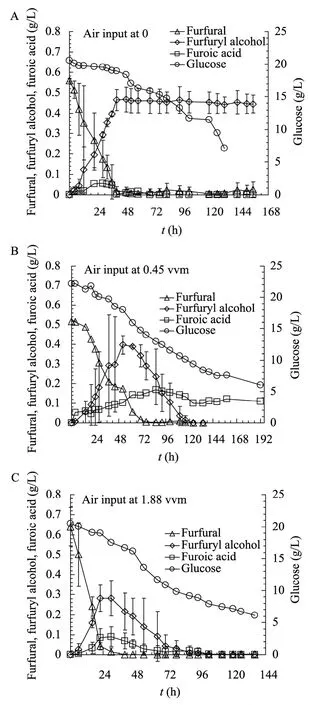
图2 不同溶氧水平下A. resinae ZN1对糠醛的代谢状况Fig. 2 Influence of metabolic mechanism of furfural degradation by the kerosene fungus strain, A. resinae ZN1 at different oxygen dissolved levels. Conditions: 20% incaution, 26 °C, pH 5.5, 100 r/min.
上述实验结果表明,溶氧在糠醇向糠酸转化过程中起着至关重要的作用,较高的溶氧不仅可以促进糠醇向糠酸的转化,而且有利于糠酸在胞内被彻底代谢为终产物。溶氧虽然不是A. resinae ZN1进行糠醛降解的限制因素,但却是糠醇进一步向糠酸氧化的重要条件;溶氧可以显著影响糠醛降解的速率,尤其是糠醇向糠酸氧化以及糠酸后续代谢的速率。提高溶氧水平可以大大加快A. resinae ZN1进行糠醛脱除的速率。
为了进一步确定溶氧在糠醛转化过程中的作用,本研究设计了一个两阶段通气法来研究溶氧对糠醛转化的影响,所用培养基为发酵培养基,成分如下:KH2PO42 g/L,(NH4)2SO41 g/L,MgSO4·7H2O 1 g/L,CaCl20.5 g/L,酵母提取物1 g/L,葡萄糖20 g/L。灭菌后分别添加过滤除菌的糠醛 (约0.6 g/L)。灭菌后添加过滤除菌的糠醛 (约0.6 g/L)。两阶段通气法是指在发酵开始前,先通入足量的氮气,以置换发酵液中的溶解氧,在发酵开始后、糠醛完全转化的这段时间内,不通空气,即在糠醛完全转化的这段时间内是完全厌氧培养,之后则以0.91 vvm的通气量通入空气进行有氧培养 (图3)。分析图3可知,厌氧培养时糠醛缓慢地向糠醇转化,在糠醛完全转化为糠醇并开始有氧培养时,糠醇开始向糠酸氧化。与图2不同的是,两阶段通气法中糠醛是在完全厌氧的环境中还原的,此时糠醇的生成速率很慢,糠酸的积累一直很少。原因可能是由于A. resinae ZN1在长时间的厌氧生长状态下,细胞活力大大下降,即使重新开始通气进行有氧培养,糠醇的氧化速度依然很慢,糠酸的利用速度也很慢。结合图2中的实验结果,有氧培养是提高细胞活力进而提高生物脱毒速率的有效途径。
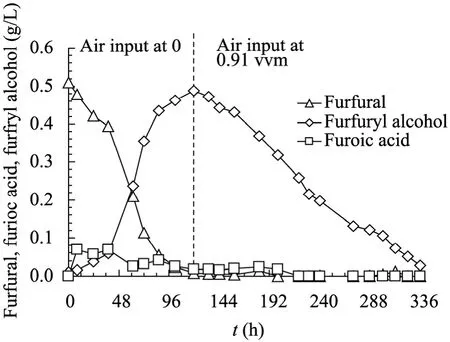
图3 两阶段通气法对A. resinae ZN1代谢糠醛的影响Fig. 3 Influence of metabolic mechanism of furfural degradation by A. resinae ZN1 with the control method of the second stage. The experiment conditions: 20% incaution, 26oC, pH 5.5, 100 r/min.
2.4 A. resinae ZN1降解糠醛代谢路径的初步解析
综合上述实验结果,本文对丝状真菌A. resinae ZN1转化糠醛和5-羟甲基糠醛的降解代谢途径进行了分析,结果见图4。糠醛首先在醛还原酶作用下快速地转化为毒性较低的糠醇;然后糠醇在醇脱氢酶作用下,再度生成不致对微生物产生危害的低浓度糠醛;然后,糠醛在醛脱氢酶作用下,继续氧化为糠酸。推测糠酸的进一步降解路径可能与Koopman等[23]提出的Cupriavidus basilensis HMF14代谢路径相似,通过进入TCA循环完成糠醛的完全降解,即糠酸在糠酰辅酶A合成酶的作用下,结合一分子的HSCoA转化为2-糠酰辅酶A (2-Furoyl-CoA);在钼依赖糠酰辅酶A脱氢酶的作用下,结合一分子水后转化为5-羟基-2-糠酰-辅酶A;通过酮-醇互变异构化,以及自发的内酯水解或者在一般的内酯水解酶的作用下转化为2-氧化戊二酸和辅酶A,2-氧化戊二酸最终进入TCA循环。
本研究推测,A. resinae ZN1的糠醛生物降解路径与前人提出的细菌中的代谢途径基本一致[23,25]。在本研究中,无论是厌氧状态还是有氧发酵,均发现糠醛也是被A. resinae ZN1的细胞摄取并且进行转化的,我们分析,发酵液中糠醛的减少应该是被A. resinae ZN1的细胞一点一点地摄入细胞内,胞外的糠醛浓度才逐渐降低,然后糠醛被快速地还原为糠醇后,高浓度的糠醇又被分泌到胞外,从而能在胞外检测到。我们认为,A. resinae ZN1的细胞是定量分批地摄入糠醛,并分泌糠醇的。因此,糠醛是被A. resinae ZN1的细胞摄取并在胞内转化的,其转化产物分别是糠醇、糠酸。考虑到糠醛的高生物毒性,A. resinae ZN1首先是将其进行快速地还原为较弱生物毒性的糠醇,然后再进行氧化反应,将高毒性抑制物的浓度维持在不影响A. resinae ZN1细胞正常生长的水平,这种脱毒方式被认为是经典的非特异性的呋喃醛脱毒机制[22]。中间产物糠醇的大量积累充当无毒性的底物泵,以供糠酸的氧化生成,糠酸是A. resinae ZN1细胞进行生长的实际底物。在本文的各项实验中,糠酸的浓度一直都不高,说明糠酸被A. resinae ZN1的细胞作为碳源以供生长繁殖所需。
本文中丝状真菌A. resinae ZN1对糠醛的降解代谢分析的结论只是初步的研究,准确的代谢路径确认还需要更多的实验数据和代谢组学研究支持。后续的工作包括A. resinae ZN1对木质纤维素预处理后的有机酸类 (乙酸、甲酸、乙酰丙酸等)、苯酚类衍生物 (香兰素、对羟基苯甲醛等) 的代谢路径分析,以及在全基因组测序基础上的荧光定量PCR和生物芯片分析等,最终的目标是将这一生物脱毒技术应用于真实木质纤维素加工过程,提高木质纤维素生物炼制的过程效率、降低纤维素乙醇的成本。
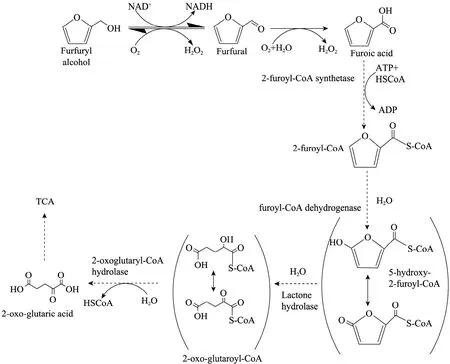
图4 A. resinae ZN1的糠醛生物降解路径[23]Fig. 4 Biodegradation pathway of furfural by A. resinae ZN1[23].
3 结论
本研究中的丝状真菌A. resinae ZN1在厌氧或者有氧状态下均可以很好地降解木质纤维素预处理后产生的呋喃抑制物糠醛。丝状真菌A. resinae ZN1转化糠醛的降解代谢途径跟前人提出的细菌中的代谢途径基本一致:糠醛首先快速地转化为毒性较低的糠醇,糠醇则再度生成不致对微生物产生危害的低浓度糠醛,糠醛继续氧化为糠酸。推测糠酸可能继续进入TCA循环,进而完成糠醛的完全降解。结果为将来加快丝状真菌A. resinae ZN1生物脱毒速率、改善限速步骤提供了重要的实验依据。
REFERENCES
[1] Stricker AR, Mach RL, Graaff LH. Regulation oftranscription of cellulases and hemicellulasesencoding genes in Aspergillus niger and Hypocrea jecorina (Trichoderma reesei). Appl Microbiol Biotechnol, 2008, 78(2): 211−220.
[2] Larsson S, Reimann A, Nilvebrant NO, et al. Comparison of different methods for the detoxification of lignocellulose hydrolysates of spruce. Appl Biochem Biotechnol, 1999, 77(1/3): 91−103.
[3] Jørgensen H, KristensenJB, FelbyC. Enzymatic conversion of lignocellulose into fermentable sugars: challenges and opportunities. Biofuels Bioprod Bioref, 2007, 1(2): 119−134.
[4] Almeida JR, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae. J Chem Technol Biotechnol, 2007, 82(4): 340−349.
[5] Klinke HB, Thomsen AB, Ahring BK. Inhibition of ethanol-producing yeast and bacteria by degradation products produced during pre-treatment of biomass. Appl Microbiol Biotechnol, 2004, 66(1): 10−26.
[6] Jing XY, Zhang XX, Bao J. Inhibition performance of lignocellulose degradation products on industrial cellulase enzymes during cellulose hydrolysis. Appl Biochem Biotechnol, 2009, 159(3): 697−707.
[7] Palmqvist E, Hahn-Hägerdal B. Fermentation of lignocellulosic hydrolysates. I.Inhibition and detoxification. Bioresour Technol, 2000, 74(1): 17−24.
[8] Martinez A, Rodriguez ME, Wells ML, et al. Detoxification of dilute acid hydrolysates of lignocellulose with lime. Biotechnol Progr, 2001, 17(2): 287−293.
[9] Jönsson LJ, Palmqvist E, Nilvebrant NO, et al. Detoxification of wood hydrolysates with laccase and peroxidase from the white-rot fungus Trametes versicolor. Appl Microbiol Biotechnol, 1998, 49(6): 691−697.
[10] Yu J, Stahl H. Microbial utilization and biopolyester synthesis of bagasse hydrolysates. Bioresour Technol, 2008, 99(17): 8042−8048.
[11] Nichols NN, Dien BS, Cotta MA. Fermentation of bioenergy crops into ethanol using biological abatement for removal of inhibitors. Bioresour Technol, 2010, 101(19): 7545−7550.
[12] Jönsson LJ, Palmqvist E, Nilvebrant NO, et al. Detoxification of wood hydrolysates with laccase and peroxidase from the white-rot fungus Trametes versicolor. Appl Microbiol Biotechnol, 1998, 49(6): 691−697.
[13] Nichols NN, Dien BS, Guisado GM, et al. Bioabatement to remove inhibitors from biomass-derived sugar hydrolysis. Appl Biochem Biotechnol, 2005, 121: 379−390.
[14] Dong HW, Bao J. Biofuel via biodetoxification. Nat Chem Biol, 2010, 5(6): 317−318.
[15] Zhang J, Zhu ZN, Wang XF, et al. Biodetoxification of toxins generated from lignocellulose pretreatment using a newly isolated fungus, Amorphotheca resinae ZN1, and the consequent ethanol fermentation. Biotechnol Biofuels, 2010, 3: 26.
[16] Zhang J, Chu DQ, Yu ZC, et al. Process strategy for ethanol production from lignocellulose feedstock under extremely low water usage and high solids loading conditions. Chin J Biotech, 2010, 26(7): 950−959.张建, 楚得强, 于占春, 等. 低水用量约束条件下的高固体含量纤维乙醇生物加工技术策略. 生物工程学报, 2010, 26(7): 950−959.
[17] Converti A, Perego P, Domínguez JM. Xylitol production from hardwood hemicellulose hydrolyzates by Pachysolen tannophilus, Debaryomyces hanseniie, and Candida guilliermondii. Appl Biochem Biotechnol, 1999, 82(2): 141−151.
[18] Brune G, Schoberth SM, Sahm H. Growth of a strictly anaerobic bacterium on furfural (2-furaldehyde). App1 Environ Microbio1, 1983, 46(5): 1187−1192.
[19] Taherzadeh MJ, Gustafsson L, Niklasson C, et al. Conversion of furfural in aerobic and anaerobicbatch fermentation of glucose by Saccharomyces cerevisiae. J Biosci Bioeng, 1999, 87(2): 169−174.
[20] Belay N, Boopathy R, Voskuilen G. Anaerobic transformation of furfural by Methanococcus deltae (Delta) LH. App1 Environ Microbio1, 1997, 63(5): 2092−2094.
[21] Nichols NN, Sharma LN, Mowery RA, et al. Fungal metabolism of fermentation inhibitors present in corn stover dilute acid hydrolysate. Enzyme Microb Technol, 2008, 42(7): 624−630.
[22] Wierckx N, Koopman F, Luaine B, et al. Isolation and characterization of Cupriavidus basilensis HMF14 for biological removal of inhibitors from lignocellulosic hydrolysate. Microbial Biotechnol, 2010, 3(3): 336−343.
[23] Koopman F, Wierckx N, Johannes HW, et al. Identification and characterization of the furfural and 5-(hydroxymethyl) furfural degradation pathways of Cupriavidus basilensis HMF14. Proc Natl Acad Sci USA, 2010, 107(11): 4919−4924.
[24] Boopathy R, Bokang H, Daniels L. Biotransformation of furfural and 5-hydroxymethyl furfural by enteric bacteria. J Ind Microbiol, 1993, 11(3): 147−150.
[25] Nichols NN, Mertens JA. Identification and transcriptional profiling of Pseudomonas putida genes involved in furoic acid metabolism. FEMS Microbiol Lett, 2008, 284(1): 52−57.
Furfural degradation by filamentous fungus Amorphotheca resinae ZN1
Xiaofeng Wang, Jian Zhang, Xiujuan Xin, and Jie Bao
State Key Laboratory of Bioreactor Engineering, School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China
Some degradation products from lignocellulose pretreatment strongly inhibit the activities of cellulolyticenzymes and ethanol fermentation strains, thus the efficient removal of the inhibitor substances (“detoxification”) is the inevitable step for the biotransformation processes. In this study, the biological detoxification of furfural by a newly isolated fungus, Amorphotheca resinae ZN1, was studied and the metabolic pathways of furfural degradation was analyzed. The metabolic pathway of furfural degradation in A. resinae ZN1 was described as follows: first, furfural was quickly converted into the low toxic furfuryl alcohol; then the furfuryl alcohol was gradually converted into furfural again but under the low concentration under aerobic condition, which was not lethal to the growth of the fungi; furfural continued to be oxidized to furoic acid by A. resinae ZN1. It is likely that furoic acid was further degraded in the TCA cycle to complete the biological degradation of furfural. The present study provided the important experimental basis for speeding up the biodetoxification of furfural by A. resinae ZN1 and the rate-limiting step in the lignocellulose biotransformation to ethanol.
metabolic pathway, biodetoxification, furfural, lignocellulose
January 18, 2012; Accepted: June 13, 2012
Jie Bao. Tel: +86-21-64251799; E-mail: jbao@ecust.edu.cn
王晓凤, 张建, 辛秀娟, 等. 丝状真菌Amorphotheca resinae ZN1的糠醛降解代谢分析. 生物工程学报, 2012, 28(9): 1070−1079.
Wang XF, Zhang J, Xin XJ, et al. Furfural degradation by filamentous fungus Amorphotheca resinae ZN1. Chin JBiotech, 2012, 28(9): 1070−1079.
Supported by: National Basic Research Program of China (No. 2011CB707406), National Natural Science Foundation of China (No. 20976051), China Postdoctoral Science Foundation (No. 2011M500742), Fundamental Research Funds for the Central Universities of China (No. WF0913005), Shanghai Leading Academic Discipline Project (No. B505).
国家重点基础研究发展计划 (973计划) (No. 2011CB707406),国家自然科学基金 (No. 20976051),中国博士后基金 (No. 2011M500742),中央高校基本科研业务费专项资金 (No. WF0913005),上海市重点学科建设项目 (No. B505) 资助。

